WikiDer > Видимое молярное свойство
An кажущееся молярное свойство из решение Компонент в смеси или растворе - это количество, определенное с целью изолировать вклад каждого компонента в неидеальность смеси. Он показывает изменение соответствующего свойства решения (например, объем) когда весь этот компонент добавлен в раствор, на моль добавленного компонента. Он описывается как очевидный потому что он, кажется, представляет молярные свойства этого компонента в растворепри условии, что свойства других компонентов раствора остаются постоянными во время добавления. Однако это предположение часто не оправдано, поскольку значения кажущихся молярных свойств компонента могут сильно отличаться от его молярных свойств в чистом состоянии.
Например, объем раствора, содержащего два идентифицированных компонента[1] в качестве растворитель и растворенное вещество дается
куда V0 это объем чистого растворителя перед добавлением растворенного вещества и это молярный объем (при той же температуре и давлении, что и раствор), п0 это количество родинки растворителя, кажущийся молярный объем растворенное вещество, и п1 число молей растворенного вещества в растворе. Разделив это отношение на молярное количество одного компонента, можно получить соотношение между кажущимся молярным свойством компонента и соотношением компонентов в смеси.
Это уравнение служит определением . Первый член равен объему того же количества растворителя без растворенного вещества, а второй член - это изменение объема при добавлении растворенного вещества. можно тогда рассматривать как молярный объем растворенного вещества если предполагается что молярный объем растворителя не изменяется при добавлении растворенного вещества. Однако это предположение часто следует считать нереалистичным, как показано в примерах ниже, так что описывается только как очевидный ценить.
Кажущееся молярное количество может быть аналогично определено для компонента, идентифицированного как растворитель. . Некоторые авторы сообщили об очевидных молярных объемах обоих (жидких) компонентов одного и того же раствора.[2][3] Эта процедура может быть распространена на трехкомпонентные и многокомпонентные смеси.
Кажущиеся количества также могут быть выражены через массу вместо числа молей. Это выражение дает кажущиеся конкретные величины, такие как кажущийся удельный объем.
где конкретные количества обозначены строчными буквами.
Кажущиеся (молярные) свойства не являются постоянными (даже при заданной температуре), но зависят от состава. В бесконечности разбавление, очевидные молярные свойства и соответствующие частичное молярное свойство стать равными.
Некоторые очевидные молярные свойства, которые обычно используются, - это кажущиеся молярные энтальпия, кажущийся моляр теплоемкость, и кажущийся молярный объем.
Отношение к моляльности
Кажущийся (молярный) объем растворенного вещества можно выразить как функцию моляльность б этого растворенного вещества (и плотностей раствора и растворителя). Объем раствора на моль растворенного вещества составляет
Вычитание объема чистого растворителя на моль растворенного вещества дает кажущийся молярный объем:
Для большего количества растворенных веществ указанное выше равенство модифицируется средней молярной массой растворенных веществ, как если бы они были одним растворенным веществом с моляльностью bТ:
- ,
Сумма молярностей продуктов - кажущиеся молярные объемы растворенных веществ в их бинарных растворах равняется произведению между суммой молярностей растворенных веществ и кажущимся молярным объемом в тройном многокомпонентном растворе, упомянутом выше.
- ,
Отношение к соотношению смешивания
Связь между кажущимся молярным компонентом смеси и молярным соотношением компонентов смеси может быть получена путем деления соотношения определения
к количеству молей одного компонента. Это дает следующее соотношение:
Отношение к парциальным (молярным) количествам
Обратите внимание на противоположные определения между парциальным молярным количеством и кажущимся молярным количеством: в случае парциальных молярных объемов , определяется
- ,
мы можем написать , и так всегда держит. Напротив, при определении кажущегося молярного объема молярный объем чистого растворителя, , вместо этого используется, что можно записать как
- ,
для сравнения. Другими словами, мы предполагаем, что объем растворителя не изменяется, и мы используем парциальный молярный объем, в котором количество молей растворенного вещества точно равно нулю («молярный объем»). Таким образом, в определяющем выражении кажущегося молярного объема ,
- ,
период, термин относится к чистому растворителю, а «оставшийся» избыточный объем, , считается происходящим из растворенного вещества. При большом разбавлении , у нас есть , поэтому кажущийся молярный объем и парциальный молярный объем растворенного вещества также сходятся: .
Количественно соотношение между частичными молярными свойствами и кажущимися свойствами можно вывести из определения кажущихся величин и моляльности. Для объема
Связь с коэффициентом активности электролита и номером его сольватной оболочки
Соотношение ра между кажущимся молярным объемом растворенного электролита в концентрированном растворе и молярным объемом растворителя (воды) можно связать со статистической составляющей коэффициент активности электролита и его сольватационная оболочка номер час:[4]
,
где ν - количество ионов за счет диссоциации электролита.
Примеры
Электролиты
Кажущийся молярный объем соли обычно меньше молярного объема твердой соли. Например, твердый NaCl имеет объем 27 см3 на моль, но кажущийся молярный объем при низких концентрациях составляет всего 16,6 см 3 / моль. Фактически, некоторые водные электролиты имеют отрицательные кажущиеся молярные объемы: NaOH −6.7, LiOH −6.0 и Na2CO3 −6,7 см3/крот.[5] Это означает, что их растворы в данном количестве воды имеют меньший объем, чем такое же количество чистой воды. (Однако эффект невелик.) Физическая причина в том, что близлежащие молекулы воды сильно притягиваются к ионам, поэтому они занимают меньше места.
Алкоголь
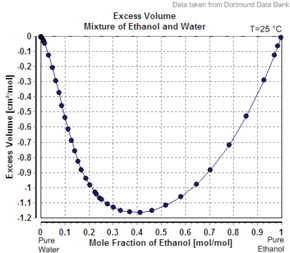
Другим примером кажущегося молярного объема второго компонента меньше его молярного объема как чистого вещества является случай этиловый спирт в воде. Например, в 20 массовые проценты этиловый спирт, раствор имеет объем 1,0326 л / кг при 20 ° C, а чистая вода - 1,0018 л / кг (1,0018 см3 / г).[6] Кажущийся объем добавленного этанола составляет 1,0326 л - 0,8 кг x 1,0018 л / кг = 0,2317 л. Число молей этанола составляет 0,2 кг / (0,04607 кг / моль) = 4,341 моль, так что кажущийся молярный объем составляет 0,2317 L / 4,341 моль = 0,0532 л / моль = 53,2 см3 / моль (1,16 см3 / г). Однако чистый этанол имеет молярный объем при этой температуре 58,4 см 3 / моль (1,27 см 3 / г).
Если бы решение было идеальный, его объем будет суммой несмешанных компонентов. Объем 0,2 кг чистого этанола составляет 0,2 кг x 1,27 л / кг = 0,254 л, а объем 0,8 кг чистой воды составляет 0,8 кг x 1,0018 л / кг = 0,80144 л, поэтому идеальный объем раствора будет 0,254 л + 0,80144 L = 1,055 л. Неидеальность раствора отражается в небольшом уменьшении (примерно 2,2%, 1,0326, а не 1,055 л / кг) объема объединенной системы при смешивании. Когда процентное содержание этанола приближается к 100%, кажущийся молярный объем увеличивается до молярного объема чистого этанола.
Электролит - неэлектролитные системы
Кажущиеся количества могут подчеркивать взаимодействия в системах электролит - неэлектролит, которые проявляют такие взаимодействия, как засолка и высаливание, но также дают представление о ион-ионных взаимодействиях, особенно по их зависимости от температуры.
Многокомпонентные смеси или растворы
Для многокомпонентных растворов кажущиеся молярные свойства можно определить несколькими способами. Для объема тройной (3-компонентный) раствор с одним растворителем и двумя растворенными веществами в качестве примера, все равно будет только одно уравнение , что недостаточно для определения двух кажущихся объемов. (Это в отличие от частичные молярные свойства, которые четко определены интенсивные свойства материалов и, следовательно, однозначно определены в многокомпонентных системах. Например, для каждого компонента определяется парциальный молярный объем. я в качестве .)
Одно описание тройных водных растворов рассматривает только средневзвешенный кажущийся молярный объем растворенных веществ,[7] определяется как
- ,
куда объем раствора и объем чистой воды. Этот метод может быть расширен для смесей, содержащих более 3 компонентов.[8]
- ,
Сумма молярностей продуктов - кажущиеся молярные объемы растворенных веществ в их бинарных растворах равняется произведению между суммой молярностей растворенных веществ и кажущимся молярным объемом в трехкомпонентном многокомпонентном растворе, упомянутом выше.
- ,
Другой метод - рассматривать троичную систему как псевдобинарный и определить кажущийся молярный объем каждого растворенного вещества со ссылкой на бинарную систему, содержащую оба других компонента: воду и другое растворенное вещество.[9] Тогда кажущиеся молярные объемы каждого из двух растворенных веществ
- и
Кажущийся молярный объем растворителя составляет:
Однако это неудовлетворительное описание объемных свойств.[10]
Кажущийся молярный объем двух компонентов или растворенных веществ, рассматриваемых как один псевдокомпонент или же не следует путать с объемами частичных бинарных смесей с одним общим компонентом Vij, Vjk которые смешались с некоторыми соотношение смешивания образуют определенную тройную смесь V или же Vijk.[требуется разъяснение]
Конечно, дополнительный объем компонента по отношению к другим компонентам смеси может быть определен как разница между объемом смеси и объемом бинарной субмеси данного состава, например:
Бывают ситуации, когда нет точного способа определить, что является растворителем, а какое растворенным, как в случае жидких смесей (например, воды и этанола), которые могут растворять твердое вещество, такое как сахар или соль, а какие нет. В этих случаях кажущиеся молярные свойства можно и нужно приписывать всем компонентам смеси.
Смотрите также
- Объемная доля
- Идеальное решение
- Обычное решение
- Изменение энтальпии раствора
- Энтальпия смешения
- Блочный дизайн
- Теплота разбавления
- Энергия гидратации
- Ионный транспортный номер
- Оболочка сольватации
- Частичное молярное свойство
- Избыточное молярное количество
- Соление в
- Тернарный сюжет
- Термодинамическая активность
Рекомендации
- ^ Эта маркировка произвольна. Для смесей двух жидкостей любая может быть описана как растворитель. Для смесей жидкости и твердого вещества жидкость обычно идентифицируется как растворитель, а твердое вещество - как растворенное вещество, но теория все еще верна, если пометки поменять местами.
- ^ Рок, Питер А., Химическая термодинамика, MacMillan 1969, стр. 227-230 для смесей вода-этанол.
- ^ Газоян Г.Г. и Ш. А. Маркарян (2014) ПЛОТНОСТЬ, ПРЕВЫШАЮЩИЕ МОЛЯРНЫЕ И ЧАСТИЧНЫЕ МОЛЯРНЫЕ ОБЪЕМЫ ДЛЯ ДИЭТИЛСУЛЬФОКСИДА С БИНАРНЫМИ СИСТЕМАМИ МЕТАНОЛА И ЭТАНОЛА В ДИАПАЗОНЕ ТЕМПЕРАТУР 298,15 - 323,15 К ТРУДЫ ЕРЕВАНСКОГО ГОСУДАРСТВЕННОГО УНИВЕРСИТЕТА №2, с.17-25. См. Таблицу 4.
- ^ Глюкауф, Э. (1955). «Влияние ионной гидратации на коэффициенты активности в концентрированных растворах электролитов». Труды общества Фарадея. 51: 1235–1244. Дои:10.1039 / TF9555101235.
- ^ Герберт Харнед и Бентон Оуэн, Физическая химия электролитических растворов., 1950, с. 253.
- ^ Рассчитано на основе данных 49-го издания CRC Handbook of Chemistry and Physics.
- ^ Лимонная кислота Апельблат, Александр (Springer 2014) стр.50 ISBN 978-3-319-11233-6
- ^ Харнед, Оуэн, указ. соч. третье издание 1958 г., стр. 398–399
- ^ Лимонная кислота Апельблат стр.320
- ^ Апельблат стр.320
внешняя ссылка
- Видимые молярные свойства: Решения: Фон
- Свойства (p, ρ, T) и кажущиеся молярные объемы этанольных растворов LiI или ZnCl2
- Кажущиеся мольные объемы и кажущаяся мольная теплоемкость Pr (NO3) 3 (водн.), Gd (NO3) 3 (водн.), Ho (NO3) 3 (водн.) И Y (NO3) 3 (водн.) При T = (288,15 , 298,15, 313,15 и 328,15) K и p = 0,1 МПа
- Изотопные эффекты для видимых свойств электролитов