WikiDer > Флюориназа
| Фториназа (аденозилфторидсинтаза) | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 2.5.1.63 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
В фториназа фермент (ЕС 2.5.1.63, также известная как аденозилфторидсинтаза) катализирует реакция между фторид ион и кофактор S-аденозил-L-метионин чтобы генерировать L-метионин и 5'-фтор-5'-дезоксиаденозин, первый предопределенный продукт пути биосинтеза фторметаболитов.[1] Первоначально фториназа была выделена из почвенной бактерии. Streptomyces cattleya, но с тех пор гомологи были идентифицированы у ряда других видов бактерий, включая Streptomyces sp. MA37, Nocardia brasiliensis и Актинопланы sp. N902-109.[2] Это единственный известный фермент, способный катализировать образование углерод-фторной связи, самой прочной одинарной связи в органической химии.[3]

Гомологичный хлориназа фермент, который катализирует ту же реакцию с хлоридом, а не с фторид-ионом, был выделен из Salinospora tropica, из биосинтетического пути салиноспорамид А.[4]
Реактивность
Фториназа катализирует SN2нуклеофильное замещение -типа в положении C-5 'SAM, в то время как L-метионин действует как нейтральная уходящая группа.[5][6] Реакция, катализируемая фториназой, оценивается между 106[6] до 1015[7] раз быстрее, чем некаталитическая реакция, значительное увеличение скорости. Несмотря на это, фториназа по-прежнему считается медленным ферментом с номер оборота (kКот) 0,06 мин.−1.[8] Высокий кинетический барьер реакции объясняется сильной сольватацией фторид-иона в воде, что приводит к высокой энергии активации, связанной с отрывом сольватирующих молекул воды от водного фторид-иона, превращая фторид в мощный нуклеофил в активном центре.
Реакция, катализируемая фториназой, обратима, и при инкубации 5'-фтор-5'-дезоксиаденозина и L-метионина с фториназой образуются SAM и фторид-ион.[9] Замена L-метионина на L-селенометионин приводит к 6-кратному увеличению скорости обратной реакции,[9] из-за возросшего нуклеофильность центра селена по сравнению с центром серы.
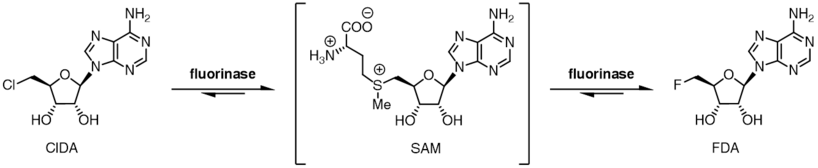
Фториназа демонстрирует определенную степень устойчивости субстрата к галогенид-ионам, а также может использовать хлорид-ион вместо фторид-иона. В то время как равновесие для реакции между SAM и фторид-ионом находится в отношении продуктов FDA и L-метионина, в случае хлорид-иона положение равновесия меняется на противоположное. Инкубация SAM и хлорид-иона с фториназой не приводит к образованию 5'-хлор-5'-дезоксиаденозина (ClDA), если только дополнительный фермент L-аминокислотная оксидаза, добавлен. Аминокислотная оксидаза удаляет L-метионин из реакции, превращая его в соответствующую оксокислоту.

Предпочтение галогенидов в сочетании с положением двух реакционных равновесий позволяет ферменту катализировать чистую реакцию трансгалогенирования.[9] Инкубация 5'-хлорнуклеозидов с ферментом вместе с каталитическим L-селенометионином или L-метионином приводит к образованию 5-фторнуклеозидов. Когда [18F] фторид используется, это реакция трансгалогенирования может быть использован для синтеза радиоиндикаторы за позитронно-эмиссионная томография.[10][11]
Структурные исследования
На конец 2007 г. 9 структуры были решены для этого класса ферментов, с PDB коды доступа 1RQP, 1RQR, 2C2W, 2C4T, 2C4U, 2C5B, 2C5H, 2CBX, и 2CC2.
Названия, данные ферменту, происходят не от структуры, а от функции: 5-фтор-5-дезоксиаденозин - это синтезированная молекула. Структура гомологична duf-62 ферментный ряд. Фермент представляет собой димер тримеров (2 молекулы с тремя субъединицами в каждой). Активные сайты расположены между этими субъединицами (интерфейсами субъединиц), каждый может связываться с одной молекулой SAM за раз.[12]
Биосинтез фторметаболитов
Этот раздел пуст. Вы можете помочь добавляя к этому. (Ноябрь 2015) |
Смотрите также
Рекомендации
- ^ а б О'Хаган Д., Шаффрат С., Кобб С.Л., Гамильтон Дж. Т., Мерфи CD (март 2002 г.). «Биохимия: биосинтез молекулы фторорганического соединения». Природа. 416 (6878): 279. Дои:10.1038 / 416279a. PMID 11907567.
- ^ Дэн Х., Ма Л., Бандаранака Н., Цинь З., Манн Дж., Кьереме К., Ю Й, Шеперд Т., Нейсмит Дж. Х., О'Хаган Д. (февраль 2014 г.). «Идентификация флюориназ из Streptomyces sp MA37, Norcardia brasiliensis и Actinoplanes sp N902-109 путем анализа генома». ChemBioChem. 15 (3): 364–8. Дои:10.1002 / cbic.201300732. PMID 24449539.
- ^ О'Хаган Д. (февраль 2008 г.). «Понимание химии фторорганических соединений. Введение в связь C-F». Обзоры химического общества. 37 (2): 308–19. Дои:10.1039 / b711844a. PMID 18197347.
- ^ Eustáquio AS, Pojer F, Noel JP, Moore BS (январь 2008 г.). «Открытие и характеристика морской бактериальной SAM-зависимой хлориназы». Природа Химическая Биология. 4 (1): 69–74. Дои:10.1038 / nchembio.2007.56. ЧВК 2762381. PMID 18059261.
- ^ Cadicamo CD, Courtieu J, Deng H, Meddour A, O'Hagan D (май 2004 г.). «Ферментативное фторирование в Streptomyces cattleya происходит с инверсией конфигурации в соответствии с механизмом реакции SN2». ChemBioChem. 5 (5): 685–90. Дои:10.1002 / cbic.200300839. PMID 15122641.
- ^ а б Сенн Х.М., О'Хаган Д., Тиль В. (октябрь 2005 г.). «Понимание ферментативного образования связи C-F из расчетов QM и QM / MM». Журнал Американского химического общества. 127 (39): 13643–55. Дои:10.1021 / ja053875s. PMID 16190730.
- ^ Ломан, округ Колумбия, Эдвардс Д.Р., Вольфенден Р. (октябрь 2013 г.). «Катализ путем десольватации: каталитические свойства SAM-зависимых галогенид-алкилирующих ферментов». Журнал Американского химического общества. 135 (39): 14473–5. Дои:10.1021 / ja406381b. PMID 24041082.
- ^ Чжу X, Робинсон Д.А., Макьюэн А.Р., О'Хаган Д., Нейсмит Дж. Х. (ноябрь 2007 г.). «Механизм ферментативного фторирования у Streptomyces cattleya». Журнал Американского химического общества. 129 (47): 14597–604. Дои:10.1021 / ja0731569. ЧВК 3326528. PMID 17985882.
- ^ а б c Денг Х., Кобб С.Л., Макьюэн А.Р., МакГлинчи Р.П., Нейсмит Дж. Х., О'Хаган Д., Робинсон Д.А., Спенсер Дж. Б. (январь 2006 г.). «Фториназа из Streptomyces cattleya также является хлориназой». Angewandte Chemie. 45 (5): 759–62. Дои:10.1002 / anie.200503582. ЧВК 3314195. PMID 16370017.
- ^ Дэн Х., Кобб С.Л., Джи А.Д., Локхарт А., Мартарелло Л., МакГлинчи Р.П., О'Хаган Д., Онега М (февраль 2006 г.). «Опосредованное фториназой образование связи C- (18) F, ферментативный инструмент для мечения ПЭТ». Химические коммуникации. 0 (6): 652–4. Дои:10.1039 / b516861a. PMID 16446840.
- ^ Томпсон С., Онега М., Эшворт С., Флеминг И.Н., Пассьер Дж., О'Хаган Д. (сентябрь 2015 г.). «Двухступенчатое мечение фермента фториназы (18) F пептида RGD для позитронно-эмиссионной томографии». Химические коммуникации. 51 (70): 13542–5. Дои:10.1039 / c5cc05013h. PMID 26221637.
- ^ Донг С., Хуанг Ф., Дэн Х., Шаффрат С., Спенсер Дж. Б., О'Хаган Д., Нейсмит Дж. Х. (февраль 2004 г.). «Кристаллическая структура и механизм бактериального фторирующего фермента». Природа. 427 (6974): 561–5. Дои:10.1038 / природа02280. PMID 14765200.