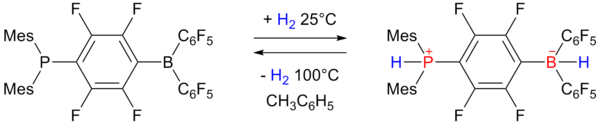WikiDer > Хранение водорода
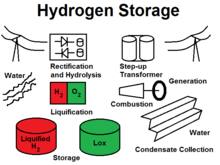
Хранение водорода это термин, используемый для любого из нескольких методов хранения водород для дальнейшего использования. Эти методы охватывают механические подходы, такие как высокое давление и низкие температуры, или химические соединения, которые выделяют H2 по запросу. Хотя производится большое количество водорода, он в основном потребляется на месте производства, особенно для синтеза аммиак. На протяжении многих лет водород хранится в виде сжатого газа или криогенный жидкость и транспортируется как таковая в цилиндрах, трубках и криогенных резервуарах для использования в промышленности или в качестве топлива в космических программах. Интерес к использованию водорода для хранения энергии на борту транспортных средств с нулевым уровнем выбросов побуждает к разработке новых методов хранения, более адаптированных к этому новому применению. Общей проблемой является очень низкая температура кипения H2: она составляет около 20,268 ° C. K (-252,882 ° C или -423,188 ° F). Достижение таких низких температур требует значительных затрат энергии.
Установленные технологии
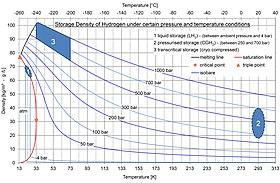
Сжатый и сжиженный водород
Сжатый водород представляет собой форму хранения, при которой газообразный водород хранится под давлением для увеличения плотности хранения. Сжатый водород в водородных баках под давлением 350 бар (5000 фунтов на квадратный дюйм) и 700 бар (10000 фунтов на квадратный дюйм) используется в системах водородных резервуаров в транспортных средствах на основе углеродно-композитной технологии типа IV.[1] Это решение разрабатывают производители автомобилей, например Honda.[2] или Nissan.[3]
Сжиженный
Жидкий водород цистерны для автомобилей, производящих например BMW Водород 7. В Японии есть хранилище жидкого водорода (LH2) в порту Кобе.[4] Водород сжижается за счет снижения его температуры до -253 ° C, как и сжиженный природный газ (СПГ), который хранится при -162 ° C. Потенциальная потеря эффективности может составлять 12,79%, или 4,26 кВтч / кг из 33,3 кВтч / кг.[5]
Химическое хранение
Хранение химикатов может обеспечить высокую производительность хранения из-за высокой плотности хранения. Например, сверхкритический водород при 30 ° C и 500 бар имеет плотность только 15,0 моль / л, в то время как метанол имеет плотность 49,5 моль H2/ Л метанола и насыщенного диметиловый эфир при 30 ° C и 7 бар имеет плотность 42,1 моль H2/ Л диметилового эфира.
Регенерация хранящегося материала проблематична. Было исследовано большое количество систем хранения химикатов. Высвобождение H2 может быть вызвано гидролиз реакции или катализируемые реакции дегидрирования. Иллюстративными запасными соединениями являются углеводороды, гидриды бора, аммиак, и алан и Т. Д.[6] Наиболее перспективным химическим подходом является электрохимическое хранение водорода, поскольку его выделение можно контролировать с помощью приложенного электричества.[7] Большинство материалов, перечисленных ниже, можно напрямую использовать для электрохимического хранения водорода.
Как было показано ранее, наноматериалы предлагают преимущество для систем хранения водорода. Наноматериалы предлагают альтернативу, которая преодолевает два основных барьера, связанных с сыпучими материалами: скорость сорбции и температуру высвобождения.
Улучшение кинетики сорбции и емкости хранения можно улучшить за счет катализатор на основе наноматериалов допинга, как показано в работе Исследовательского центра чистой энергии в Университет Южной Флориды.[8] Эта исследовательская группа изучала LiBH4 допированный никель наночастиц и проанализировали потерю веса и температуру высвобождения различных видов. Они заметили, что увеличение количества нанокатализатора снижает температуру высвобождения примерно на 20 ° C и увеличивает потерю веса материала на 2-3%. Было обнаружено, что оптимальное количество частиц Ni составляет 3 мол.%, Для которых температура находится в установленных пределах (около 100 ° C), а потеря веса заметно больше, чем у нелегированных частиц.
Скорость сорбции водорода улучшается на наномасштабе за счет короткого распространение расстояние по сравнению с сыпучими материалами. У них также есть благоприятные отношение площади поверхности к объему.
Температура высвобождения материала определяется как температура, при которой десорбция процесс начинается. Энергия или температура, вызывающие высвобождение, влияют на стоимость любой стратегии хранения химикатов. Если водород связан слишком слабо, давление, необходимое для регенерации, будет высоким, что сводит на нет экономию энергии. Целевой показатель для бортовых водородных топливных систем составляет примерно <100 ° C для выброса и <700 бар для перезарядки (20-60 кДж / моль H2).[9] Модифицированный уравнение Ван'та Гоффа, связывает температуру и парциальное давление водорода в процессе десорбции. Модификации стандартного уравнения связаны с размерными эффектами в наномасштабе.
Где пЧАС2 - парциальное давление водорода, ΔЧАС это энтальпия процесса сорбции (экзотермический), ΔS изменение в энтропия, р это идеал газовая постоянная, T - температура в Кельвинах, Vм это молярный объем металла, р - радиус наночастицы и γ это поверхностная свободная энергия частицы.
Из приведенного выше соотношения мы видим, что изменение энтальпии и энтропии процессов десорбции зависит от радиуса наночастицы. Кроме того, включен новый термин, который учитывает удельную площадь поверхности частицы, и можно математически доказать, что уменьшение радиуса частицы приводит к снижению температуры высвобождения для данного парциального давления.[10]
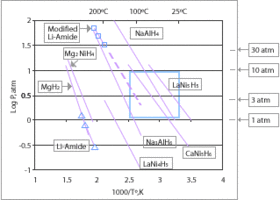
Гидриды металлов
Гидриды металлов, Такие как MgH2, NaAlH4, LiAlH4, LiH, ЛаНи5ЧАС6, TiFeH2, аммиачный боран, и гидрид палладия представляют собой источник хранимого водорода. И снова постоянными проблемами являются процентный вес H2, который они несут, и обратимость процесса хранения.[11] Некоторые из них легко заправляются жидкостью при температуре и давлении окружающей среды, тогда как другие представляют собой твердые частицы, которые можно превратить в гранулы. Эти материалы имеют хорошие плотность энергиихотя их удельная энергия часто хуже, чем ведущий углеводород топливо.
Альтернативный метод понижения температуры диссоциации - легирование активаторами. Эта стратегия использовалась для гидрид алюминия, но сложный синтез делает подход непривлекательным.[13]
Предлагаемые гидриды для использования в водородной экономике включают простые гидриды магний[14] или же переходные металлы и комплексные гидриды металлов, обычно содержащие натрий, литий, или же кальций и алюминий или же бор. Гидриды, выбранные для хранения, обладают низкой реакционной способностью (высокой безопасностью) и высокой плотностью хранения водорода. Ведущие кандидаты гидрид лития, борогидрид натрия, литийалюминийгидрид и аммиачный боран. Французская компания McPhy Energy разрабатывает первый промышленный продукт на основе гидрида магния, который уже продан некоторым крупным клиентам, таким как Iwatani и ENEL.
Обратимое хранение водорода демонстрирует разочарованная пара Льюиса, который дает борогидрид.[15][16][17]
Фосфиноборан слева принимает один эквивалент водорода при одной атмосфере и температуре 25 ° C и снова удаляет его при нагревании до 100 ° C. Емкость составляет 0,25 мас.%.
Алюминий
Водород можно получить из алюминия, реагируя с водой.[18] Однако для реакции с водой алюминий должен быть лишен его естественной окись слой, процесс, требующий измельчения,[19] химические реакции с едкими веществами или сплавами.[20] Побочным продуктом реакции образования водорода является оксид алюминия, который можно переработать обратно в алюминий с помощью Процесс Холла-Эру, что делает реакцию теоретически возобновляемой. Однако для этого требуется электролиз, который потребляет большое количество энергии.
Органические носители водорода
Ненасыщенные органические соединения могут хранить огромное количество водорода. Эти Жидкие носители органического водорода (LOHC) гидрируют для хранения и снова дегидрируют, когда требуется энергия / водород. Используя LOHC, можно достичь относительно высоких плотностей гравиметрического хранения (около 6 мас.%), А общая энергоэффективность выше, чем для других вариантов хранения химических веществ, таких как производство метана из водорода.[21] И гидрирование, и дегидрирование LOHC требует катализаторов.[22] Было продемонстрировано, что замена углеводородов гетероатомами, такими как N, O и т. Д., Улучшает свойства обратимой де / гидрогенизации.
Циклоалканы
Исследования LOHC были сосредоточены на циклоалканах на ранней стадии с их относительно высокой водородной емкостью (6-8 мас.%) И образованием CO.Икс-свободный водород.[22] Гетероциклические ароматические соединения (или N-гетероциклы) также подходят для этой задачи. Соединение, показанное в исследовании LOHC, является N-этилкарбазол (NEC)[23] но существуют и многие другие.[24] Дибензилтолуол, который уже используется в качестве теплоносителя в промышленности, был идентифицирован как потенциальный LOHC. В качестве материала LOHC идеально подходит дибензилтолуол, имеющий широкий диапазон жидкостей от -39 ° C (точка плавления) до 390 ° C (точка кипения) и плотность хранения водорода 6,2 мас.%.[25] Муравьиная кислота был предложен в качестве многообещающего материала для хранения водорода с емкостью по водороду 4,4 мас.%.[26]
Циклоалканы, обозначенные как LOHC, включают циклогексан, метилциклогексан и декалин. Дегидрирование циклоалканов сильно эндотермично (63-69 кДж / моль H2), что означает, что для этого процесса требуется высокая температура.[22] Дегидрирование декалина является наиболее термодинамически предпочтительным из трех циклоалканов, а метилциклогексан занимает второе место из-за наличия метильной группы.[27] Исследования по разработке катализаторов дегидрирования циклоалканов ведутся десятилетиями. Катализаторы на основе никеля (Ni), молибдена (Mo) и платины (Pt) хорошо изучены на предмет дегидрирования. Однако коксование по-прежнему является серьезной проблемой для долгосрочной стабильности катализатора.[28][29]
Предлагается альтернативный, новаторский и многообещающий подход к преобразованию водорода, связанного с LOHC, в электричество, который представляет собой безопасную последовательность без выбросов CO2, без ввода внешней энергии и без молекулярного водорода в любой момент во время выделения водорода.[30] Новая последовательность разгрузки состоит из почти термонейтрального катализатора. перенос гидрирования ступенчатое преобразование кетон (ацетон) к вторичный спирт (2-пропанол) при контакте с носителем, богатым водородом, и вторичный спирт затем непосредственно расходуется в PEMFC (DIPAFC, топливный элемент прямого действия изопрапанола).[30][31] При таком подходе может иметь смысл с экономической точки зрения использовать водород как химическое вещество, а не как носитель энергии.[32] «Топливный элемент прямого действия LOHC», основанный на концепции соединения LOHC-DIPAFC, является очень привлекательным решением для бортовой генерации электроэнергии в мобильных приложениях.[30]
N-гетероциклы
Температура, необходимая для гидрирования и дегидрирования, значительно падает для гетероциклов по сравнению с простыми карбоциклами.[33] Среди всех N-гетероциклов насыщенная-ненасыщенная пара додекагидро-N-этилкарбазол (12H-NEC) и NEC рассматривается как многообещающий кандидат для хранения водорода с довольно большим содержанием водорода (5,8 мас.%).[34] На рисунке вверху справа показано дегидрирование и гидрирование пары 12H-NEC и NEC. Стандартный катализатор для превращения NEC в 12H-NEC - это Ru и Rh. Селективность гидрирования может достигать 97% при 7 МПа и 130 ° C-150 ° C.[22] Хотя N-гетероцилы могут оптимизировать неблагоприятные термодинамические свойства циклоалканов, многие вопросы остаются нерешенными, такие как высокая стоимость, высокая токсичность, кинетические барьеры и т. Д.[22]
Ионные жидкости имидазолия, такие как соли алкил (арил) -3-метилимидазолия N-бис (трифторметансульфонил) имидата, могут обратимо добавлять 6–12 атомов водорода в присутствии классических катализаторов на основе наночастиц Pd / C или Ir0 и могут использоваться в качестве альтернативных материалов для бортовые накопители водорода. Эти соли могут содержать до 30 г л.−1 водорода при атмосферном давлении.[35]
Муравьиная кислота
Муравьиная кислота является высокоэффективным материалом для хранения водорода, хотя его плотность H2 невысока. Водород, не содержащий окиси углерода, образуется в очень широком диапазоне давлений (1–600 бар). Гомогенная каталитическая система на основе водорастворимых рутениевых катализаторов селективно разлагает HCOOH на H2 и CO2 в водном растворе.[36] Эта каталитическая система преодолевает ограничения других катализаторов (например, низкая стабильность, ограниченный срок службы катализатора, образование CO) для разложения муравьиной кислоты, что делает ее жизнеспособным материалом для хранения водорода.[37] И побочный продукт этого разложения, диоксид углерода, можно использовать в качестве переносчика водорода, гидрируя его обратно до муравьиной кислоты на второй стадии. Каталитическое гидрирование CO2 давно изучается и разработаны эффективные процедуры.[38][39] Муравьиная кислота содержит 53 г л.−1 водород при комнатной температуре и атмосферном давлении. Чистая муравьиная кислота по массе содержит 4,3 мас.% Водорода. Чистая муравьиная кислота представляет собой жидкость с температурой вспышки 69 ° C (для бензина -40 ° C, этанола 13 ° C). 85% муравьиная кислота не горюч.
Углеводы
Углеводы (полимерный C6ЧАС10О5) выпускает H2 в биореформаторе, опосредованном коктейлем ферментов - бесклеточный синтетический путь биотрансформации. Углеводы обеспечивают высокую плотность хранения водорода в виде жидкости с умеренным повышением давления и криогенными ограничениями: он также может храниться в виде твердого порошка. Углеводы - это самый распространенный возобновляемый биоресурс в мире.
Аммиак
Аммиак (NH3) выпускает H2 в соответствующей установке каталитического риформинга. Аммиак обеспечивает высокую плотность хранения водорода в виде жидкости с умеренным повышением давления и криогенными ограничениями: он также может храниться в жидком виде при комнатной температуре и давлении при смешивании с водой. Аммиак является вторым наиболее часто производимым химическим веществом в мире, и существует большая инфраструктура для производства, транспортировки и распределения аммиака. Аммиак можно преобразовать для получения водорода без вредных отходов или его можно смешивать с существующим топливом и при правильных условиях сжигать эффективно. Поскольку в аммиаке нет углерода, не образуются побочные углеродные продукты; тем самым делая эту возможность «углеродно-нейтральным» вариантом на будущее. Чистый аммиак плохо горит при атмосферном давлении в водонагревателях и печах, работающих на природном газе. При сжатии в автомобильном двигателе это подходящее топливо для немного модифицированных бензиновых двигателей. Аммиак является подходящим альтернативным топливом, поскольку он имеет удельную энергию 18,6 МДж / кг на NTP и безуглеродные побочные продукты сгорания.[40]
Аммиак имеет несколько проблем, связанных с его повсеместной адаптацией в качестве материала для хранения водорода. Аммиак - ядовитый газ с сильным запахом при стандартной температуре и давлении.[41] Кроме того, для обеспечения коммерческой жизнеспособности необходимы достижения в области эффективности и масштабируемости разложения аммиака, поскольку мембраны топливных элементов очень чувствительны к остаточному аммиаку, а современные методы разложения имеют низкие показатели выхода.[42] Для катализа реакции разложения аммиака можно использовать различные переходные металлы, наиболее эффективным из которых является рутений. Этот катализ работает через хемосорбция, где энергия адсорбции N2 меньше энергии реакции диссоциации.[43] Очистку водорода можно осуществить несколькими способами. Водород можно отделить от непрореагировавшего аммиака с помощью проницаемой водородоселективной мембраны.[44] Его также можно очистить путем адсорбции аммиака, который может избирательно улавливаться из-за его полярности.[45]
В сентябре 2005 г. химики из Технический университет Дании объявил о способе хранения водорода в виде аммиак насыщенный в солевую таблетку. Они утверждают, что это будет недорогой и безопасный способ хранения.[46]
Гидразин
Гидразин распадается в клетке, чтобы сформировать азот и водород/[47] Гидриды кремния и гидриды германия также являются кандидатами в качестве материалов для хранения водорода, поскольку они могут подвергаться энергетически благоприятной реакции с образованием ковалентно связанных димеров с потерей молекулы водорода.[48][49]
Бораны амина
До 1980 года были исследованы несколько соединений на предмет хранения водорода, включая сложные боргидриды или алюмогидриды и соли аммония. Эти гидриды имеют верхний теоретический выход водорода, ограниченный примерно 8,5% по массе. Среди соединений, содержащих только B, N и H (как положительные, так и отрицательные ионы), характерные примеры включают: аминобораны, аммониаты гидрида бора, гидразин-борановые комплексы и октагидротрибораты или тетрагидробораты аммония. Из них аминобораны (и особенно аммиачный боран) широко исследовались как переносчики водорода. В течение 1970-х и 1980-х годов армия и военно-морской флот США финансировали усилия, направленные на разработку соединений, генерирующих водород / дейтерий, для использования в химикатах HF / DF и HCl. лазеры, и газодинамические лазеры. Ранее в составах, генерирующих водородный газ, использовались аминобораны и их производные. Воспламенение борана (ами) форм нитрид бора (BN) и газообразный водород. Помимо аммиачного борана (H3BNH3), другие газогенераторы включают диаммониат диборана, H2B (NH3)2BH4.
Физическая память
В этом случае водород остается в физических формах, то есть в виде газа, сверхкритического флюида, адсорбата или молекулярных включений. Рассмотрены теоретические ограничения и экспериментальные результаты. [50]касательно объемной и гравиметрической емкости стеклянных микрососудов, микропористых и нанопористых сред, а также требований безопасности и времени наполнения.
Пористый или слоистый углерод
Активированные угли представляют собой высокопористые аморфные углеродные материалы с большой кажущейся площадью поверхности. Водород физическая адсорбция может быть увеличен в этих материалах за счет увеличения кажущейся площади поверхности и оптимизации диаметра пор примерно до 7 Å.[51] Эти материалы представляют особый интерес в связи с тем, что они могут быть изготовлены из отходов, таких как окурки сигарет, которые показали большой потенциал в качестве исходных материалов для материалов для хранения водорода большой емкости.[52][53]
Графен может эффективно хранить водород. H2 добавляет к двойным связям, давая графан. Водород выделяется при нагревании до 450 ° C.[54][55]
Носители водорода на основе наноструктурированного углерода (например, углерода Buckyballs и нанотрубки) Были предложены. Однако содержание водорода составляет ~ 3,0-7,0 мас.% При 77 К, что далеко от значения, установленного Министерством энергетики США (6 мас.% При почти окружающих условиях).
Чтобы реализовать углеродные материалы в качестве эффективных технологий хранения водорода, углеродные нанотрубки (УНТ) были легированы MgH2.[8] Доказано, что гидрид металла имеет теоретическую емкость накопления (7,6 мас.%), Которая удовлетворяет требованиям Министерство энергетики США требуется 6 мас.%, но имеет ограниченное практическое применение из-за высокой температуры высвобождения. Предлагаемый механизм предполагает создание каналов быстрой диффузии с помощью CNT в пределах MgH2 решетка. Фуллерен другие углеродистые наноматериалы, которые были протестированы на хранение водорода в этом центре. Молекулы фуллерена состоят из C60 структура с закрытыми каркасами, которая позволяет гидрогенизировать двойные углеродные связи, приводя к теоретическому C60ЧАС60 изомер с содержанием водорода 7,7% мас. Однако температура выпуска в этих системах высока (600 ° C).
Металлоорганические каркасы
Металлоорганические каркасы представляют собой другой класс синтетических пористых материалов, хранящих водород и энергию на молекулярном уровне. MOF - это высококристаллические неорганические-органические гибридные структуры, которые содержат металлические кластеры или ионы (вторичные строительные единицы) в качестве узлов и органические лиганды в качестве линкеров. Когда гостевые молекулы (растворитель), занимающие поры, удаляются во время замены растворителя и нагревания в вакууме, пористая структура MOF может быть достигнута без дестабилизации каркаса, и молекулы водорода будут адсорбироваться на поверхности пор посредством физической сорбции. По сравнению с традиционными цеолитами и пористыми углеродными материалами, MOF имеют очень большое количество пор и площадь поверхности, которые обеспечивают более высокое поглощение водорода в заданном объеме. Таким образом, исследовательские интересы по хранению водорода в MOF растут с 2003 года, когда было введено первое хранилище водорода на основе MOF. Поскольку существует бесконечное количество геометрических и химических вариаций MOF, основанных на различных комбинациях SBU и линкеров, многие исследователи исследуют, какая комбинация обеспечит максимальное поглощение водорода различными материалами, содержащими ионы металлов и линкеры.
В 2006 году химики на UCLA и университет Мичигана достигли концентрации накопления водорода до 7,5 мас.% в MOF-74 при низкой температуре 77 K.[56][57] В 2009 году исследователи из Ноттингемский университет достигала 10 мас.% при 77 бар (1117 фунтов на квадратный дюйм) и 77 К с MOF NOTT-112.[58] В большинстве статей о хранении водорода в MOF сообщается о способности поглощения водорода при температуре 77K и давлении 1 бар, поскольку эти условия обычно доступны, а энергия связи между водородом и MOF при этой температуре велика по сравнению с энергией тепловых колебаний. Варьирование нескольких факторов, таких как площадь поверхности, размер пор, катенация, структура лиганда и чистота образца, может привести к разному поглощению водорода в MOF.
В 2020 году исследователи из Северо-Западного университета в США сообщили, что NU-1501-Al, сверхпористый металлорганический каркас (MOF) на основе металлических трехъядерных кластеров, продемонстрировал «впечатляющие гравиметрические и объемные характеристики накопления водорода и метана» с водородом. производительность 14,0% по массе, 46,2 г / л.[59] [60]
Крио-сжатый
Хранение водорода в криосжатом состоянии - единственная технология, которая соответствует целям Министерства энергетики США на 2015 год по объемной и гравиметрической эффективности (см. «CcH2» на слайде 6 в [61]).
Кроме того, другое исследование показало, что криосжатие демонстрирует интересные преимущества с точки зрения затрат: стоимость владения (цена за милю) и стоимость системы хранения (цена за автомобиль) на самом деле самые низкие по сравнению с любой другой технологией (см. Третью строку на слайде 13 документа). [62]). Например, система крио-сжатого водорода будет стоить 0,12 доллара за милю (включая стоимость топлива и все другие сопутствующие расходы), в то время как обычные бензиновые автомобили стоят от 0,05 до 0,07 доллара за милю.
Как и при хранении жидкости, при криосжатии используется холодный водород (20,3 К и немного выше) для достижения высокой плотности энергии. Однако основное отличие состоит в том, что, когда водород нагревается из-за теплопередачи с окружающей средой («выкипает»), в резервуаре может быть повышено давление до гораздо более высоких (до 350 бар по сравнению с парой бар для хранение жидкости). Как следствие, требуется больше времени, прежде чем водород должен выйти, и в большинстве дорожных ситуаций автомобиль использует достаточно водорода, чтобы поддерживать давление значительно ниже предела вентиляции.
Следовательно, было продемонстрировано, что большой запас хода может быть достигнут с помощью криокомпрессированного бака: более 650 миль (1050 км) было проехано с полным баком, установленным на водородном двигателе. Toyota Prius.[63] Исследования все еще продолжаются, чтобы изучить и продемонстрировать весь потенциал технологии.[64]
С 2010 года BMW Group начала тщательную проверку на уровне компонентов и систем криокомпрессированного хранилища транспортных средств на пути к коммерческому продукту.[65]
Клатрат гидраты
ЧАС2 в клетке в клатрат гидрат впервые было сообщено в 2002 году, но для стабильности требуется очень высокое давление. В 2004 г. исследователи из Делфтский технологический университет и Колорадская горная школа показал твердую H2-содержащие гидраты могут образовываться при температуре окружающей среды и 10 с бар путем добавления небольших количеств промотирующих веществ, таких как THF.[66] Эти клатраты имеют теоретическую максимальную плотность водорода около 5 мас.% И 40 кг / м3.3.
Стеклянные капиллярные решетки
Группа ученых из России, Израиля и Германии совместно разработала инновационную технологию на основе стеклянных капиллярных матриц для безопасной инфузии, хранения и контролируемого высвобождения водорода в мобильных приложениях.[67][68] Технология C.En достигла Министерство энергетики США (DOE) Цели на 2010 год для бортовых систем хранения водорода.[69]Цели DOE 2015 могут быть достигнуты с помощью гибких стеклянных капилляров и криокомпрессированного метода хранения водорода.[70]
Стеклянные микросферы
Пустой стеклянные микросферы (HGM) можно использовать для контролируемого хранения и выделения водорода. ПТГ диаметром от 1 до 100 мкм, плотностью от 1,0 до 2,0 г / см3 и пористой стенкой с отверстиями от 10 до 1000 ангстремы рассматриваются для хранения водорода. Преимущества HGM для хранения водорода заключаются в том, что они нетоксичны, легки, дешевы, пригодны для вторичной переработки, обратимы, легко обрабатываются в атмосферных условиях, могут храниться в резервуаре, а водород внутри не взрывоопасен. [71] Каждый из этих ПТГ способен содержать водород до 150 МПа, не будучи тяжелым и громоздким, как большой резервуар под давлением. Все эти качества благоприятны для автомобильного применения. Помимо этих преимуществ, HGM рассматриваются как возможное решение проблемы водорода из-за водорода. диффузионность имеющий большую температурную зависимость. При комнатной температуре коэффициент диффузии очень низок, и водород задерживается в HGM. Недостаток HGM в том, что они заполняют и выхлопные газы водород эффективно, температура должна быть не менее 300 ° C, что значительно увеличивает эксплуатационные расходы HGM при хранении водорода.[72] Отчасти высокая температура может быть связана с тем, что стекло изолятор и имея низкий теплопроводность; это препятствует водороду диффузионность и поэтому требуется более высокая температура для достижения желаемой производительности.
Чтобы сделать эту технологию более экономически жизнеспособной для коммерческого использования, проводятся исследования по увеличению эффективность водорода распространение через HGM. Одно исследование, проведенное Dalai et al. стремился увеличить теплопроводность HGM через допинг стакан с кобальт. При этом они увеличили теплопроводность от 0,0072 до 0,198 Вт / м-К при 10 мас.% Со. Увеличение содержания водорода адсорбция хотя наблюдались только до 2 мас.% Со (0,103 Вт / м-К) в качестве оксид металла начал закрывать поры в стеклянной оболочке. Это исследование завершилось тем, что емкость накопления водорода составила 3,31 мас.% С 2 мас.% Со при 200 ° C и 10 бар.[71]
Исследование, проведенное Раппом и Шелби, стремилось увеличить скорость выделения водорода за счет фотоиндуцированного выделения газа в легированных HGM по сравнению с традиционными методами нагрева. Стекло было легировано оптически активный металлы для взаимодействия с высокоинтенсивным Инфракрасный свет. Исследование показало, что 0,5 мас.% Fe3О4 легированный 7070 боросиликатное стекло имеет увеличение выделения водорода пропорционально интенсивности инфракрасной лампы. Помимо улучшения коэффициента диффузии только за счет инфракрасного излучения, реакции между водородом и стеклом, легированным железом, увеличивали Fe2+/ Fe3+ соотношение, которое увеличивает поглощение инфракрасного излучения, следовательно, дополнительно увеличивает выход водорода.[73]
По состоянию на 2020 год прогресс, достигнутый в изучении HGM, повысил его эффективность, но все еще не соответствует целям Министерства энергетики в отношении этой технологии. Рабочие температуры как для адсорбции, так и для выделения водорода являются самым большим препятствием для коммерциализация. [74]
Стационарное хранилище водорода
В отличие от мобильных приложений, плотность водорода не является большой проблемой для стационарных приложений. Что касается мобильных приложений, стационарные приложения могут использовать установленные технологии:
- Сжатый водород (CGH2) в водородный бак[75]
- Жидкий водород в (LH2) криогенный водородный бак
- Слякоть водород в криогенном водородном резервуаре
Подземное хранилище водорода
Подземное хранилище водорода практика хранения водорода в пещеры, соляные купола и истощенные нефтяные и газовые месторождения. Большие количества газообразного водорода хранились в пещерах ICI много лет без всяких сложностей.[77] Хранение больших количеств жидкого водорода под землей может функционировать как сетевое хранилище энергии. Эффективность приема-передачи составляет примерно 40% (против 75-80% для гидроаккумулятор (PHES)), а стоимость немного выше, чем у гидроаккумулятора, если требуется только ограниченное количество часов хранения.[78] Другое исследование, на которое ссылается рабочий документ европейского персонала, показало, что для крупномасштабного хранилища самым дешевым вариантом является водород по цене 140 евро / МВтч в течение 2000 часов хранения с использованием электролизера, хранилища соляной пещеры и электростанции с комбинированным циклом.[76]:15 Европейский проект Hyunder[79] в 2013 г. указали, что для хранения энергии ветра и солнца необходимы дополнительные 85 каверн, поскольку они не могут быть покрыты PHES и CAES системы.[80] Немецкое тематическое исследование по хранению водорода в соляных пещерах показало, что если избыток электроэнергии в Германии (7% от общей переменной возобновляемой генерации к 2025 году и 20% к 2050 году) будет преобразован в водород и хранится под землей, для этих количеств потребуется около 15 каверн. по 500 000 кубометров каждая к 2025 г. и около 60 каверн к 2050 г., что соответствует примерно одной трети количества газовых каверн, действующих в настоящее время в Германии.[81] В США Sandia Labs проводит исследования по хранению водорода на истощенных нефтяных и газовых месторождениях, которые могут легко поглощать большое количество возобновляемого водорода, поскольку существует около 2,7 миллионов истощенных скважин.[82]
Мощность на газ
Мощность на газ это технология, которая преобразует электрические мощность на газ топливо. Есть два метода: первый - использовать электричество для расщепление воды и закачать полученный водород в сеть природного газа; второй, менее эффективный метод используется для преобразования углекислый газ и водород к метан, (видеть натуральный газ) с помощью электролиз и Сабатье реакция. Третий вариант - объединить водород посредством электролиза с источником углерода (диоксидом углерода или оксидом углерода из биогаз, из промышленных процессов или через диоксид углерода, улавливаемый прямым воздухом) через биометанирование,[83][84] где биометаногены (археи) потребляют углекислый газ и водород и производят метан в пределах анаэробный среда. Этот процесс очень эффективен, так как археи самовоспроизводятся и требуют только низкопотенциального тепла (60 ° C) для проведения реакции.
Другой процесс также был достигнут SoCalGas преобразование диоксида углерода в неочищенном биогазе в метан за один электрохимический этап, представляющий собой более простой метод преобразования избыточной возобновляемой электроэнергии в пригодный для хранения природный газ.[85]
Великобритания завершила исследования и готовится начать закачку водорода в газовую сеть, так как ранее в сеть подавался «городской газ», который на 50% состоит из водородно-метанового газа, образованного из угля. Аудиторы KPMG обнаружили, что перевод Великобритании на газообразный водород может обойтись на 150–200 млрд фунтов стерлингов дешевле, чем переоборудование британских домов для использования электрического отопления с использованием источников с более низким содержанием углерода.[86]
Избыточная мощность или внепиковая мощность, генерируемая ветряными генераторами или солнечными батареями, затем может использоваться для балансировки нагрузки в энергосистеме. Используя существующую систему природного газа для водорода, производитель топливных элементов Гидрогеника и дистрибьютор природного газа Enbridge объединились, чтобы разработать такой мощность на газ система в Канаде.[87]
Трубопроводное хранилище водорода, где сеть природного газа используется для хранения водорода. Перед переходом на натуральный газ, газовые сети Германии эксплуатировались с использованием Towngas, который большей частью (60-65%) состоял из водорода. Емкость газовой сети Германии составляет более 200 000 ГВт · ч, чего хватает на несколько месяцев потребности в энергии. Для сравнения, мощность всех немецких гидроаккумулирующих электростанций составляет всего около 40 ГВт · ч. Транспортировка энергии по газовой сети осуществляется с гораздо меньшими потерями (<0,1%), чем в электрической сети (8%). Использование существующих трубопроводы природного газа для водорода был изучен NaturalHy[88]
Автомобильное бортовое хранилище водорода

Цели были поставлены FreedomCAR Партнерство в январе 2002 г. между Советом США по автомобильным исследованиям (USCAR) и Министерство энергетики США (Цели предполагают 5-кг H2 система хранения). В 2005 году цели на 2005 год не были достигнуты.[90] Цели были пересмотрены в 2009 году, чтобы отразить новые данные об эффективности системы, полученные от парка тестовых автомобилей.[91] Конечная цель для объемного хранения все еще выше теоретической плотности жидкого водорода.[92][требуется разъяснение][неудачная проверка]
Важно отметить, что эти цели предназначены для системы хранения водорода, а не для материала для хранения водорода. Плотность системы часто составляет примерно половину плотности рабочего материала, поэтому в то время как в материале может храниться 6 вес% ЧАС2, рабочая система, использующая этот материал, может достигать только 3 мас.%, если учесть вес резервуаров, оборудования для контроля температуры и давления и т. д.
В 2010 году только две технологии хранения были определены как имеющие потенциал для достижения целей Министерства энергетики США: MOF-177 превышает целевой показатель 2010 года по объемной емкости, в то время как криосжатый H2 превышает более строгие целевые показатели на 2015 год как по весовым, так и по объемным показателям (см. слайд 6 в [61]).
Существующие варианты хранения водорода требуют больших объемов хранения, что делает их непрактичными для стационарных и переносных приложений. Портативность - одна из самых больших проблем в автоматизированная индустрия, где системы хранения с высокой плотностью хранения проблематичны из соображений безопасности.
Транспортные средства на топливных элементах должны обеспечивать запас хода более 300 миль - этого нельзя достичь с помощью традиционных методов хранения. Долгосрочная цель, поставленная Управлением технологий топливных элементов, включает использование наноматериалов для увеличения максимальной дальности действия.[93]
Требования Министерства энергетики США
Министерство энергетики поставило цели по хранению водорода на борту легковых автомобилей. В перечень требований входят параметры, касающиеся гравиметрической и объемной вместимости, работоспособности, прочности и стоимости. Эти цели были поставлены в качестве цели многолетнего плана исследований, который, как ожидается, предложит альтернативу ископаемым видам топлива.[94]
Топливные элементы и хранение
Благодаря своим характеристикам экологически чистого горения водород является одной из самых многообещающих альтернативных топлив в автомобильной промышленности. Топливо на водородной основе может значительно снизить выбросы парниковые газы такие как CO2, ТАК2 и нетИкс. Три ограничивающих фактора для использования водородные топливные элементы (HFC) включают эффективность, размер и безопасное хранение газа на борту. Другие основные недостатки этой новой технологии связаны с проблемами стоимости, работоспособности и долговечности, которые еще предстоит улучшить по сравнению с существующими системами. Для решения этих проблем было предложено использование наноматериалов в качестве альтернативы традиционным системам хранения водорода. Использование наноматериалов может обеспечить систему с более высокой плотностью, которая, как ожидается, увеличит предел диапазона движения, установленный DOE на 300 миль. Углеродистые материалы, такие как CNT и гидриды металлов - основное внимание исследователей. Углеродистые материалы в настоящее время рассматриваются для бортовых систем хранения из-за их универсальности, многофункциональности, механических свойств и низкой стоимости по сравнению с другими альтернативами.[95]
Другие преимущества наноматериалов в топливных элементах
Использование наноматериалов в бортовых системах хранения водорода может стать поворотным моментом в автомобильной промышленности. Однако хранение - не единственный практический аспект топливного элемента, в котором наноматериалы могут вносить свой вклад. Различные исследования показали, что транспорт и каталитические свойства из Нафион мембраны, используемые в ГФУ можно улучшить с помощью TiO2/SnO2 наночастицы.[95] Повышенная производительность вызвана улучшением расщепления водорода. кинетика из-за каталитическая активность наночастиц. Кроме того, эта система демонстрирует более быструю транспортировку протоны через ячейку, что делает ГФУ с композитными мембранами наночастиц является многообещающей альтернативой.
Другое применение наноматериалов в расщеплении воды было предложено исследовательской группой в Манчестерский столичный университет в Великобритании с использованием трафаретной печати электроды состоящий из графен-подобный материал.[96] Подобные системы были разработаны с использованием фотоэлектрохимические методы.
Смотрите также
- Каскадная система хранения
- Криоадсорбция
- Электрохимический компрессор водорода
- Гидрогенография
- Водородная энергетическая установка в Дании
- Промышленный газ
- Настраиваемый нанопористый углерод
Рекомендации
- ^ Эберле, Ульрих; Мюллер, Бернд; фон Гельмольт, Риттмар (2012). «Электромобили на топливных элементах и водородная инфраструктура: статус 2012». Энергетика и экология. 5 (10): 8780. Дои:10.1039 / C2EE22596D. Получено 2014-12-19.
- ^ "FCX Clarity". Honda в мире. Получено 2012-01-08.
- ^ "Модель X-TRAIL FCV '03". Nissan-global.com. Архивировано из оригинал на 2010-09-17. Получено 2012-01-08.
- ^ Саввидес, Ник (2017-01-11). «Япония планирует использовать импортный сжиженный водород для топлива Олимпийских игр 2020 года в Токио». Справедливо. Морской портал IHS Markit. Получено 22 апреля 2018.
- ^ Садагиани, Мирхади С. (2 марта 2017 г.). «Внедрение и энергетический анализ новой конфигурации процесса криогенного сжижения водорода». Международный журнал водородной энергетики. 42 (9): 6033–6050. Дои:10.1016 / j.ijhydene.2017.01.136.
- ^ Сунита, Сатьяпал (2007). «Национальный проект по хранению водорода Министерства энергетики США: прогресс в удовлетворении требований к водородным транспортным средствам». Катализ сегодня. 120 (3–4): 246–256. Дои:10.1016 / j.cattod.2006.09.022.
- ^ Эфтехари, Али; Байцзэн, Фанг (2017). «Электрохимическое хранение водорода: возможности для хранения топлива, аккумуляторов, топливных элементов и суперконденсаторов». Международный журнал водородной энергетики. 42 (40): 25143–25165. Дои:10.1016 / j.ijhydene.2017.08.103.
- ^ а б Niemann, Michael U .; Srinivasan, Sesha S .; Phani, Ayala R .; Кумар, Ашок; Госвами, Д. Йоги; Стефанакос, Элиас К. (2008). «Наноматериалы для хранения водорода: обзор». Журнал наноматериалов. 2008: 1–9. Дои:10.1155/2008/950967.
- ^ Хранение водорода в ЕС. (PDF). Проверено 8 января 2012.
- ^ Сунандана, К.С. (2007). «Наноматериалы для хранения водорода». Резонанс. 12 (5): 31–36. Дои:10.1007 / s12045-007-0047-9. S2CID 118701455.
- ^ DOE Гидриды металлов. eere.energy.gov (19 декабря 2008 г.). Проверено 8 января 2012.
- ^ Кристиан, Меганн; Агей-Зинсу, Кондо Франсуа (2012). «Стратегия Core – Shell, ведущая к высокой емкости обратимого хранения водорода для NaBH4». САУ Нано. 6 (9): 7739–7751. Дои:10.1021 / nn3030018. PMID 22873406.
- ^ Graetz, J .; Reilly, J .; Sandrock, G .; Johnson, J .; Zhou, W. M .; Wegrzyn, J. (2006). «Гидрид алюминия, A1H3, как соединение для хранения водорода». Дои:10.2172/899889. Цитировать журнал требует
| журнал =(помощь) - ^ CNRS Institut Neel H2 Storage. Neel.cnrs.fr. Проверено 8 января 2012.
- ^ Welch, G.C .; Juan, R.R.S .; Masuda, J.D .; Стефан, Д. В. (2006). «Обратимая безметалловая водородная активация». Наука. 314 (5802): 1124–6. Bibcode:2006Научный ... 314.1124W. Дои:10.1126 / science.1134230. PMID 17110572. S2CID 20333088.
- ^ Элизабет Уилсон Активация H2, обратимо Соединение, не содержащее металлов, легко разрушается и выделяет водород, Новости химии и машиностроения 20 ноября, 2006
- ^ Mes означает мезитил заместитель и C6F5 для пентафторфенильной группы см. также трис (пентафторфенил) бор
- ^ Белая книга: новый метод хранения энергии в сети с использованием алюминиевого топлива В архиве 2013-05-31 в Wayback Machine, Alchemy Research, апрель 2012 г.
- ^ «Открытие армии может предложить новый источник энергии | Исследовательская лаборатория армии США». www.arl.army.mil. Архивировано из оригинал на 2018-07-09. Получено 2018-07-09.
- ^ «Новый процесс генерирует водород из алюминиевого сплава для работы двигателей и топливных элементов». Phys.org.
- ^ Мюллер, Бенджамин (2011). "Energiespeicherung mittels Methan und energietragenden Stoffen - ein thermodynamischer Vergleich" [Хранение энергии с помощью CO2 Метанизация и энергоносители: термодинамическое сравнение. Chemie Ingenieur Technik (на немецком). 83 (11): 2002–2013. Дои:10.1002 / cite.201100113.
- ^ а б c d е Он, Тэн; Пей, Цицзюнь; Чен, Пинг (01.09.2015). «Жидкие носители органического водорода». Журнал Энергетической Химии. 24 (5): 587–594. Дои:10.1016 / j.jechem.2015.08.007.
- ^ Тейхманн, Даниэль; Арльт, Вольфганг; Вассершайд, Питер; Фрейманн, Раймонд (2011). «Энергоснабжение будущего на основе жидких органических водородов (LOHC)». Энергетика и экология. 4 (8): 2767–2773. Дои:10.1039 / C1EE01454D.
- ^ Патент США 7351395, «Хранение водорода путем обратимого гидрирования пи-конъюгированных субстратов»
- ^ Брюкнер, Николь (2013). «Оценка применяемых в промышленности жидкостей-теплоносителей как систем жидкого органического носителя водорода». ChemSusChem. 7 (1): 229–235. Дои:10.1002 / cssc.201300426. PMID 23956191.
- ^ Грасеманн, Мартин; Лауренци, Габор (18 июля 2012 г.). «Муравьиная кислота как источник водорода - последние разработки и будущие тенденции». Энергетика и экология. 5 (8): 8171–8181. Дои:10.1039 / C2EE21928J.
- ^ Ван, Бо; Гудман, Д. Уэйн; Фромент, Гилберт Ф. (25 января 2008 г.). «Кинетическое моделирование получения чистого водорода из декалина». Журнал катализа. 253 (2): 229–238. Дои:10.1016 / j.jcat.2007.11.012.
- ^ Кария, Нобуко; Фукуока, Ацуши; Итикава, Масару (10.07.2002). «Эффективное выделение водорода из жидких циклоалканов над Pt-содержащими катализаторами, нанесенными на активные угли, в« влажно-сухих многофазных условиях »."". Прикладной катализ A: Общие. 233 (1–2): 91–102. Дои:10.1016 / S0926-860X (02) 00139-4.
- ^ Йолкулар, Севим; Ольгун, Озден (01.11.2008). «Катализаторы Ni / Al2O3 и их активность в дегидрировании метилциклогексана для получения водорода». Катализ сегодня. Избранные доклады с сессии Европейского общества водорода EUROPACAT VIII, Турку, Финляндия, 26–31 августа 2007 г. 138 (3–4): 198–202. Дои:10.1016 / j.cattod.2008.07.020.
- ^ а б c Сиеви, Габриэль; Гебуртиг, Дениз (24.05.2019). «На пути к концепции эффективных топливных элементов с жидким органическим водородом». Энергетика и экология. 12 (7): 2305–2314. Дои:10.1039 / C9EE01324E.
- ^ Хауэнштейн, Паскаль; Сибергер, Доминик (2020). «Высокоэффективный прямой органический топливный элемент, использующий систему жидкого органического носителя водорода ацетон / изопропанол». Электрохимические коммуникации. 118: 106786. Дои:10.1016 / j.elecom.2020.106786.
- ^ Мюллер, Карстен; Тиле, Саймон; Вассершайд, Питер (2019). «Оценка концепций интеграции топливных элементов в системы жидкого органического носителя водорода». Энергия и топливо. 33: 10324–10330. Дои:10.1021 / acs.energyfuels.9b01939.
- ^ Сгусток, Эрик; Эйзенштейн, Одиллия; Крэбтри, Роберт Х. (30 мая 2007 г.). «Вычислительная структура – активность отношения в хранении H2: как размещение атомов N влияет на температуры высвобождения в органических жидких материалах хранения». Химические коммуникации. 0 (22): 2231–2233. Дои:10.1039 / B705037B. PMID 17534500.
- ^ Эблагон, Катаржина Морава; Там, Кин; Цанг, Шик Чи Эдман (2012). «Сравнение каталитических характеристик нанесенных рутения и родия на гидрирование 9-этилкарбазола для хранения водорода». Энергетика и экология. 5 (9): 8621. Дои:10.1039 / C2EE22066K.
- ^ Stracke, Marcelo P .; Эбелинг, Гюнтер; Каталония, Ренато; Дюпон, Джэртон (2007). «Материалы для хранения водорода на основе имидазолиевых ионных жидкостей». Энергия и топливо. 21 (3): 1695–1698. Дои:10.1021 / ef060481t.
- ^ Fellay, C; Дайсон, П.Дж.; Лауренци, G (2008). «Жизнеспособная система хранения водорода, основанная на избирательном разложении муравьиной кислоты с рутениевым катализатором». Angewandte Chemie International Edition на английском языке. 47 (21): 3966–8. Дои:10.1002 / anie.200800320. PMID 18393267.
- ^ Ф. Джо (2008). «Прорыв в хранении водорода - муравьиная кислота как устойчивый материал для хранения водорода». ChemSusChem. 1 (10): 805–8. Дои:10.1002 / cssc.200800133. PMID 18781551.
- ^ П. Г. Джессоп, в Справочник по гомогенному гидрированию (Ред .: J. G. de Vries, C. J. Elsevier), Wiley-VCH, Weinheim, Германия, 2007С. 489–511.
- ^ П. Г. Джессоп; Ф. Джо; К.-К. Тай (2004). «Последние достижения в области гомогенного гидрирования диоксида углерода». Обзоры координационной химии. 248 (21–24): 2425. Дои:10.1016 / j.ccr.2004.05.019.
- ^ АВЕРИ, В. (1988). «Роль аммиака в водородной экономике». Международный журнал водородной энергетики. 13 (12): 761–773. Дои:10.1016/0360-3199(88)90037-7. ISSN 0360-3199.
- ^ Аммиачная экономика В архиве 2008-05-13 на Wayback Machine. Memagazine.org (10 июля 2003 г.). Проверено 8 января 2012.
- ^ Lamb, Krystina E .; Долан, Майкл Д .; Кеннеди, Даниэль Ф. (05.02.2019). «Аммиак для хранения водорода; Обзор каталитического разложения аммиака, отделения и очистки водорода». Международный журнал водородной энергетики. 44 (7): 3580–3593. Дои:10.1016 / j.ijhydene.2018.12.024. ISSN 0360-3199.
- ^ Bligaard, T .; Nørskov, J. K .; Dahl, S .; Matthiesen, J .; Christensen, C.H .; Сехестед, Дж. (2004-05-15). «Соотношение Бренстеда – Эванса – Поланьи и вулканическая кривая в гетерогенном катализе». Журнал катализа. 224 (1): 206–217. Дои:10.1016 / j.jcat.2004.02.034. ISSN 0021-9517.
- ^ Долан, Майкл Д .; Виано, Дэвид М .; Лэнгли, Мэтью Дж .; Лэмб, Кристина Е. (2018-03-01). «Трубчатые ванадиевые мембраны для очистки водорода». Журнал мембрановедения. 549: 306–311. Дои:10.1016 / j.memsci.2017.12.031. ISSN 0376-7388.
- ^ Пак, Су-Джин; Ким, Бён-Джу (2005-11-15). «Удаление аммиака из активированных углеродных волокон, полученных оксифторированием». Журнал коллоидной и интерфейсной науки. 291 (2): 597–599. Дои:10.1016 / j.jcis.2005.05.012. ISSN 0021-9797.
- ^ Фокус Дания. Netpublikationer.dk (13 июня 2006 г.). Проверено 8 января 2012.
- ^ «Ликвидный актив». Инженер. 2008-01-15. Архивировано из оригинал на 2012-12-09. Получено 2015-01-09.
- ^ Zong, J., J. T. Mague и R. A. Pascal, Jr., Exceptional Steric Congestion in in, in-Bis (гидросилан), J. Am. Chem. Soc. 2013, 135, 13235-13237.
- ^ Эчеверрия, Хорхе; Ауллон, Габриэль; Альварес, Сантьяго (2017). «Межмолекулярные взаимодействия в гидридах группы 14: За пределами контактов C-H ··· H-C». Международный журнал квантовой химии. 117 (21): e25432. Дои:10.1002 / qua.25432.
- ^ Сборник водородной энергетики. Том 2: Хранение водорода, транспортировка и инфраструктура. Том в издании Woodhead Publishing Series in Energy 2016, глава 8 - Другие методы физического хранения водорода Дои:10.1016 / B978-1-78242-362-1.00008-0
- ^ Севилья, Марта; Мокая, Роберт (2014-03-21). «Применение активированного угля в хранении энергии: суперконденсаторы и хранение водорода». Energy Environ. Наука. 7 (4): 1250–1280. Дои:10.1039 / c3ee43525c. HDL:10261/140713. ISSN 1754-5706.
- ^ Бланкеншип II, Трой Скотт; Балахмар, Нора; Мокая, Роберт (2017-11-16). «Богатые кислородом микропористые угли с исключительной способностью удерживать водород». Nature Communications. 8 (1): 1545. Bibcode:2017НатКо ... 8.1545B. Дои:10.1038 / с41467-017-01633-х. ISSN 2041-1723. ЧВК 5691040. PMID 29146978.
- ^ Бланкеншип, Трой Скотт; Мокая, Роберт (2017-12-06). «Уголь, полученный из окурка сигарет, имеет сверхвысокую площадь поверхности и беспрецедентную способность удерживать водород» (PDF). Энергетика и экология. 10 (12): 2552–2562. Дои:10.1039 / c7ee02616a. ISSN 1754-5706.
- ^ Графен как подходящее вещество для хранения водорода. Physicsworld.com. Проверено 8 января 2012.
- ^ Графен в графан. Rsc.org. Январь 2009. Проверено 8 января 2012 г.
- ^ MOF-74 - потенциальное хранилище водорода. Nist.gov. Проверено 8 января 2012.
- ^ Исследователи продемонстрировали хранение 7,5% водорода в MOF. Конгресс зеленых автомобилей (2006-03-06). Проверено 8 января 2012.
- ^ Новый материал MOF с поглощением водорода до 10 мас.%. 22 февраля 2009 г.
- ^ Мэтт МакГрат (18 апреля 2020 г.). «Изменение климата: прорыв в использовании губки для ванн может сделать автомобили более чистыми». Новости BBC. Получено 19 апреля 2020.
- ^ Чжицзе Чен (2020). «Уравновешивание объемного и гравиметрического поглощения высокопористыми материалами для получения чистой энергии». Наука. 368 (6488): 297–303. Дои:10.1126 / science.aaz8881. PMID 32299950. S2CID 215789994. Получено 19 апреля 2020.
- ^ а б Р. К. Ахлувалия, Т. К. Хуа, Дж. К. Пэн и Р. Кумар Анализ системного уровня вариантов хранения водорода. Обзор водородной программы Министерства энергетики за 2010 г., Вашингтон, округ Колумбия, 8–11 июня 2010 г.
- ^ Стивен Лэшер Анализ материалов для хранения водорода и бортовых систем. Ежегодный обзор заслуг Министерства энергетики США 7–11 июня 2010 г.
- ^ S&TR | Установка мирового рекорда вождения с использованием водорода В архиве 2008-12-03 на Wayback Machine. Llnl.gov (12 июня 2007 г.). Проверено 8 января 2012.
- ^ Компактное (L) хранилище H2 с длительным режимом покоя в сосудах криогенного давления. Ливерморская национальная лаборатория имени Лоуренса 8 июня 2010 г.
- ^ Технические сессии. FISITA 2010. Проверено 8 января 2012 г.
- ^ Florusse, L.J .; Питерс, CJ; Schoonman, J; Hester, KC; Ко, Калифорния; Декабрь, SF; Марш, КН; Слоан, ЭД (2004). «Стабильные кластеры водорода низкого давления, хранящиеся в бинарном клатратном гидрате». Наука. 306 (5695): 469–71. Bibcode:2004Наука ... 306..469F. Дои:10.1126 / science.1102076. PMID 15486295. S2CID 38107525.
- ^ Жеваго, Н.К .; Глебов, В. (2007). «Хранение водорода в капиллярных решетках». Преобразование энергии и управление. 48 (5): 1554–1559. Дои:10.1016 / j.enconman.2006.11.017.
- ^ Жеваго, Н.К .; Денисов, Э.И .; Глебов, В. (2010). «Экспериментальное исследование хранения водорода в капиллярных решетках». Международный журнал водородной энергетики. 35: 169–175. Дои:10.1016 / j.ijhydene.2009.10.011.
- ^ Дэн Элиэзер и другие. Новая технология хранения водорода в капиллярных решетках. C.En & BAM
- ^ Жеваго, Н. К .; Чабак, А. Ф .; Денисов, Э. И .; Глебов, В. И .; Коробцев, С. В. (2013). «Хранение криосжатого водорода в гибких стеклянных капиллярах». Международный журнал водородной энергетики. 38 (16): 6694–6703. Дои:10.1016 / j.ijhydene.2013.03.107.
- ^ а б Далай, Шридхар; Савитри, Виджаялакшми (26 октября 2017 г.). «Исследование влияния загрузки кобальта на теплопроводность и водородную способность полых стеклянных микросфер (ПГС)». MaterialsToday: Материалы. 4 (11): 11608–11616. Дои:10.1016 / j.matpr.2017.09.072. Получено 16 ноября 2020.
- ^ Ци, Сяобо; Гао, Цун; Чжан, Жанвэнь; Чен, Суфэн; Ли, Бо; Вэй, Шэн (январь 2012 г.). «Производство и характеристика полых стеклянных микросфер с высоким коэффициентом диффузии для хранения водорода». Международный журнал водородной энергетики. 37 (2): 1518–1530. Дои:10.1016 / j.ijhydene.2011.10.034. Получено 16 ноября 2020.
- ^ Рапп, Дуглас; Шелби, Джеймс (1 декабря 2004 г.). «Фотоиндуцированное выделение водорода из стекла». Журнал некристаллических твердых тел. 349: 254–259. Дои:10.1016 / j.jnoncrysol.2004.08.151. Получено 16 ноября 2020.
- ^ Зарезаде Мехризи, Маджид; Абди, Джафар; Резаказеми, Машаллах; Салехи, Эхсан (10 июля 2020 г.). «Обзор последних достижений в области полых сфер для хранения водорода». Международный журнал водородной энергетики. 45 (35): 17583–17604. Дои:10.1016 / j.ijhydene.2020.04.201. Получено 16 ноября 2020.
- ^ «НИОКР больших стационарных емкостей для хранения водорода / КПГ / HCNG» (PDF).
- ^ а б «РАБОЧИЙ ДОКУМЕНТ ПЕРСОНАЛА КОМИССИИ: Хранение энергии - роль электричества» (PDF). Европейская комиссия. 1 февраля 2017 г.. Получено 22 апреля 2018.
- ^ 1994 - Аннотация ECN. Hyweb.de. Проверено 8 января 2012.
- ^ «Исследование европейской сети возобновляемых источников энергии» (PDF). Брюссель: Европейский Союз. Январь 2012. С. 86, 188.
- ^ «Зачем хранить крупномасштабные периодические возобновляемые источники энергии с водородом?». Hyunder. Получено 2018-11-25.
- ^ «Хранение возобновляемой энергии: является ли водород жизнеспособным решением?» (PDF).
- ^ «Эффективный перенос энергии Северного моря на берег» (PDF). Мировой энергетический совет Нидерланды. Получено 22 апреля 2018.
- ^ Гердес, Джастин (2018-04-10). "Внесение заброшенных нефтяных и газовых скважин в" электронные запасы "'". Greentech Media. Получено 22 апреля 2018.
- ^ Рати, Акшат. «Батареи не могут решить самую большую в мире проблему хранения энергии. У одного стартапа есть решение». qz.com. Кварцевый. Получено 22 апреля 2018.
- ^ «Мюнхенский стартап Electrochaea и венгерское коммунальное предприятие MVM создают совместное предприятие по производству электроэнергии из газа». МВМ Групп. 24 октября 2016 г.. Получено 22 апреля 2018.
- ^ «SoCalGas и Opus 12 успешно демонстрируют технологию, которая упрощает преобразование двуокиси углерода в возобновляемые источники энергии». prnewswire.com. prnewswire. Получено 22 апреля 2018.
- ^ Амброуз, Джиллиан (2018-01-06). «Энергетические сети готовятся к добавлению водорода в газовую сеть впервые». Телеграф. Получено 22 апреля 2018.
- ^ Анскомб, Надя (4 июня 2012 г.). «Хранение энергии: может ли водород быть ответом?». Солнечный Новус сегодня. Получено 3 ноября 2012.
- ^ Naturalhy В архиве 2012-01-18 в Wayback Machine
- ^ «Национальный центр Министерства энергетики по хранению водорода на основе углерода». Национальная лаборатория возобновляемых источников энергии (NREL). Архивировано из оригинал на 2007-01-27. Получено 1 октября, 2006.. Смотрите также «Задачи для бортовых систем хранения водорода» (PDF). Управление энергоэффективности и возобновляемых источников энергии. Архивировано из оригинал (PDF) на 2007-04-18. Получено 1 апреля, 2007.
- ^ Дорожная карта технологий хранения водорода. uscar.org. Ноябрь 2005 г.
- ^ Ян, июнь; Судик, А; Волвертон, К; Сигель, DJ (2010). «Материалы для хранения водорода с высокой емкостью: атрибуты для автомобильных приложений и методы открытия материалов». Обзоры химического общества. 39 (2): 656–675. CiteSeerX 10.1.1.454.1947. Дои:10.1039 / b802882f. PMID 20111786.
- ^ FCT Хранение водорода: современные технологии. Управление энергоэффективности и возобновляемых источников энергии | доступ
- ^ «Хранение водорода». Министерство энергетики США.
- ^ «Технические цели Министерства энергетики США по хранению водорода на борту легковых автомобилей». Министерство энергетики США.
- ^ а б Хусейн, А. (2015). «Применение нанотехнологий в возобновляемых источниках энергии - всесторонний обзор и понимание». Обзоры возобновляемых и устойчивых источников энергии. 42: 460–476. Дои:10.1016 / j.rser.2014.10.027.
- ^ Эванс, Скарлетт (20 августа 2018 г.). «Исследователи создают водородный источник энергии с помощью нанотехнологий». Объединенное Королевство.
внешняя ссылка
| Викискладе есть медиафайлы по теме Хранение водорода. |
- Резервуары для водорода MaHyTec
- ЕС Сторхи
- Несши
- Водик
- Водород как топливо будущего, доклад DLR; обсуждает типы хранения водорода
- Запланированные программные мероприятия Министерства энергетики США на 2003–2010 годы
- Аммиачный бор (NhxBHx)
- Хайвеб (1996)
- Исследование металлоорганического каркаса или наноклеток [1]Проекты хранения H2
- Технические данные по хранению водорода