WikiDer > Фосфатидная кислота
Фосфатидные кислоты являются анионными фосфолипидами, важными для передачи клеточных сигналов и прямой активации липидно-зависимые ионные каналы. Гидролиз фосфатидной кислоты дает по одной молекуле глицерина и фосфорной кислоты и по две молекулы жирных кислот. Они составляют около 0,25% фосфолипидов в бислое.[1]
Структура
Фосфатидная кислота состоит из глицерин позвоночник, в общем, насыщенный жирная кислота связаны с углерод-1, ненасыщенный жирная кислота связаны с углерод-2, а фосфат группа связана с углерод-3.[2][3]
Формирование и деградация
Помимо синтеза de novo, PA может быть образован тремя способами:
- К фосфолипаза D (PLD), посредством гидролиза связи P-O фосфатидилхолин (ПК) для производства PA и холин.[4]
- За счет фосфорилирования диацилглицерин (DAG) автор: Киназа DAG (ДАГК)
- Путем ацилирования лизофосфатидная кислота лизоПА-ацилтрансферазой (LPAAT); это самый распространенный путь.[5]
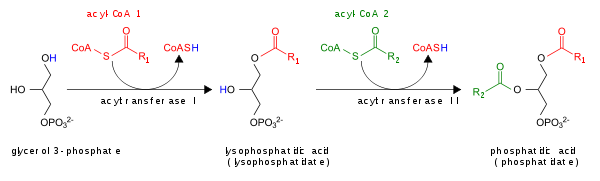
PA ухудшается преобразованием в DAG с помощью липидфосфатфосфогидролазы (LPP)[6][7] или в лизо-PA фосфолипазой A (PLA).
Роль ПА в клетке
Роль ПА в клетке можно разделить на три категории:
- PA является предшественником биосинтеза многих других липидов.
- Физические свойства ПА влияют на кривизну мембраны.
- PA действует как сигнальный липид, рекрутируя цитозольные белки на соответствующие мембраны (например, сфингозинкиназа 1[8]).
- PA играет очень важную роль в фототрансдукция в Дрозофила[9]
- PA представляет собой липидный лиганд, закрывающий ионные каналы.[10] Смотрите также липидно-зависимые ионные каналы.
Первые три роли не исключают друг друга. Например, PA может участвовать в образовании везикул, способствуя кривизне мембраны и рекрутируя белки для выполнения гораздо более энергетически невыгодной задачи образования шейки и защемления.
ПА как предшественник биосинтеза
PA представляет собой жизненно важный клеточный липид, который действует как биосинтетический предшественник для образования (прямо или косвенно) всех липидов ацилглицерина в клетке.[11]
У млекопитающих и дрожжи В клетках известны два различных пути синтеза PA de novo: глицерин-3-фосфатный путь или дигидроксиацетонфосфатный путь. У бактерий присутствует только первый путь, и мутации, блокирующие этот путь, являются летальными, что демонстрирует важность PA. В клетках млекопитающих и дрожжей, где ферменты этих путей избыточны, мутация любого фермента не является летальной. Однако стоит отметить, что in vitro, различные ацилтрансферазы проявляют различную субстратную специфичность по отношению к ацил-КоА, которые включены в PA. Различные ацилтрансферазы также имеют различное внутриклеточное распределение, например, эндоплазматический ретикулум (ER), митохондрии или пероксисомы, и локальные концентрации активированных жирных кислот. Это предполагает, что различные ацилтрансферазы, присутствующие в клетках млекопитающих и дрожжей, могут быть ответственны за продуцирование различных пулов PA.[11]
Превращение ПА в диацилглицерин (DAG) LPP является обязательным шагом для производства фосфатидилхолин (ПК), фосфатидилэтаноламин (PE) и фосфатидилсерин (PS). Кроме того, DAG также преобразуется в CDP-DAG, который является предшественником для фосфатидилглицерин (PG), фосфатидилинозитол (PI) и фосфоинозитиды (ПИП ПИП2, PIP3).[11]
Концентрации PA поддерживаются на крайне низких уровнях в клетке за счет активности сильнодействующих LPP.[6] Они очень быстро превращают PA в DAG, и, поскольку DAG является предшественником многих других липидов, он также быстро метаболизируется в другие мембранные липиды. Это означает, что любая повышающая регуляция продукции PA может быть согласована со временем с соответствующей повышающей регуляцией LPP и ферментов, метаболизирующих DAG.
Следовательно, PA необходим для синтеза липидов и выживания клеток, но в нормальных условиях поддерживается в клетке на очень низких уровнях.
Биофизические свойства ПА
PA представляет собой уникальный фосфолипид, поскольку он имеет небольшую высоко заряженную головную группу, которая очень близка к основной цепи глицерина. PA, как известно, играет роль в обоих везикул деление[12] и слияние,[13] и эти роли могут относиться к биофизическим свойствам PA.
В местах отрастания или слияния мембраны мембрана становится или сильно изогнута. Важное событие в почковании пузырьков, таких как транспортные переносчики из Гольджи, это создание и последующее сужение шейки мембраны. Исследования показали, что этот процесс может быть вызван липидами, и постулировали центральную роль DAG из-за его, также, уникальной молекулярной формы. Наличие двух ацильных цепей, но без головной группы приводит к большой отрицательной кривизне мембран.[14]
LPAAT BARS-50 также участвовал в почковании от Golgi.[12] Это говорит о том, что превращение лизоПА в PA может влиять на кривизну мембраны. Активность LPAAT удваивает количество ацильных цепей, значительно увеличивая площадь поперечного сечения липида, который находится «внутри» мембраны, в то время как поверхностная головная группа остается неизменной. Это может привести к более отрицательной кривизне мембраны. Исследователи из Утрехтский университет изучали влияние лизоПА по сравнению с ПА на кривизну мембраны, измеряя влияние, которое они оказывают на температуру перехода ПЭ от липидных бислоев к неламеллярным фазам, используя 31Р-ЯМР.[15] Было показано, что искривление, индуцированное этими липидами, зависит не только от структуры лизоПА по сравнению с PA, но также от динамических свойств, таких как гидратация головных групп и меж- и внутримолекулярные взаимодействия. Например, Ca2+ может взаимодействовать с двумя PA с образованием нейтрального, но сильно искривленного комплекса. Нейтрализация отталкивающих зарядов головных групп и отсутствие каких-либо стерическое препятствие обеспечивает сильные межмолекулярные взаимодействия между ацильными цепями, в результате чего образуются микродомены, богатые ПА. Таким образом in vitroфизиологические изменения pH, температуры и концентрации катионов оказывают сильное влияние на кривизну мембраны, вызванную PA и lysoPA.[15] Взаимопревращение лизоПА, PA и DAG - а также изменения pH и концентрации катионов - могут вызывать изгиб и дестабилизацию мембраны, играя прямую роль в делении мембраны просто в силу своих биофизических свойств. Однако, хотя было показано, что PA и lysoPA влияют на кривизну мембраны in vitro; их роль in vivo неясно.
Роль lysoPA, PA и DAG в обеспечении кривизны мембраны не исключает их роли в рекрутировании белков на мембрану. Например, Ca2+ На потребность в слиянии сложных липосом не сильно влияет добавление аннексина I, хотя оно снижается за счет PLD. Однако с аннексином I и PLD, степень синтеза значительно увеличивается, и Ca2+ потребность снижается почти в 1000 раз до почти физиологического уровня.[13]
Таким образом, метаболические, биофизические, рекрутинговые и сигнальные роли PA могут быть взаимосвязаны.
Измерение производства PA
Поскольку PA быстро превращается в DAG, он очень недолговечен в клетке. Это означает, что сложно измерить продукцию PA и, следовательно, изучить роль PA в клетке. Однако активность PLD можно измерить путем добавления в ячейку первичных спиртов.[16] Затем PLD проводит реакцию трансфосфатидилирования вместо гидролиза с образованием фосфатидиловых спиртов вместо PA. Фосфатидиловые спирты являются тупиками метаболизма, и их можно легко экстрагировать и измерять. Таким образом, можно измерить активность PLD и продукцию PA (если не сам PA), и, блокируя образование PA, можно сделать вывод об участии PA в клеточных процессах.
PA как сигнальный липид
PA удерживается на низком уровне в объеме мембраны, чтобы временно взорваться и локально передать сигнал в высокой концентрации.[17] Например, каналы TREK-1 активируются локальной ассоциацией с PLD и производством PA.[18] Константа диссоциации ПА для ТРЭК-1 составляет примерно 10 мкмоль.[19]. Относительно слабое связывание в сочетании с низкой концентрацией PA в мембране позволяет каналу отключаться. Высокая локальная концентрация для активации предполагает, по крайней мере, некоторые ограничения в локальной диффузии липидов. Основная низкая концентрация PA в сочетании с высокими локальными всплесками противоположна передаче сигналов PIP2. PIP2 удерживается на относительно высоком уровне в мембране и затем временно гидролизуется рядом с белком, чтобы временно снизить передачу сигналов PIP2.[20] Передача сигналов PA отражает передачу сигналов PIP2 в том смысле, что основная концентрация сигнального липида не должна изменяться для оказания сильного местного эффекта на целевой белок.
Как описано выше, PLD гидролизует ПК сформировать ПА и холин. Поскольку холина в клетке очень много, активность PLD не оказывает значительного влияния на уровень холина; и холин вряд ли играет какую-либо роль в передаче сигналов.[нужна цитата]
Роль активации PLD во многих контекстах передачи сигналов, в сочетании с отсутствием роли холина, предполагает, что PA играет важную роль в передаче сигналов. Однако PA быстро превращается в DAG, и DAG также известен как сигнальная молекула. Это поднимает вопрос о том, играет ли PA какую-либо прямую роль в передаче сигналов или он просто действует как предшественник для продукции DAG.[21][22] Если будет обнаружено, что PA действует только как предшественник DAG, тогда можно поднять вопрос, почему клетки должны производить DAG с использованием двух ферментов, если они содержат ПЛК который может создать DAG за один шаг.
PA, производимый PLD или DAGK, можно отличить по добавлению [γ-32P] АТФ. Это покажет, является ли фосфатная группа новым производным от киназной активности или происходит от ПК.[23]
Хотя PA и DAG взаимопревращаемы, они действуют разными путями. Стимулы, активирующие PLD, не активируют ферменты, расположенные ниже DAG, и наоборот. Например, было показано, что добавление PLD к мембранам приводит к образованию [32P] -меченные PA и [32P] -меченные фосфоинозитиды.[24] Добавление ингибиторов DAGK устраняет продукцию [32P] -меченный PA, но не продуцирование фосфоинозитидов, стимулированное PLD.
Возможно, что, хотя PA и DAG являются взаимопревращаемыми, отдельные пулы сигнальных и несигнальных липидов могут сохраняться. Исследования показали, что передача сигналов DAG опосредуется полиненасыщенным DAG, тогда как PA, происходящий из PLD, является мононенасыщенным или насыщенным. Таким образом, функциональный насыщенный / мононенасыщенный PA может быть разложен путем его гидролиза с образованием нефункционального насыщенного / мононенасыщенного DAG, тогда как функциональный полиненасыщенный DAG может быть разложен путем преобразования его в нефункциональный полиненасыщенный PA.[21][25]
Эта модель предполагает, что эффекторы PA и DAG должны быть способны различать липиды с одинаковыми головными группами, но с разными ацильными цепями. Хотя некоторые липид-связывающие белки способны внедряться в мембраны и гипотетически распознавать тип ацильной цепи или результирующие свойства мембраны, многие липид-связывающие белки являются цитозольными и локализуются на мембране, связывая только головные группы липидов. Возможно, различные ацильные цепи могут влиять на угол наклона головной группы в мембране. Если это так, это предполагает, что PA-связывающий домен должен быть не только способен специфически связывать PA, но также должен быть способен идентифицировать те головные группы, которые находятся под правильным углом. Каким бы ни был механизм, такая специфика возможна. В семенниках свиней обнаружен DAGK, специфичный для полиненасыщенного DAG.[26] и в двух LPP гепатоцитов крысы, которые дефосфорилируют разные виды PA с разной активностью.[27] Более того, стимуляция активности SK1 с помощью PS in vitro Было показано, что они сильно варьируются в зависимости от того, используются ли диолеоил (C18: 1), дистеароил (C18: 0) или 1-стеароил, 2-олеоил PS.[28] Таким образом, кажется, что, хотя PA и DAG взаимопревращаемы, разные виды липидов могут иметь различную биологическую активность; и это может позволить двум липидам поддерживать отдельные сигнальные пути.
Белки известно взаимодействовать с PA
Рекомендации
- ^ Welti, R; Ли, Вт; Ли, М; Пел, Y; Biesiada, H; Чжоу, HE; Раджашекар, CB; Уильямс, TD; Ван X (30 августа 2002 г.). «Профилирование мембранных липидов в ответах растений на стресс. Роль фосфолипазы D альфа в вызванных замораживанием липидных изменениях у Arabidopsis». Журнал биологической химии. 277 (35): 31994–2002. Дои:10.1074 / jbc.M205375200. PMID 12077151.
- ^ Уильям В. Кристи (10 апреля 2009 г.). «Фосфатидная кислота, лизофосфатидная кислота и родственные липиды». Архивировано из оригинал 23 октября 2004 г.. Получено 5 ноября 2009. Проверить значения даты в:
| дата =(помощь) - ^ Schroeder, R .; Лондон, E .; Браун, Д. (декабрь 1994 г.). «Взаимодействие между насыщенными ацильными цепями придает устойчивость к детергентам липидам и гликозилфосфатидилинозитолу (GPI)-заякоренным белкам: GPI-заякоренные белки в липосомах и клетках демонстрируют аналогичное поведение». Труды Национальной академии наук Соединенных Штатов Америки. 91 (25): 12130–12134. Bibcode:1994PNAS ... 9112130S. Дои:10.1073 / пнас.91.25.12130. ЧВК 45390. PMID 7991596.
- ^ Liscovitch M, Czarny M, Fiucci G, Tang X (февраль 2000 г.). «Фосфолипаза D: молекулярная и клеточная биология нового семейства генов». Biochem. J. 345 (3): 401–15. Дои:10.1042/0264-6021:3450401. ЧВК 1220771. PMID 10642495.
- ^ Девлин, Т. М. 2004. Bioquímica, 4ª edición. Реверте, Барселона. ISBN 84-291-7208-4
- ^ а б Бриндли Д. Н., Ваггонер Д. В. (май 1996 г.). «Фосфатидатфосфогидролаза и сигнальная трансдукция». Chem. Phys. Липиды. 80 (1–2): 45–57. Дои:10.1016/0009-3084(96)02545-5. PMID 8681429.
- ^ Бриндли Д. Н., Ваггонер Д. В. (сентябрь 1998 г.). «Липидфосфатфосфогидролазы млекопитающих». J. Biol. Chem. 273 (38): 24281–4. Дои:10.1074 / jbc.273.38.24281. PMID 9733709.
- ^ Делон С., Манифава М., Вуд Е. и др. (Октябрь 2004 г.). «Сфингозинкиназа 1 является внутриклеточным эффектором фосфатидной кислоты». J. Biol. Chem. 279 (43): 44763–74. Дои:10.1074 / jbc.M405771200. PMID 15310762.
- ^ П., Рагху (август 2012 г.). «Липидная передача сигналов в фоторецепторах дрозофилы». Biochim Biophys Acta. 1821 (8): 1154–1165. Дои:10.1016 / j.bbalip.2012.03.008. PMID 22487656.
- ^ Робинсон, резюме; Рохач, Т; Хансен, SB (сентябрь 2019 г.). «Инструменты для понимания наноуровневой регуляции липидов ионных каналов». Тенденции в биохимических науках. 44 (9): 795–806. Дои:10.1016 / j.tibs.2019.04.001. ЧВК 6729126. PMID 31060927.
- ^ а б c Афенштадт К., Даум Г. (ноябрь 1999 г.). «Фосфатидная кислота, ключевой промежуточный продукт в метаболизме липидов». Евро. J. Biochem. 266 (1): 1–16. Дои:10.1046 / j.1432-1327.1999.00822.x. PMID 10542045.
- ^ а б Вайгерт Р., Силлетта М.Г., Спано С. и др. (Ноябрь 1999 г.). «CtBP / BARS индуцирует деление мембран Гольджи путем ацилирования лизофосфатидной кислоты». Природа. 402 (6760): 429–33. Bibcode:1999Натура 402..429Вт. Дои:10.1038/46587. PMID 10586885.
- ^ а б Блэквуд Р.А., Смолен Дж. Э., Трансу А. и др. (Апрель 1997 г.). «Активность фосфолипазы D способствует Са2 + -индуцированной агрегации и слиянию сложных липосом». Являюсь. J. Physiol. 272 (4, часть 1): C1279–85. Дои:10.1152 / ajpcell.1997.272.4.C1279. PMID 9142853.
- ^ Шемеш Т., Луини А., Малхотра В., Бургер К.Н., Козлов М.М. (декабрь 2003 г.). «Пределение трубчатых носителей Гольджи, вызванное локальным метаболизмом липидов: теоретическая модель». Биофиз. J. 85 (6): 3813–27. Bibcode:2003BpJ .... 85.3813S. Дои:10.1016 / S0006-3495 (03) 74796-1. ЧВК 1303683. PMID 14645071. Архивировано из оригинал на 2008-05-07.
- ^ а б Коойман Э. Э., Чупин В., де Крюйфф Б., Бургер К. Н. (март 2003 г.). «Модуляция кривизны мембраны фосфатидной кислотой и лизофосфатидной кислотой». Трафик. 4 (3): 162–74. Дои:10.1034 / j.1600-0854.2003.00086.x. PMID 12656989.
- ^ Моррис А.Дж., Фроман М.А., Энгебрехт Дж. (Октябрь 1997 г.). «Измерение активности фосфолипазы D». Анальный. Биохим. 252 (1): 1–9. Дои:10.1006 / abio.1997.2299. PMID 9324933.
- ^ Робинсон, резюме; Рохач, Т; Хансен, SB (сентябрь 2019 г.). «Инструменты для понимания наноуровневой регуляции липидов ионных каналов». Тенденции в биохимических науках. 44 (9): 795–806. Дои:10.1016 / j.tibs.2019.04.001. ЧВК 6729126. PMID 31060927.
- ^ Comoglio, Y; Левиц, Дж; Кинцлер, Массачусетс; Lesage, F; Isacoff, EY; Сандоз, Г. (16 сентября 2014 г.). «Фосфолипаза D2 специфически регулирует калиевые каналы TREK посредством прямого взаимодействия и местного производства фосфатидной кислоты». Труды Национальной академии наук Соединенных Штатов Америки. 111 (37): 13547–52. Bibcode:2014PNAS..11113547C. Дои:10.1073 / pnas.1407160111. ЧВК 4169921. PMID 25197053.
- ^ Cabanos, C; Ван, М; Хан, X; Хансен, С.Б. (8 августа 2017 г.). «Анализ растворимого флуоресцентного связывания выявляет PIP2 Антагонизм каналов ТРЕК-1 ». Отчеты по ячейкам. 20 (6): 1287–1294. Дои:10.1016 / j.celrep.2017.07.034. ЧВК 5586213. PMID 28793254.
- ^ Павел, Массачусетс; Чанг, HW; Петерсен, EN; Хансен, С.Б. (октябрь 2019 г.). "Полимодальный механизм ингибирования TWIK-связанных K + каналов местным анестетиком". Анестезия и анальгезия. 129 (4): 973–982. Дои:10.1213 / ANE.0000000000004216. PMID 31124840.
- ^ а б Ходжкин М.Н., Петитт Т.Р., Мартин А., Мичелл Р.Х., Пембертон А.Дж., Вакелам М.Дж. (июнь 1998 г.). «Диацилглицерины и фосфатидаты: какие виды молекул являются внутриклеточными посредниками?». Trends Biochem. Наука. 23 (6): 200–4. Дои:10.1016 / S0968-0004 (98) 01200-6. PMID 9644971.
- ^ Вакелам MJ (декабрь 1998 г.). «Диацилглицерин - когда он внутриклеточный мессенджер?». Биохим. Биофиз. Acta. 1436 (1–2): 117–26. Дои:10.1016 / S0005-2760 (98) 00123-4. PMID 9838074.
- ^ Кокрофт С., Болдуин Дж. М., Аллан Д. (июль 1984 г.). «Са2 + -активированная полифосфоинозитидфосфодиэстераза мембран нейтрофилов человека и кролика». Biochem. J. 221 (2): 477–82. Дои:10.1042 / bj2210477. ЧВК 1144062. PMID 6089740.
- ^ Мориц А., Де Граан П.Н., Гиспен У.Х., Вирц К.В. (апрель 1992 г.). «Фосфатидная кислота является специфическим активатором фосфатидилинозитол-4-фосфаткиназы». J. Biol. Chem. 267 (11): 7207–10. PMID 1313792.
- ^ Бочкино С.Б., Блэкмор П.Ф., Уилсон П.Б., Экстон Дж. Х. (ноябрь 1987 г.). «Накопление фосфатидата в гепатоцитах, обработанных гормоном, по механизму фосфолипазы D». J. Biol. Chem. 262 (31): 15309–15. PMID 3117799.
- ^ Ходжкин М.Н., Гарднер С.Д., Роуз С., Патерсон А., Мартин А., Вакелам М.Дж. (март 1997 г.). «Очистка и характеристика sn-1-стеароил-2-арахидоноилглицерин киназы из семенников свиней». Biochem. J. 322 (Pt 2): 529–34. Дои:10.1042 / bj3220529. ЧВК 1218222. PMID 9065773.
- ^ Флеминг И. Н., Йеман С. Дж. (Июнь 1995 г.). «Очистка и характеристика нечувствительной к N-этилмалеимиду фосфогидролазы фосфатидной кислоты (PAP2) из печени крысы». Biochem. J. 308 (Pt 3): 983–9. Дои:10.1042 / bj3080983. ЧВК 1136819. PMID 8948459.
- ^ Оливера А., Розенталь Дж., Шпигель С. (март 1996 г.). «Влияние кислых фосфолипидов на сфингозинкиназу». J. Cell. Биохим. 60 (4): 529–37. Дои:10.1002 / (SICI) 1097-4644 (19960315) 60: 4 <529 :: AID-JCB9> 3.0.CO; 2-U. PMID 8707892.
- ^ Wiczer, Brian M; Томас, Джордж (27 марта 2012 г.). «Фосфолипаза D и mTORC1: питательные вещества - вот что их объединяет». Sci. Сигнал. 5 (217): pe13. Дои:10.1126 / scisignal.2003019. PMID 22457329.
- ^ Cabanos, C; Ван, М; Хан, X; Хансен, SB (8 августа 2017 г.). «Анализ растворимого флуоресцентного связывания выявляет PIP2 Антагонизм каналов ТРЕК-1 ». Отчеты по ячейкам. 20 (6): 1287–1294. Дои:10.1016 / j.celrep.2017.07.034. ЧВК 5586213. PMID 28793254.
- ^ Хайт, РК; Баттервик, Дж. А; Маккиннон, Р. (6 октября 2014 г.). «Модуляция фосфатидной кислоты функции датчика напряжения канала Kv». eLife. 3. Дои:10.7554 / eLife.04366. ЧВК 4212207. PMID 25285449.
- ^ Hansen, SB; Дао, Х; Маккиннон, Р. (28 августа 2011 г.). «Структурная основа активации PIP2 классического входящего выпрямителя K + канал Kir2.2». Природа. 477 (7365): 495–8. Bibcode:2011Натура.477..495H. Дои:10.1038 / природа10370. ЧВК 3324908. PMID 21874019.
