WikiDer > Сфингомиелин

Сфингомиелин (SPH, ˌSfɪŋɡoˈmaɪəlɪn) является разновидностью сфинголипид найдено в животном клеточные мембраны, особенно в перепончатом миелиновой оболочки что окружает некоторые нервная клетка аксоны. Обычно он состоит из фосфохолин и керамид, или фосфоэтаноламин головная группа; поэтому сфингомиелины также можно отнести к сфингофосфолипидам.[1][2] У человека SPH составляет ~ 85% всех сфинголипидов и обычно составляет 10-20 мол.% плазматическая мембрана липиды.
Сфингомиелин был впервые выделен Немецкий химик Иоганн Л.В. Thudicum в 1880-х гг.[3] О структуре сфингомиелина впервые сообщили в 1927 году как о N-ацил-сфингозин-1-фосфорилхолине.[3] Содержание сфингомиелина у млекопитающих колеблется от 2 до 15% в большинстве тканей, причем более высокие концентрации обнаруживаются в нервных тканях, эритроцитах и линзах глаза. Сфингомиелин играет важную структурную и функциональную роль в клетке. Он является компонентом плазматической мембраны и участвует во многих сигнальных путях. Метаболизм сфингомиелина создает множество продуктов, которые играют важную роль в клетке.[3]
Физические характеристики
Сочинение
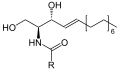
Сфингомиелин состоит из фосфохолин головная группа, а сфингозин, а жирная кислота. Это один из немногих мембранных фосфолипидов, не синтезируемых из глицерина. Сфингозин и жирная кислота в совокупности могут быть отнесены к церамидам. Эта композиция позволяет сфингомиелину играть важную роль в сигнальных путях: деградация и синтез сфингомиелина производят важные вторичные мессенджеры для передачи сигнала.
Сфингомиелин, полученный из природных источников, таких как яйца или бычий мозг, содержит жирные кислоты различной длины цепи. Сфингомиелин с заданной длиной цепи, такой как пальмитоилсфингомиелин с насыщенной 16-ацильной цепью, коммерчески доступен.[4]
Характеристики
В идеале молекулы сфингомиелина имеют форму цилиндра, однако многие молекулы сфингомиелина имеют существенное несоответствие цепей (длины двух гидрофобных цепей значительно различаются).[5] Гидрофобные цепи сфингомиелина имеют тенденцию быть намного более насыщенными, чем другие фосфолипиды. В температура основной переходной фазы сфингомиелинов также выше по сравнению с температурой фазового перехода аналогичных фосфолипидов, около 37 ° C. Это может вносить латеральную неоднородность в мембрану, генерируя домены в бислое мембраны.[5]
Сфингомиелин значительно взаимодействует с холестерином. Холестерин обладает способностью устранять фазовый переход из жидкого состояния в твердое в фосфолипидах. Поскольку температура перехода сфингомиелина находится в пределах физиологического диапазона температур, холестерин может играть значительную роль в фазе сфингомиелина. Сфингомиелин также более склонен к образованию межмолекулярных водородных связей, чем другие фосфолипиды.[6]
Место расположения
Сфингомиелин синтезируется в эндоплазматический ретикулум (ER), где его можно найти в небольших количествах, и в транс Гольджи. Он обогащен плазматическая мембрана с большей концентрацией на внешней, чем на внутренней створке.[7] Комплекс Гольджи представляет собой промежуточное звено между ER и плазматической мембраной с немного более высокими концентрациями в направлении транс-стороны.[8]
Метаболизм
Синтез
Синтез сфингомиелина включает ферментативный перенос фосфохолина из фосфатидилхолин к керамиду. Первый обязательный этап синтеза сфингомиелина включает конденсацию L-серин и пальмитоил-КоА. Эта реакция катализируется серинпальмитоилтрансфераза. Продукт этой реакции восстанавливается с образованием дигидросфингозина. Дигидросфингозин подвергается N-ацилированию с последующей десатурацией с образованием церамида. Каждая из этих реакций происходит на цитозольной поверхности эндоплазматический ретикулум. Керамид транспортируется в аппарат Гольджи где он может быть преобразован в сфингомиелин. Сфингомиелинсинтаза отвечает за производство сфингомиелина из церамида. Диацилглицерин образуется как побочный продукт при переносе фосфохолина.[9]
Деградация
Распад сфингомиелина ответственен за запуск многих универсальных сигнальных путей. Он гидролизуется сфингомиелиназами (сфингомиелинспецифическими фосфолипазами типа C).[7] Головная группа фосфохолина выделяется в водную среду, в то время как церамид диффундирует через мембрану.
Функция
Мембраны
Перепончатый миелиновой оболочки который окружает и электрически изолирует многие нервные клетки аксоны особенно богат сфингомиелином, что предполагает его роль в качестве изолятора нервных волокон.[2] В плазматическая мембрана других клеток также изобилует сфингомиелином, хотя в основном он находится в экзоплазматическом листке клеточной мембраны. Однако есть некоторые свидетельства того, что во внутреннем листке мембраны также может находиться пул сфингомиелина.[10][11] Более того, нейтральная сфингомиелиназа-2 - фермент, расщепляющий сфингомиелин на керамид - было обнаружено, что он локализуется исключительно на внутренней створке, что позволяет предположить, что там может присутствовать сфингомиелин.[12]
Передача сигнала
Функция сфингомиелина оставалась неясной, пока не было обнаружено, что он играет роль в преобразование сигнала.[13] Было обнаружено, что сфингомиелин играет важную роль в сигнальных путях клеток. Синтез сфингомиелина на плазматической мембране сфингомиелинсинтазой 2 производит диацилглицерин, который является жирорастворимым вторичным мессенджером, который может проходить по сигнальному каскаду. Кроме того, деградация сфингомиелина может производить церамид, который участвует в апоптотическом сигнальном пути.
Апоптоз
Было обнаружено, что сфингомиелин играет роль в клеточном апоптоз путем гидролиза в церамид. Исследования конца 1990-х годов показали, что церамид продуцируется в различных условиях, ведущих к апоптозу.[14] Затем была выдвинута гипотеза, что гидролиз сфингомиелина и передача сигналов церамидов важны для принятия решения о том, умирает ли клетка. В начале 2000-х годов появились новые исследования, которые определили новую роль гидролиза сфингомиелина в апоптозе, определяя не только, когда клетка умирает, но и как.[14] После дополнительных экспериментов было показано, что если гидролиз сфингомиелина происходит на достаточно ранней стадии пути, производство церамида может влиять либо на скорость и форму гибели клеток, либо работать для высвобождения блоков при последующих событиях.[14]
Липидные рафты
Сфингомиелин, как и другие сфинголипиды, связаны с липидные микродомены в плазматической мембране, известной как липидные рафты. Липидные рафты характеризуются тем, что молекулы липидов находятся в липидной упорядоченной фазе, предлагая большую структуру и жесткость по сравнению с остальной частью плазматической мембраны. В рафтах ацильные цепи имеют низкое движение цепи, но молекулы обладают высокой боковой подвижностью. Этот порядок частично объясняется более высокой температурой перехода сфинголипидов, а также взаимодействием этих липидов с холестерином. Холестерин - это относительно небольшая неполярная молекула, которая может заполнять пространство между сфинголипидами, образованное большими ацильными цепями. Считается, что липидные рафты участвуют во многих клеточных процессах, таких как сортировка и транспортировка мембран, трансдукция сигналов и поляризация клеток.[15] Избыток сфингомиелина в липидных рафтах может привести к резистентность к инсулину.[16]
Из-за определенных типов липидов в этих микродоменах липидные рафты могут накапливать определенные типы белков, связанных с ними, тем самым увеличивая те особые функции, которыми они обладают. Предполагается, что липидные рафты участвуют в каскаде клеточного апоптоза.[17]
Аномалии и сопутствующие заболевания
Сфингомиелин может накапливаться в редких наследственный болезнь называется Болезнь Ниманна – Пика, типы A и B. Это генетически унаследованный заболевание, вызванное дефицитом лизосомный фермент кислая сфингомиелиназа, что вызывает накопление сфингомиелина в селезенка, печень, легкие, Костный мозг, и мозг, вызывая необратимые неврологические повреждения. Из двух типов, включающих сфингомиелиназа, тип А встречается у младенцев. Он характеризуется желтуха, увеличенный печень, и глубокий мозг повреждать. Дети с этим типом редко доживают до 18 месяцев. Тип B включает увеличение печени и селезенки, что обычно происходит в подростковом возрасте. Мозг не поражен. У большинства пациентов нормальный уровень фермента <1% по сравнению с нормальным уровнем. Гемолитический белок, лизенин, может быть ценным зондом для обнаружения сфингомиелина в клетках пациентов Ниманна-Пика А.[18].
В результате аутоиммунного заболевания рассеянный склероз (MS), миелин оболочка нервных клеток в головном и спинном мозге разрушается, что приводит к потере способности передавать сигнал. У пациентов с РС наблюдается повышенная регуляция определенных цитокины в спинномозговой жидкости, особенно фактор некроза опухоли альфа. Это активирует сфингомиелиназу, фермент, катализирующий гидролиз сфингомиелина до церамида; Активность сфингомиелиназы наблюдалась в сочетании с клеточным апоптозом.[19]
Избыток сфингомиелина в мембране эритроцитов (как в абеталипопротеинемия) вызывает избыточное накопление липидов в наружной створке эритроцит плазматическая мембрана. Это приводит к образованию эритроцитов неправильной формы, называемых акантоциты.
Дополнительные изображения
Шариковая модель сфингомиелина
Формула скелета сфингомиелина
Рекомендации
внешняя ссылка
- Сфингомиелины в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- ^ Брун, Хайке; Винкельманн, Юлия; Андерсен, Кристиан; Андре, Йорг; Лейппе, Маттиас (01.01.2006). «Рассмотрение механизмов цитолитической и антибактериальной активности лизенина, защитного белка кольчатых червей Eisenia fetida». Развитие и сравнительная иммунология. 30 (7): 597–606. Дои:10.1016 / j.dci.2005.09.002. ISSN 0145-305X. PMID 16386304.
- ^ а б Дональд Дж. Воет; Джудит Г. Воет; Шарлотта В. Пратт (2008). «Липиды, бислои и мембраны». Принципы биохимии, третье издание. Вайли. п. 252. ISBN 978-0470-23396-2.
- ^ а б c Рамштедт, В; Слотт, JP (30 октября 2002 г.). «Мембранные свойства сфингомиелинов». Письма FEBS. 531 (1): 33–7. Дои:10.1016 / S0014-5793 (02) 03406-3. PMID 12401199. S2CID 35378780.

- ^ «Avanti Polar Lipids». В архиве из оригинала от 29.03.2014. Получено 2013-07-16.
- ^ а б Баренхольц, Y; Томпсон, TE (ноябрь 1999 г.). «Сфингомиелин: биофизические аспекты». Химия и физика липидов. 102 (1–2): 29–34. Дои:10.1016 / S0009-3084 (99) 00072-9. PMID 11001558.
- ^ Мэсси, Джон Б. (9 февраля 2001 г.). «Взаимодействие церамидов с фосфатидилхолином, сфингомиелином и бислоями сфингомиелина / холестерина». Biochimica et Biophysica Acta (BBA) - Биомембраны. 1510 (1–2): 167–84. Дои:10.1016 / S0005-2736 (00) 00344-8. PMID 11342156.

- ^ а б Тести, Роберто (декабрь 1996 г.). «Распад сфингомиелина и судьба клеток». Тенденции в биохимических науках. 21 (12): 468–71. Дои:10.1016 / S0968-0004 (96) 10056-6. PMID 9009829.
- ^ Брюггер, В; Sandhoff, R; Wegehingel, S; Горгас, К; Malsam, J; Helms, JB; Lehmann, WD; Никель, Вт; Виланд, FT (30 октября 2000 г.). «Доказательства сегрегации сфингомиелина и холестерина во время образования везикул, покрытых COPI». Журнал клеточной биологии. 151 (3): 507–18. Дои:10.1083 / jcb.151.3.507. ЧВК 2185577. PMID 11062253.
- ^ Tafesse, FG; Ternes, P; Холтуис, JC (6 октября 2006 г.). «Мультигенное семейство сфингомиелинсинтаз». Журнал биологической химии. 281 (40): 29421–5. Дои:10.1074 / jbc.R600021200. HDL:1874/19992. PMID 16905542.

- ^ Linardic CM, Hannun YA (1994). «Идентификация отдельного пула сфингомиелина, участвующего в цикле сфингомиелина». J. Biol. Chem. 269 (38): 23530–7. PMID 8089120.
- ^ Zhang, P .; Лю, Б .; Jenkins, G.M .; Hannun, Y.A .; Обейд, Л. М. (1997). «Экспрессия нейтральной сфингомиелиназы идентифицирует отдельный пул сфингомиелина, участвующий в апоптозе». Журнал биологической химии. 272 (15): 9609–9612. Дои:10.1074 / jbc.272.15.9609. PMID 9092485.
- ^ Tani, M .; Ханнун, Ю. А. (2007). «Анализ топологии мембраны нейтральной сфингомиелиназы 2». Письма FEBS. 581 (7): 1323–1328. Дои:10.1016 / j.febslet.2007.02.046. ЧВК 1868537. PMID 17349629.
- ^ Колесник (1994). «Передача сигнала по пути сфингомиелина». Мол Chem Neuropathol. 21 (2–3): 287–97. Дои:10.1007 / BF02815356. PMID 8086039. S2CID 30521415.
- ^ а б c Грин, Дуглас Р. (10 июля 2000 г.). «Апоптоз и гидролиз сфингомиелина. Обратная сторона». Журнал клеточной биологии. 150 (1): F5–7. Дои:10.1083 / jcb.150.1.F5. ЧВК 2185551. PMID 10893276.
- ^ Giocondi, MC; Boichot, S; Plénat, T; Le Grimellec, CC (август 2004 г.). «Структурное разнообразие микродоменов сфингомиелина». Ультрамикроскопия. 100 (3–4): 135–43. Дои:10.1016 / j.ultramic.2003.11.002. PMID 15231303.
- ^ Ли, Z; Чжан, Х; Лю, Дж; Лян, КП; Ли, У; Ли, У; Тейтельман, Г; Бейер, Т; Bui, HH; Пик, DA; Zhang, Y; Сандерс, ЧП; Куо, MS; Парк, ТС; Cao, G; Цзян, XC (октябрь 2011 г.). «Уменьшение сфингомиелина плазматической мембраны увеличивает чувствительность к инсулину». Молекулярная и клеточная биология. 31 (20): 4205–18. Дои:10.1128 / MCB.05893-11. ЧВК 3187286. PMID 21844222.
- ^ Чжан, Л; Hellgren, LI; Сюй, X (3 мая 2006 г.). «Ферментативное производство церамида из сфингомиелина». Журнал биотехнологии. 123 (1): 93–105. Дои:10.1016 / j.jbiotec.2005.10.020. PMID 16337303.
- ^ Брун, Хайке; Винкельманн, Юлия; Андерсен, Кристиан; Андре, Йорг; Лейппе, Маттиас (01.01.2006). «Рассмотрение механизмов цитолитической и антибактериальной активности лизенина, защитного белка кольчатых червей Eisenia fetida». Развитие и сравнительная иммунология. 30 (7): 597–606. Дои:10.1016 / j.dci.2005.09.002. ISSN 0145-305X. PMID 16386304.
- ^ Яна, А; Пахан, К. (декабрь 2010 г.). «Сфинголипиды при рассеянном склерозе». Нейромолекулярная медицина. 12 (4): 351–61. Дои:10.1007 / s12017-010-8128-4. ЧВК 2987401. PMID 20607622.