WikiDer > Посттранскрипционная модификация
Этот отсутствует информация о разделах для РНК, кроме мРНК. (Октябрь 2020) |
Посттранскрипционная модификация или же котранскрипционная модификация это набор биологических процессов, общих для большинства эукариотический ячейки, с помощью которых РНК первичная стенограмма химически изменен после транскрипция из ген для производства зрелой функциональной молекулы РНК, которая затем может покинуть ядро и выполнять в ячейке любую из множества различных функций. [1] Есть много типов посттранскрипционных модификаций, достигаемых с помощью разнообразного класса молекулярных механизмов.
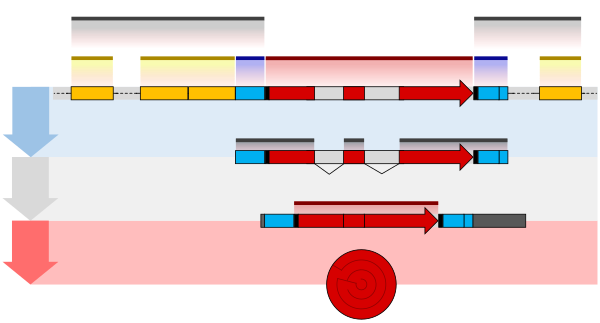
Одним из примеров является преобразование прекурсора информационная РНК транскрипции в зрелую информационную РНК, которая впоследствии может быть переведено в белок. Этот процесс включает три основных этапа, которые существенно изменяют химическую структуру молекулы РНК: добавление Крышка 5 футов, добавление 3 ' полиаденилированный хвост и Сплайсинг РНК. Такая обработка жизненно важна для правильного перевода эукариотической геномы потому что исходная мРНК-предшественник, продуцируемая транскрипцией, часто содержит оба экзоны (кодирующие последовательности) и интроны (некодирующие последовательности); сплайсинг удаляет интроны и напрямую связывает экзоны, в то время как шапочка и хвост облегчают транспорт мРНК к рибосома и защитить его от молекулярной деградации.[2]
Посттранскрипционные модификации могут также происходить во время обработки других транскриптов, которые в конечном итоге становятся переносить РНК, рибосомная РНКили любой из других типов РНК, используемых клеткой.
обработка мРНК
Молекула пре-мРНК претерпевает три основных модификации. Эти модификации 5 'крышка, 3' полиаденилирование, и Сплайсинг РНК, которые происходят в ядро клетки до того, как РНК переведено.[4]
5 'обработка
Укупорка
Кэппирование пре-мРНК включает добавление 7-метилгуанозин (м7Ж) до конца 5 '. Для этого необходимо удалить концевой 5 'фосфат, что осуществляется с помощью фосфатаза фермент. Фермент гуанозилтрансфераза затем катализирует реакцию, которая производит дифосфат 5 'конец. Затем дифосфатный 5'-конец атакует альфа-атом фосфора GTP молекулу, чтобы добавить гуанин остаток в 5'5 'трифосфатной связи. Фермент (гуанин-N7-) - метилтрансфераза ("cap MTase") переносит метильную группу из S-аденозил метионин к гуаниновому кольцу.[5] Этот тип кепки только с (m7G) в позиции называется структурой крышки 0. В рибоза соседних нуклеотид также может быть метилировано с образованием кэпа 1. Метилирование нуклеотидов после молекулы РНК дает структуры кэпа 2, кэпа 3 и так далее. В этих случаях метильные группы добавляются к 2'-ОН-группам сахара рибозы. Cap защищает 5'-конец первичного транскрипта РНК от атаки со стороны рибонуклеазы которые имеют специфичность к 3'5 ' фосфодиэфирные связи.[6]
3 'обработка
Расщепление и полиаденилирование
Процессинг пре-мРНК на 3'-конце молекулы РНК включает отщепление ее 3'-конца и затем добавление примерно 250 аденин остатки, чтобы сформировать поли (А) хвост. Реакции расщепления и аденилирования происходят в первую очередь, если сигнальная последовательность полиаденилирования (5'-AAUAAA-3 ') расположен около 3' конца молекулы пре-мРНК, за которой следует другая последовательность, обычно (5'-CA-3 ') и является местом расщепления. А ГУ-богатая последовательность также обычно присутствует ниже по течению от молекулы пре-мРНК. Недавно было продемонстрировано, что альтернативные сигнальные последовательности, такие как UGUA, расположенные выше сайта расщепления, также могут направлять расщепление и полиаденилирование в отсутствие сигнала AAUAAA. Важно понимать, что эти два сигнала не являются взаимно независимыми и часто сосуществуют. После синтеза элементов последовательности несколько мультисубъединичных белки переносятся на молекулу РНК. Перенос этих специфичных связывающих белков фактор специфичности расщепления и полиаденилирования (CPSF), фактор расщепления I (CF I) и фактор стимуляции расщепления (CStF) происходит от РНК-полимераза II. Эти три фактора связаны с элементами последовательности. Сигнал AAUAAA напрямую связывается с CPSF. Для сайтов UGUA-зависимого процессинга связывание мультибелкового комплекса осуществляется фактором расщепления I (CF I). Образовавшийся в результате белковый комплекс содержит дополнительные факторы расщепления и фермент Полиаденилат-полимераза (ПАП). Этот комплекс расщепляет РНК между последовательностью полиаденилирования и богатой GU последовательностью в сайте расщепления, отмеченном последовательностями (5'-CA-3 '). Затем поли (A) полимераза добавляет около 200 единиц аденина к новому 3'-концу молекулы РНК, используя АТФ как предшественник. По мере синтеза поли (А) хвоста он связывает несколько копий поли (A) -связывающий белок, который защищает 3'-конец от переваривания рибонуклеаз ферментами, включая CCR4-Нет сложный.[6]
Сплайсинг интронов
Сплайсинг РНК - это процесс, посредством которого интроныобласти РНК, которые не кодируют белки, удаляются из пре-мРНК, а оставшиеся экзоны соединены, чтобы переформировать единую непрерывную молекулу. Экзоны - это участки мРНК, которые «экспрессируются» или транслируются в белок. Они являются кодирующими частями молекулы мРНК.[7] Хотя большая часть сплайсинга РНК происходит после полного синтеза и концевого кэпирования пре-мРНК, транскрипты со многими экзонами могут быть сплайсированы котранскрипционно.[8] Реакция сплайсинга катализируется большим белковым комплексом, называемым сплайсосома собран из белков и малая ядерная РНК молекулы, которые распознают сайты сращивания в последовательности пре-мРНК. Многие пре-мРНК, в том числе кодирующие антитела, могут быть сплайсированы разными способами для получения различных зрелых мРНК, которые кодируют разные белковые последовательности. Этот процесс известен как альтернативное сращивание, и позволяет производить большое количество белков из ограниченного количества ДНК.
Обработка мРНК гистонов
Гистоны H2A, H2B, H3 и H4 образуют ядро нуклеосома и поэтому называются основные гистоны. Обработка ядер гистонов осуществляется по-другому, потому что типичная мРНК гистонов лишена некоторых свойств других мРНК эукариот, таких как поли (A) хвост и интроны. Таким образом, такие мРНК не подвергаются сплайсингу, и их 3'-процессинг осуществляется независимо от большинства факторов расщепления и полиаденилирования. МРНК гистонов ядра имеют особую стебель-петля структура на 3-простом конце, распознаваемая белок, связывающий стебель-петлю и нижестоящая последовательность, называемая гистоновым нижележащим элементом (HDE), которая привлекает U7 мяРНК. Фактор специфичности расщепления и полиаденилирования 73 разрезает мРНК между стержнем-петлей и HDE[9]
Варианты гистонов, такие как H2A.Z или H3.3, однако, имеют интроны и процессируются как нормальные мРНК, включая сплайсинг и полиаденилирование.[9]
Смотрите также
Рекомендации
- ^ Поцелуй Т (июль 2001 г.). «Небольшая ядрышковая РНК-управляемая посттранскрипционная модификация клеточных РНК». Журнал EMBO. 20 (14): 3617–22. Дои:10.1093 / emboj / 20.14.3617. ЧВК 125535. PMID 11447102.
- ^ Берг, Тимочко и Страйер 2007, п. 836
- ^ а б Шафи, Томас; Лоу, Рохан (2017). «Структура эукариотических и прокариотических генов». WikiJournal of Медицина. 4 (1). Дои:10.15347 / wjm / 2017.002. ISSN 2002-4436.
- ^ Берг, Тимочко и Страйер 2007, п. 841
- ^ Ямада-Окабе Т., Мио Т., Кашима Ю., Мацуи М., Арисава М., Ямада-Окабе Х. (ноябрь 1999 г.). «Ген Candida albicans для 5-кэп-метилтрансферазы мРНК: идентификация дополнительных остатков, необходимых для катализа». Микробиология. 145 (Pt 11) (11): 3023–33. Дои:10.1099/00221287-145-11-3023. PMID 10589710. Архивировано из оригинал на 2012-07-12.
- ^ а б Хеймс и Хупер 2006, п. 221
- ^ Биология. Образование холма Мграу. 2014. С. 241–242. ISBN 978-981-4581-85-1.
- ^ Лодиш Х.Ф., Берк А., Кайзер С., Кригер М., Скотт М.П., Бретчер А., Плоег Х., Мацудаира П.Т. (2007). «Глава 8: Посттранскрипционный генный контроль». Молекулярная клетка. Биология. Сан-Франциско: WH Freeman. ISBN 978-0-7167-7601-7.
- ^ а б Марцлуфф В.Ф., Вагнер Э.Дж., Дуронио Р.Дж. (ноябрь 2008 г.). «Метаболизм и регуляция канонических мРНК гистонов: жизнь без поли (А) хвоста». Обзоры природы. Генетика. 9 (11): 843–54. Дои:10.1038 / nrg2438. ЧВК 2715827. PMID 18927579.
дальнейшее чтение
- Берг Ю.М., Тимочко Ю.Л., Страйер Л (2007). Биохимия (6 изд.). Нью-Йорк: WH Freeman & Co. ISBN 978-0-7167-6766-4.
- Хеймс Д., Хупер Н. (2006). Мгновенные заметки Биохимия. Annales de Biologie Clinique. 58 (3-е изд.). Лидс: Тейлор и Фрэнсис. п. 767. ISBN 978-0-415-36778-3. PMID 11098183.
- Сунь В.Дж., Ли Дж.Х., Лю С., Ву Дж., Чжоу Х., Цюй Л.Х., Ян Дж.Х. (январь 2016 г.). «RMBase: ресурс для расшифровки ландшафта модификаций РНК из данных высокопроизводительного секвенирования». Исследования нуклеиновых кислот. 44 (D1): D259-65. Дои:10.1093 / нар / gkv1036. ЧВК 4702777. PMID 26464443.
- Machnicka MA, Milanowska K, Osman Oglou O, Purta E, Kurkowska M, Olchowik A, Januszewski W, Kalinowski S, Dunin-Horkawicz S, Rother KM, Helm M, Bujnicki JM, Grosjean H (январь 2013 г.). «MODOMICS: база данных путей модификации РНК - обновление 2013 г.». Исследования нуклеиновых кислот. 41 (Проблема с базой данных): D262-7. Дои:10.1093 / нар / гкс1007. ЧВК 3531130. PMID 23118484.
- Кантара В.А., Крейн П.Ф., Розенски Дж., Макклоски Дж. А., Харрис К.А., Чжан Х, Вендейш Ф.А., Фабрис Д., Агрис П.Ф. (январь 2011 г.). «База данных модификаций РНК, RNAMDB: обновление 2011 г.». Исследования нуклеиновых кислот. 39 (Выпуск базы данных): D195-201. Дои:10.1093 / nar / gkq1028. ЧВК 3013656. PMID 21071406.
- Посттранскрипционный + РНК + Модификация в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)