WikiDer > Комплекс хлорида переходного металла
В химия, а комплекс хлорида переходного металла это координационный комплекс который состоит из переходный металл координируется с одним или несколькими хлористый лиганд. Класс комплексов обширен.[1]
Склеивание
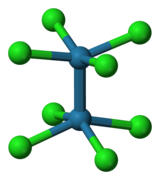
Галогениды X-типа лиганды в координационная химия. Они оба являются σ- и π-донорами. Хлорид обычно встречается как концевой лиганд, так и мостиковый лиганд. Галогенидные лиганды лиганды слабого поля. Из-за меньшей энергии расщепления кристаллического поля все гомолептические галогенидные комплексы первой серии переходов имеют высокий спин. Только [CrCl6]3− обмен инертен.
Известны гомолептические комплексы галогенидов металлов с несколькими стехиометриями, но основными из них являются гексагалометаллаты и тетрагалометаллаты. Гексагалогениды принимают октаэдрическая координационная геометрия, тогда как тетрагалогениды обычно тетраэдрические. Квадратные плоские тетрагалогениды известны для Pd (II), Pt (II) и Au (III). Примеры с 2- и 3-координацией являются общими для Au (I), Cu (I) и Ag (I).
Из-за наличия заполненных пπ орбитали, галогенидные лиганды на переходных металлах способны усиливать π-обратное соединение на π-кислоту. Они также известны своей лабилизацией СНГ-лиганды.[2]
Гомолептические комплексы
Гомолептические комплексы (комплексы только с хлоридными лигандами) часто являются общими реагентами. Почти все примеры - анионы.
1-й ряд

| Сложный | цвет | электронный конфиг. | геометрия | Комментарии |
|---|---|---|---|---|
| TiCl4 | бесцветный | (т2 г)0 | четырехгранный | |
| [Ti2Cl10]2− | бесцветный | d0d0 | биоктаэдрический | |
| [Ti2Cl9]− | белый / бесцветный | d0d0 | биоктаэдр с общим лицом | Ti-Cl (концевой) = 2,23 Å, 2,45 (концевой) (N (PCl3)2)+ соль)[3] |
| [Ti2Cl9]3- | апельсин | (т2 г)1(т2 г)1 | биоктаэдр с общим лицом | Ti-Ti = 3,22 Å Ti-C1 (концевой) = 2,32-2,35 Å (концевой), Ti-Cl (мостик) = 2,42-2,55 Å ((Сеть4+)3)3 соль)[4] |
| [Ti3Cl12]3- | зеленый | (т2 г)1(т2 г)1(т2 г)1 | триоктаэдр с разделением граней | Ti-Ti = 3,19, 3,10 Å (концевой) Ti-C1 (концевой) = 2,36 Å (концевой), Ti-Cl (мостик) = 2,50 Å ((PPh4+)3)3 соль)[5] |
| [TiCl6]2− | желтый | d0 | восьмигранный | |
| VCl4 | красный | (т2 г)1 | четырехгранный | V1-Cl = 2,29 Å |
| VCl5 | фиолетовый | (т2 г)0 | биоктаэдр с общими ребрами | V1-Cl (мостиковый) = 2,48 Å, V1-Cl (концевой) = 2,16-2,21 Å[6] |
| [VCl6]2- | красный | (т2 г)1 | восьмигранный | V1-Cl = 2,29 Å[7] |
| [CrCl6]3− | ?? | (т2 г)3 | восьмигранник[8] | |
| [MnCl4]2−[9] | бледно-розовый | (еграмм)2(т2 г)3 | четырехгранный | Длина связи Mn-Cl = 2,3731-2,3830 Å.[10] |
| [Mn2Cl6]2− | желто-зеленый | (еграмм)2(т2 г)3 | битетраэдрический | Длина связи Mn-Cl (концевой) = 2,24 Å. Длина связи Mn-Cl (концевой) = 2,39 Å.[11] (PPN+)2 соль |
| [MnCl6]2− | темно-красный | (т2 г)3(еграмм)1 | восьмигранный | Расстояние Mn-Cl = 2,28 Å K+ соль[12]) соль изоструктурна K2PtCl6 |
| [Mn3Cl12]6− | розовый | (т2 г)3(еграмм)2 | кофациальный триоктаэдр | Расстояние Mn-Cl = --- Å [(C (NH2)3]+6 соль[13] |
| [FeCl4]2−[9] | крем ((Et4N+)2 соль)[9] | (еграмм)3(т2 г)3 | четырехгранный | |
| [FeCl4]− | (еграмм)2(т2 г)3 | четырехгранный | Длина связи Fe-Cl = 2,19 Å[14] | |
| [Fe2Cl6]2− | бледно-желтый | (еграмм)2(т2 г)3 | битетраэдрический | Длина связи Fe-Cl (концевой) = 2,24 Å. Длина связи Fe-Cl (концевой) = 2,39 Å.[11] (PPN+)2 соль |
| [CoCl4]2−[9] | синий[9] | (еграмм)4(т2 г)3 | четырехгранный | |
| [Co2Cl6]2− | синий[11] | (еграмм)4(т2 г)3 | битетраэдрический | Длина связи Mn-Cl (концевой) = 2,24 Å. Длина связи Co-Cl (концевой) = 2,35 Å.[11] (PPN+)2 соль |
| [NiCl4]2−[9] | синий[9] | (еграмм)4(т2 г)4 | четырехгранный | Длина связи Ni-Cl = 2,28 Å (Et4N+)2 соль[15] |
| [Ni3Cl12]6− | апельсин[16] | (т2 г)6(еграмм)2 | конфациальный триоктаэдр | Длина связи Ni-Cl = 2,36-2,38 Å ((Мне2NH2+)2)8 соль двойная соль с двумя Cl−[16] |
| [CuCl4]2−[9] | апельсин[17] | (т2 г)6(еграмм)3 | четырехгранный | Длина связи Cu-Cl = 2,24 Å |
| [Cu2Cl6]2− | зеленый | (т2 г)6(еграмм)3 | с разделенными кромками бис (квадратный плоский)[18] | |
| [ZnCl4]2− | белый / бесцветный | d10 | четырехгранный |

2-й ряд
- Структуры некоторых хлоридов металлов
Некоторые гомолептические комплексы переходных металлов второго ряда содержат связи металл-металл.
| Сложный | цвет | электронный конфиг. | геометрия | Комментарии |
|---|---|---|---|---|
| [ZrCl6]2− | желтый | (т2 г)0 | восьмигранный | Расстояние Zr-Cl = 2,460 Å (Мне4N+)2 соль[20] |
| [Zr2Cl10]2− | бесцветный | (т2 г)0 | биоктаэдр с общим ребром | Zr-Cl = 2,36 Å (концевой), 2,43 Å (мостиковый) N (PCl3)2)+ соль[3] |
| [NbCl5] | желтый | (т2 г) | биоктаэдрические с общими краями [Nb2Cl10] | |
| [NbCl6]− | желтый | (т2 г)0 | восьмигранный | Nb-Cl = 2,34 Å N (PCl3)2)+ соль[3] |
| [Nb6Cl18]2- | чернить | Nb-Cl = 2,92 Å (K+) 2 соли[21] | ||
| MoCl6 | чернить | (т2 г)0 | октаэдр | Mo-Cl = 2,28 -2,31 Å[6]10.1524 / ncrs.2004.219.2.101 |
| [MoCl6]2- | желтый | (т2 г)2 | октаэдр | Mo-Cl = 2,37, 2,38, 2,27 Å[22] |
| [MoCl6]3- | розовый | (т2 г)3 | восьмигранный | |
| [Пн2Cl8]4- | фиолетовый[23] | d4 | Четырехкратная облигация Mo-Mo 10.1002 / zaac.19845080113 | |
| [Пн2Cl9]3- | d3 | Длина (тройной) связи Mo-Mo = 2,65 Å. Длина связи Mo-Cl (концевой) = 2,38 Å. Длина связи Mo-Cl (мостиковая) = 2,49 Å.[24] | ||
| [Пн2Cl10]2-[25][26] | d1d1 | |||
| [Пн5Cl13]2- | коричневый[23] | d2d2d2d2d3 | неполный октаэдр[27] | |
| [Пн6Cl14]2- | желтый | d4 | октаэдрический кластер | |
| [RuCl6]2− | коричневый | (т2 г)4 | восьмигранный | (EtPPh3+)2 соль[28] |
| [RU3Cl12]4− | зеленый | (d5)2(d6) | кофасциальный триоктаэдрический | Длина связи Ru-Ru = 2,86 Å. Длина связи Ru-Cl = 2,37-2,39 Å. (Et4N+)2(ЧАС7О3+)2 соль[29] |
| [RhCl6]3− | красный | (т2 г)6 | восьмигранный | ЧАС2N+(CH2CH2NH3+)2 соль)[30] |
| [Rh2Cl9]3− | красно-коричневый | (т2 г)6 | восьмигранный | Rh-Cl (концевой) = 2,30 Å, Rh-Cl (концевой) = 2,40 Å ((Мне3CH2Ph)+)3 соль)[24] |
| [PdCl4]2− | коричневый | d8 | квадратный плоский | |
| [PdCl6]2− | коричневый | d6 | восьмигранный | необычный пример Pd (IV) |
| [AgCl2]− | белый / бесцветный | d10 | линейный | соль [K (2.2.2-крипта)]+[31] |
| [CdCl4]2− | белый / бесцветный | d10 | четырехгранный | Et4N+ соли, расстояние Cd-Cl составляет 2,43 Å[19] |
| [CD2Cl6]2− | белый / бесцветный | d10 | битетраэдр с общими ребрами | (C6N3(4-С5ЧАС4N)33+ соль[32] |
| [CD3Cl12]6− | белый / бесцветный | d10 | октаэдрический (центральный Cd) пентакоординат (терминальные компакт-диски) кофакционный триоктаэдр | (C6N3(4-С5ЧАС4N)33+ соль[32] (3,8-диаммоний-6-фенилфенантридин3+)2[33] |
| [CD6Cl19]7− | белый / бесцветный | d10 | октаэдр октаэдров | 4,4 '- (С6ЧАС3(2-Et) NH3+)2 соль[34] |
3-й ряд
| Сложный | цвет | электронный конфиг. | геометрия | Комментарии |
|---|---|---|---|---|
| [HfCl6]2− | белый | (т2 г)0 | восьмигранный | Расстояние Hf-Cl = 2,448 A ((Мне4N+)2 соль)[20] |
| [Hf2Cl10]2− | бесцветный / белый | (т2 г)0 | биоктаэдрический[35] | |
| [Hf2Cl9]− | бесцветный / белый | (т2 г)0 | биоктаэдр с общей гранью[36] | |
| [TaCl5] | белый | (т2 г)0 | биоктаэдр с общим ребром | |
| [TaCl6]− | белый / бесцветный | (т2 г)0 | восьмигранный | Ta-Cl = 2,34 Å (N (PCl3)2)+ соль)[3] |
| [Та6Cl18]2- | зеленый | d0 | восьмигранный | Ta-Ta = 2,34 Å (ЧАС+2 гексагидрат соли[37] |
| WCl6 | синий | (т2 г)0 | восьмигранный | 2,24–2,26 Å[38] |
| [WCl6]2− | (т2 г)2 | восьмигранный | Расстояние W-Cl составляет от 2,34 до 2,37 Å. (PPh4+ соль)[39] | |
| [WCl6]− | (т2 г)1 | восьмигранный | Расстояние W-Cl = 2,32 Å (Et4N+ соль)[40] | |
| [W2Cl9]2− | d3d2 | биоктаэдр с разделением лиц | Расстояние W-W = 2,54 Å W-Cl (концевой) = 2,36 Å, W-Cl (мостик) = 2,45 Å ((PPN+)2 соль)[41] | |
| [W2Cl9]3− | d3d3 | восьмигранный | Расстояние W-Cl = 2,32 Å (Et4N+ соль)[41] | |
| [W3Cl13]3− | d3, d3, d4 | [W3(μ3-Cl) (мк-Cl)3Cl9]3- | Расстояние W-W = 2,84 Å[42] | |
| [W3Cl13]2− | d3, d4, d4 | [W3(μ3-Cl) (мк-Cl)3Cl9]3-[42] | Расстояние W-W = 2,78 Å[42] | |
| [W6Cl14]2- | желтый[43] | (d4)6 | см. Мо6Cl12 | |
| [ReCl6]− | красно-коричневый | (т2 г)6 | восьмигранный | Расстояние Re-Cl = 2,24-2,31 Å (PPh4+ соль)[44] |
| [ReCl6] | (т2 г)1 | восьмигранный | Расстояние Re-Cl = 226,3 (6) Å[6] | |
| [ReCl6]2− | зеленый | (т2 г)5 | восьмигранный | Расстояние Re-Cl = 2,35-2,38 Å ((PPN+)2 соль)[45] |
| [Re2Cl9]2− | (т2 г)5 | биоктаэдр с разделением лиц | Расстояние Re-Re = 2,48 Å Расстояния Re-Cl = 2,42 Å (мостик), 2,33 Å (конец) ((Et4N+)2 соль)[46] | |
| [Re2Cl9]− | (т2 г)5 | биоктаэдр с разделением лиц | Расстояние Re-Re = 2,70 Å Расстояния Re-Cl = 2,41 (мостик), 2,28 Å (конец) (Bu4N+ соль)[46] | |
| [Операционные системы2Cl10]2− | (т2 г)5 | восьмигранный | (Et4N+)2 соль [47] соль | |
| [OsCl6]− | (т2 г)5 | восьмигранный | Расстояние Os-Cl составляет 2,28 Å. | |
| [OsCl6]2− | (т2 г)4 | восьмигранный[48] | Расстояние Os-Cl 2,33 Å | |
| [IrCl6]3− | красный | (т2 г)6 | восьмигранный | Ir-Cl = 2,36 Å[49] |
| [IrCl6]2− | коричневый | (т2 г)5 | восьмигранный | Ir-Cl = 2,33 Å[50] |
| [PtCl4]2− | розовый | d8 | квадратный плоский | |
| [PtCl6]2− | желтый | d6 | восьмигранный | Расстояние Pt-Cl = 2,32 Å Et4N+ соль, ((Me4N+)2 соль)[20] |
| [AuCl2]− | белый / бесцветный | d10 | линейный | Расстояния Au-Cl 2,28 Å 4+ Сал[51] |
| [AuCl4]− | желтый | d8 | квадратный плоский | Расстояния Au-Cl 2,26 Å НБУ4+ соль[52] |
| [HgCl4]2− | белый / бесцветный | d10 | четырехгранный | Расстояние Hg-Cl составляет 2,46 Å.[19] Et4N+ соль |
| [Hg2Cl6]2− | белый / бесцветный | d10 | битетраэдрический | Расстояние Hg-Cl составляет 2,46 Å.[53] Бу4N+ соль |
Гетеролептические комплексы
Гетеролептические комплексы, содержащие хлорид, многочисленны. Большинство гидратированных галогенидов металлов относятся к этому классу. Гексамминкобальта (III) хлорид и Цисплатин (СНГ-Pt (NH3)2Cl2) являются яркими примерами металл-аммин-хлоридов.
Увлажняет

Как указано в таблице ниже, много гидратов хлоридов металлов представляют собой молекулярные комплексы.[54][55] Эти соединения часто являются важными коммерческими источниками хлоридов переходных металлов. Некоторые гидратированные хлориды металлов немолекулярны и поэтому не включены в эту таблицу. Например, дигидраты хлорид марганца (II), хлорид никеля (II), хлорид меди (II), хлорид железа (II), и хлорид кобальта (II) находятся координационные полимеры.
| Формула гидратированные галогениды металлов | Координация сфера из металла |
|---|---|
| VCl3(ЧАС2O)6 | транс- [VCl2(ЧАС2O)4]+[56] |
| CrCl3(ЧАС2O)6 | транс- [CrCl2(ЧАС2O)4]+ |
| CrCl3(ЧАС2O)6 | [CrCl (H2O)5]2+ |
| CrCl2(ЧАС2O)4 | транс- [CrCl2(ЧАС2O)4] |
| CrCl3(ЧАС2O)6 | [Cr (H2O)6]3+[57] |
| MnCl2(ЧАС2O)6 | транс- [MnCl2(ЧАС2O)4] |
| MnCl2(ЧАС2O)4 | СНГ- [MnCl2(ЧАС2O)4][58] |
| FeCl2(ЧАС2O)6 | транс- [FeCl2(ЧАС2O)4] |
| FeCl2(ЧАС2O)4 | транс- [FeCl2(ЧАС2O)4] |
| FeCl3(ЧАС2O)6 | один из четырех гидратов хлорид железа,[59] |
| FeCl3(ЧАС2O)2.5 | СНГ- [FeCl2(ЧАС2O)4]+[60] |
| CoCl2(ЧАС2O)6 | транс- [CoCl2(ЧАС2O)4] |
| CoCl2(ЧАС2O)4 | СНГ- [CoCl2(ЧАС2O)4] |
| NiCl2(ЧАС2O)6 | транс- [NiCl2(ЧАС2O)4] |
| NiCl2(ЧАС2O)4 | СНГ- [NiCl2(ЧАС2O)4] |
Эфирные комплексы
Хлориды металлов образуют аддукты с простыми эфирами, особенно с тетрагидрофураном.[61] и хелатирующие эфиры. Эти соединения часто являются важными реагентами, поскольку они растворимы и безводны.
| Формула Комплексы металл-хлорид-эхер | Координация сфера из металла | цвет |
|---|---|---|
| TiCl4(thf)2 | TiO2Cl4 | желтый |
| TiCl3(thf)3 | TiO3Cl3 | синий |
| ZrCl4(thf)2 | ZrO2Cl4 | белый |
| HfCl4(thf)2 | HfO2Cl4 | белый |
| VCl3(thf)3 | VO3Cl3 | розовый |
| NbCl4(thf)2 | NbO2Cl4 | желтый |
| NiCl2(диметоксиэтан)2 | NiCl2О4 | желтый[62] |
Рекомендации
- ^ Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
- ^ Дж. Ф. Хартвиг (2009). «4: Ковалентные (X-типа) лиганды, связанные через связи металл-гетероатом». Органопереходная химия металлов. ISBN 978-1-891389-53-5.
- ^ а б c d Ривард, Эрик; McWilliams, Andrew R .; Лох, Алан Дж .; Манеры, Ян (2002). "Бис (трихлорфосфин) иминия соли, [Cl3P = N = PCl3]+, с противоионами галогенидов переходных металлов ». Acta Crystallographica Раздел C Связь с кристаллической структурой. 58 (9): i114 – i118. Дои:10.1107 / S0108270102012532. PMID 12205363.
- ^ Castro, Stephanie L .; Streib, William E .; Хаффманн, Джон С .; Христу, Джордж (1996). "Смешанная валентность (TiIIITiIV) Карбоксилатный комплекс: кристаллическая структура и свойства [Ti2OCl3(O2CPh)2(THF)3] и [NEt4] 3 [Ti2Cl9]". Химические коммуникации (18): 2177. Дои:10.1039 / CC9960002177.
- ^ Чен, Линьфэн; Коттон, Ф. Альберт (1998). «Синтез, реакционная способность и рентгеновские структуры комплексов Ti (III) с разделением граней; новый трехъядерный ион [Ti3Cl12] 3–». Многогранник. 17 (21): 3727–3734. Дои:10.1016 / S0277-5387 (98) 00171-5.
- ^ а б c Тамадон, Фархад; Сеппельт, К. (2012). "Неуловимые галиды VCl"5, MoCl6, и ReCl6". Angewandte Chemie International Edition. 52 (2): 767–769. Дои:10.1002 / anie.201207552. PMID 23172658.CS1 maint: использует параметр авторов (связь)
- ^ Хэйтон, Тревор В .; Патрик, Брайан О .; Легздиньш, Питер (2004). «Новые подробности о реакциях оксида азота с тетрахлоридом ванадия». Неорганическая химия. 43 (22): 7227–7233. Дои:10.1021 / ic0491534. PMID 15500362.
- ^ Филипенко О.С., Макитова Д.Д., Красочка О.Н., Пономарев В.И., Атовмян Л.О. (1987). Коорд. Хим. 13: 669. Отсутствует или пусто
| название =(помощь)CS1 maint: несколько имен: список авторов (связь) - ^ а б c d е ж грамм час Gill, N.S .; Тейлор, Ф. Б. (1967). «Тетрахалоидные комплексы дипозитивных металлов в первой переходной серии». Неорганические синтезы. 9: 136–142. Дои:10.1002 / 9780470132401.ch37. ISBN 9780470132401.
- ^ Чанг, Джуй-Ченг; Хо, Вен-Юэ; Вс, И-Вэнь; Чжоу, Ю-Кай; Се, Синь-Сю; Ву, Цзи-И (2011). «Синтез и свойства новых солей тетрахлорокобальтата (II) и тетрахлорманганата (II) с дикионными противоионами». Многогранник. 30 (3): 497–507. Дои:10.1016 / j.poly.2010.11.009.
- ^ а б c d Сунь, Джуй-Суй; Чжао, Ханьхуа; Оуян, Сян; Клерак, Родольф; Смит, Дженнифер А .; Clemente-Juan, Juan M .; Гомес-Гарсия, Карлос; Коронадо, Эухенио; Данбар, Ким Р. (1999). «Структуры, магнитные свойства и исследования реакционной способности солей, содержащих двухъядерный анион [M2Cl6] 2- (M = Mn, Fe, Co)». Неорганическая химия. 38 (25): 5841–5855. Дои:10.1021 / ic990525w.
- ^ Моус, П. К. (1966). «Кристаллическая структура, видимые и ультрафиолетовые спектры гексахлорманганата калия (IV)». Неорганическая химия. 5: 5–8. Дои:10.1021 / ic50035a002.
- ^ Сен, Абхиджит; Свейн, Диптиканта; Guru Row, Tayur N .; Сундаресан, А. (2019). «Беспрецедентный гистерезис 30 K через переключаемые диэлектрические и магнитные свойства в ярком люминесцентном органо-неорганическом галогениде (CH6N3) 2MnCl4» (PDF). Журнал химии материалов C. 7 (16): 4838–4845. Дои:10.1039 / C9TC00663J.
- ^ Лутц, Мартин; Хуанг, Юсин; Морэ, Марк-Этьен; Кляйн Геббинк, Робертус Дж. М. (2014). «Фазовые переходы и двойниковые низкотемпературные структуры тетрахлоридоферрата (III) тетраэтиламмония». Acta Crystallographica Раздел C Структурная химия. 70 (5): 470–476. Дои:10.1107 / S2053229614007955. HDL:1874/307900. PMID 24816016.
- ^ Stucky, G.D .; Folkers, J. B .; Кистенмахер, Т. J. (1967). «Кристаллическая и молекулярная структура тетрахлороникелата тетраэтиламмония (II)». Acta Crystallographica. 23 (6): 1064–1070. Дои:10.1107 / S0365110X67004268.
- ^ а б Гердес, Эллисон; Бонд, Маркус Р. (2009). «Octakis (диметиламмоний) гекса-μ2-хлорид-гексахлоридотриникелат (II) дихлорид: линейный комплекс триникеля с асимметричным мостиком». Acta Crystallographica Раздел C Связь с кристаллической структурой. 65 (10): m398 – m400. Дои:10.1107 / S0108270109036853. PMID 19805875.
- ^ Mahoui, A .; Lapasset, J .; Moret, J .; Сен-Грегуар, П. (1996). «Тетраэтиламмоний Тетрахлоркупрат (II), [(C2H5) 4N] [(CH3) 4N] [CuCl4]». Acta Crystallographica Раздел C Связь с кристаллической структурой. 52 (11): 2674–2676. Дои:10.1107 / S0108270196009031.
- ^ Willett, Roger D .; Мясник, Роберт Э .; Landee, Christopher P .; Твэмли, Брендан (2006). «Обмен двух галогенидов в димерах галогенидов меди (II): (4,4′-бипиридиний) Cu2Cl6-х BRX". Многогранник. 25 (10): 2093–2100. Дои:10.1016 / j.poly.2006.01.005.
- ^ а б c Mahoui, A .; Lapasset, J .; Moret, J .; Сен-Грегуар, П. (1996). «Бис (тетраэтиламмоний) тетрахлорметаллаты, [(C2H5) 4N] 2 [MCl4], где M = Hg, Cd, Zn». Acta Crystallographica Раздел C Связь с кристаллической структурой. 52 (11): 2671–2674. Дои:10.1107 / S010827019600666X.
- ^ а б c Аутильо, Матье; Уилсон, Ричард Э. (2017). «Фазовые переходы в соединениях гексахлорметаллата тетраметиламмония (ТМА)2MCl6 (M = U, Np, Pt, Sn, Hf, Zr) ". Европейский журнал неорганической химии. 2017 (41): 4834–4839. Дои:10.1002 / ejic.201700764.
- ^ Саймон, Арндт; фон Шнеринг, Ханс-Георг; Шефер, Харальд (1968). "Beiträge zur Chemie der Elemente Niob und Tantal. LXIX K4Nb6Cl18 Darstellung, Eigenschaften und Struktur ". Zeitschrift für anorganische und allgemeine Chemie. 361 (5–6): 235–248. Дои:10.1002 / zaac.19683610503.
- ^ Рабе, Сюзанна; Бубенхайм, Вильфрид; Мюллер, Ульрих (2004). «Кристаллические структуры ацетонитрильных сольватов бис (тетрафенилфосфония), тетрахлороксованадата (IV), гексахлоростанната (IV) и -молибдата (IV), [P (C6ЧАС5)4] 2 [VOCl4] · 4CH3CN, [P (C6ЧАС5)4] 2 [MCl6] · 4CH3CN (M = Sn, Mo) ". Zeitschrift für Kristallographie - Новые кристаллические структуры. 219 (2): 101–105. Дои:10.1524 / ncrs.2004.219.2.101. S2CID 201122319.
- ^ а б Brignole, A.B .; Cotton, F. A .; Дори, З. (1972). Соединения рения и молибдена, содержащие четверные связи. Неорг. Synth. 13. С. 81–89. Дои:10.1002 / 9780470132449.ch15.
- ^ а б Cotton, F.A; Учко, Дэвид А. (1972). "Структура триметилфениламмония нонахлородиродата (III) и обзор взаимодействий металл-металл в конфасиальных биоктаэдрах". Неорганика Chimica Acta. 6: 161–172. Дои:10.1016 / S0020-1693 (00) 91778-X.
- ^ . Дои:10.1524 / ncrs.2004.219.2.101. Цитировать журнал требует
| журнал =(помощь); Отсутствует или пусто| название =(помощь) - ^ Эй, Э .; Веллер, Ф .; Дехнике, К. (1984). "Synthese und Kristallstruktur von (PPh4)2[Пн2Cl10]". Zeitschrift für anorganische und allgemeine Chemie. 508: 86–92. Дои:10.1002 / zaac.19845080113.
- ^ Ахмед, Эджаз; Рак, Майкл (2011). «Химия полиядерных комплексов переходных металлов в ионных жидкостях». Dalton Transactions. 40 (37): 9347–57. Дои:10.1039 / c1dt10829h. PMID 21743925.
- ^ Шарутин, В. В .; Шарутина, О.К .; Сенчурин, В. С .; Андреев П.В. (2018). «Синтез и структура комплексов рутения $$ rm [{Ph_ {3} PR] _2 ^ + [RuCl6] ^ {2 -}} $$ [Ph3PR] 2 + [RuCl6] 2 - (R = C2ЧАС5, CH = CHCH3, CH2CH = CHCH3, CH2ОСН3) и $$ rm [{Ph_ {3PCH2CH = CHCH2{PPh3}] _ 2 ^ {2 +} [Ru_2Cl_ {10} O] ^ {4 -}} $$ [Ph3PCH2CH = CHCH2PPh3 ] 2 2 + [Ru2Cl10O]4− · 4H2О ". Российский журнал неорганической химии. 63 (9): 1178–1185. Дои:10.1134 / S0036023618090188. S2CID 105746627.
- ^ Бино, Ави; Коттон, Ф. Альберт (1980). "Линейный трехъядерный хлорный комплекс рутения со смешанной валентностью, [Ru3Cl12]4-". Журнал Американского химического общества. 102 (2): 608–611. Дои:10.1021 / ja00522a027.
- ^ Фрэнк, Уолтер; Reiß, Guido J .; Кляйнвехтер, Инго (1996). "Spezielle Alkylammoniumhexachlorometallate. I. Kristallisationsverhalten und Kristallstruktur von Diethylentriammoniumhexachlororhodat, [H3N (CH2)2NH2(CH2)2NH3] [RhCl6]". Zeitschrift für anorganische und allgemeine Chemie. 622 (4): 729–733. Дои:10.1002 / zaac.19966220428.
- ^ Helgesson, Goeran; Ягнер, Сьюзен (1991). «Галогеноаргентат (I) с необычной координационной геометрией. Синтез и структура калийных крипт солей хлор-, бром- и йодааргентатов (I), включая первый пример двухкоординированного хлороаргентата (I) в твердом состоянии». Неорганическая химия. 30 (11): 2574–2577. Дои:10.1021 / ic00011a024.
- ^ а б Хао, Пэнфэй; Го, Чунью; Шен, Джунджу; Фу, Юньлун (2019). «Новый фотохромный гибрид, содержащий трехъядерные кластеры [Cd3Cl12] 6- и протонированные трипиридил-триазины». Dalton Transactions. 48 (44): 16497–16501. Дои:10.1039 / C9DT03494C. PMID 31559400.
- ^ Костин-Хоган, Кристина Е .; Чен, Чун-Лонг; Хьюз, Эмма; Пикетт, Остин; Валенсия, Ричард; Rath, Nigam P .; Битти, Алисия М. (2008). ""Реверс «инженерия: К кластерам галогенида кадмия 0-D». CrystEngComm. 10 (12): 1910. Дои:10.1039 / b812504j.
- ^ Чен, Чун-Лонг; Битти, Алисия М. (2007). «От инженерии кристаллов к инженерии кластеров: как преобразовать хлорид кадмия из 2-D в 0-D». Chem. Commun. (1): 76–78. Дои:10.1039 / B613761J. PMID 17279266.
- ^ Ноймюллер, Бернхард; Дехнике, Курт (2004). "Die Kristallstrukturen von (Ph4П)2[HfCl6] 2CH2Cl2 und (Ph4П)2[Hf2Cl10] CH2Cl2". Zeitschrift für anorganische und allgemeine Chemie. 630 (15): 2576–2578. Дои:10.1002 / zaac.200400370.
- ^ Дёттерль, Маттиас; Хаас, Изабель; Альт, Гельмут Г. (2011). «Поведение растворимости TiCl.4, ZrCl4, и HfCl4 в хлороалюминатных ионных жидкостях ". Zeitschrift für anorganische und allgemeine Chemie. 637 (11): 1502–1506. Дои:10.1002 / zaac.201100244.
- ^ Джейкобсон, Роберт А .; Такстон, Чарльз Б. (1971). «Кристаллическая структура H2 [Ta6Cl18] .6H2O». Неорганическая химия. 10 (7): 1460–1463. Дои:10.1021 / ic50101a029.
- ^ Дж. К. Тейлор, П. В. Уилсон (1974). «Структура β-гексахлорида вольфрама с помощью порошковых нейтронов и рентгеновской дифракции». Acta Crystallographica. B30 (5): 1216–1220. Дои:10.1107 / S0567740874004572.CS1 maint: использует параметр авторов (связь)
- ^ Lau, C .; Дитрих, А .; Тарелка, М .; Dierkes, P .; Neumüller, B .; Wocadlo, S .; Massa, W .; Harms, K .; Дехнике, К. (2003). "Die Kristallstrukturen der Hexachlorometallate NH4[SbCl6], NH4[WCl6], [K (18-Крона-6) (CH2Cl2)]2[WCl6] · 6 каналов2Cl2 унд (PPh4)2[WCl6] · 4CH3CN ». Zeitschrift für Anorganische und Allgemeine Chemie. 629 (3): 473–478. Дои:10.1002 / zaac.200390078.
- ^ Eichler, W .; Зейферт, Х.-Дж. (1977). "Strukturelle und magnetische Untersuchungen an Hexachlorowolframaten (V)". Zeitschrift für anorganische und allgemeine Chemie. 431: 123–133. Дои:10.1002 / zaac.19774310112.
- ^ а б Коттон, Ф. Альберт; Фалвелло, Ларри Р .; Mott, Graham N .; Schrock, Ричард Р .; Стерджофф, Линда Г. (1983). «Структурная характеристика иона нехлоровольфрама (II, III)». Неорганическая химия. 22 (18): 2621–2623. Дои:10.1021 / ic00160a031.
- ^ а б c Колесниченко, Владимир; Люси, Джеффри Дж .; Свенсон, Дейл С.; Мессерле, Луи (1998). «W3 (μ3-Cl) (μ-Cl) 3Cl9n- (n = 2, 3), Дискретные монокапсулированные кластеры тритольфрама, полученные из нового бинарного хлорида вольфрама, W3Cl10: влияние счета электронов на связывание в изоструктурных триангуло M3X13Clusters1». Журнал Американского химического общества. 120 (50): 13260–13261. Дои:10.1021 / ja9831958.
- ^ Колесниченко, Владимир; Мессерле, Луи (1998). «Простое восстановление галогенидов вольфрама с помощью нетрадиционных мягких восстановителей. 2. Четыре удобных, высокопродуктивных твердотельных синтеза кластера додекахлорида гексавольфрама W6Cl12 и кластерной кислоты (H3O) 2 [W6 (μ3-Cl) 8Cl6] (OH2) x, Включая новые катионо-катионные тройные маршруты ». Неорганическая химия. 37 (15): 3660–3663. Дои:10.1021 / ic980232n. PMID 11670462.
- ^ Arp, O .; Preetz, W. (1994). "Darstellung, Schwingungsspektren und Normalkoordinatenanalyse von Hexachlororhenat (V) sowie Kristallstruktur von [P (C6ЧАС5)4] [ReCl6]". Zeitschrift für anorganische und allgemeine Chemie. 620 (8): 1391–1396. Дои:10.1002 / zaac.19946200811.
- ^ «Структура ди [бис (трифенилфосфин) иминия] гексахлоррената (IV)». Acta Crystallographica Раздел C Связь с кристаллической структурой. 44 (4): 751–753. 1988. Дои:10.1107 / S0108270187011910.
- ^ а б Heath, Graham A .; Макгрейди, Джон Э .; Raptis, Raphael G .; Уиллис, Энтони С. (1996). «Валентно-зависимая связь металл-металл и оптические спектры в конфациальном биоктаэдре [Re2Cl9]z-(z = 1, 2, 3). Кристаллографические и расчетные характеристики [Re2Cl9]−и [Re2Cl9]2-". Неорганическая химия. 35 (23): 6838–6843. Дои:10.1021 / ic951604k. PMID 11666851.
- ^ Б. Кребс, Г. Хенкель, М. Дартманн, В. Приц, М. Брюнс (1984). «Реакции и структура [(C2H5) 4N] [OsCl6] и [(n-C4H9) 4N] 2 [Os2Cl10] / Реакции и структуры [(C2H5) 4N] [OsCl6] и [(n-C4H9) 4N] 2 [Os2Cl10] ". З. Натурфорш. 39 (7): 843. Дои:10.1515 / znb-1984-0701. S2CID 95254820.CS1 maint: несколько имен: список авторов (связь)
- ^ Kim, Eunice E .; Эрикс, Клаас; Магнусон, Рой (1984). «Кристаллические структуры тетрафенилфосфониевых солей гексахлоросмата (V) и гексахлоросмата (IV), [(C6ЧАС5)4P] OsCl6 и [(C6ЧАС5)4П]2OsCl6". Неорганическая химия. 23 (4): 393–397. Дои:10.1021 / ic00172a003.
- ^ Ранкин Д.А.; Penfold, BR; Фергюссон, Дж. Э. (1983). «Хлор- и бромокомплексы иридия (III) и иридия (IV). II. Структурная химия комплексов IrIII». Австралийский химический журнал. 36 (5): 871. Дои:10.1071 / CH9830871.
- ^ Санчис-Перучо, Адриан; Мартинес-Лилло, Хосе (2019). «Обменное ферромагнитное взаимодействие в новой цепочке Ir (IV) –Cu (II) на основе аниона гексахлоридата (IV)». Dalton Transactions. 48 (37): 13925–13930. Дои:10.1039 / C9DT02884F. PMID 31411207.
- ^ Хельгессон, Горан; Джагнер, Сьюзен; Vicentini, G .; Rodellas, C .; Ниинистё, Л. (1987). "Кристаллические структуры дихлораурата тетраэтиламмония (I) и дииодоаурата тетраэтиламмония (I)". Acta Chemica Scandinavica. 41а: 556–561. Дои:10.3891 / acta.chem.scand.41a-0556.
- ^ Бакли, Робби В .; Хили, Питер К .; Лафлин, Венди А. (1997). "Сокращение [НБУ4] [AuCl4] в [NBu4] [AuCl2] с ацетилацетонатом натрия ». Австралийский химический журнал. 50 (7): 775. Дои:10.1071 / C97029.
- ^ Гоггин, Питер Л .; Кинг, Пол; МакЭван, Дэвид М .; Тейлор, Грэм Э .; Вудворд, Питер; Сандстрём, Магнус (1982). «Колебательные спектроскопические исследования тригалогеномеркуратов тетра-н-бутиламмония; кристаллические структуры [NBun4] (HgCl3) и [NBun4] - (HgI3)». J. Chem. Soc., Dalton Trans (5): 875–882. Дои:10.1039 / dt9820000875.
- ^ Waizumi, K .; Masuda, H .; Отаки, Х. (1992). «Рентгеноструктурные исследования FeBr2 • 4H2O, CoBr2 • 4H2O, NiCl2 • 4H2O и CuBr2 • 4H2O. Селективность цис / транс в тетрагидрате дигалогенида переходного металла (II) ». Неорганика Chimica Acta. 192: 173–181. Дои:10.1016 / S0020-1693 (00) 80756-2.
- ^ Моросин, Б. (1967). "Исследование дифракции рентгеновских лучей на дигидрате хлорида никеля (II)". Acta Crystallogr. 23 (4): 630–634. Дои:10.1107 / S0365110X67003305.
- ^ Донован, Уильям Ф .; Смит, Питер В. (1975). «Кристаллическая и молекулярная структура комплексов аквагалогенованадия (III). Часть I. Рентгеноструктура кристаллов. транс-Тетракисквадибром-ванадий (III) бромид дигидрат и изоморфное хлор-соединение ». Журнал химического общества, Dalton Transactions (10): 894. Дои:10.1039 / DT9750000894.
- ^ Андресс, К.Р .; Карпентер, К. "Кристаллгидрат. II.Die Struktur von Chromchlorid- und Aluminiumchloridhexahydrat" Zeitschrift für Kristallographie, Kristallgeometrie, Kristallphysik, Kristallchemie 1934, volume 87, p446-p463.
- ^ Залкин, Аллан; Forrester, J.D .; Темплтон, Дэвид Х. (1964). «Кристаллическая структура тетрагидрата дихлорида марганца». Неорганическая химия. 3 (4): 529–33. Дои:10.1021 / ic50014a017.
- ^ Линд, М. Д. (1967). «Кристаллическая структура гексагидрата хлористого железа». Журнал химической физики. 47 (3): 990–993. Bibcode:1967JChPh..47..990L. Дои:10.1063/1.1712067.
- ^ Саймон А. Коттон (2018). «Хлорид железа (III) и его координационная химия». Журнал координационной химии. 71 (21): 3415–3443. Дои:10.1080/00958972.2018.1519188. S2CID 105925459.
- ^ Манзер, Л. Э. (1982). Тетрагидрофурановые комплексы отдельных металлов с ранним переходом. Неорганические синтезы. 21. С. 135–140. Дои:10.1002 / 9780470132524.ch31.
- ^ Уорд, Лэрд Г. Л. (1972). «Безводные галогениды никеля (II) и их тетракис (этанол) и 1,2-диметоксиэтановые комплексы». Неорганические синтезы. Неорганические синтезы. 13. С. 154–164. Дои:10.1002 / 9780470132449.ch30. ISBN 9780470132449.