WikiDer > Хлорид циркония (IV)
 | |
 | |
 | |
| Имена | |
|---|---|
| Имена ИЮПАК Тетрахлорид циркония Хлорид циркония (IV) | |
| Идентификаторы | |
3D модель (JSmol) | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.030.041 |
| Номер ЕС |
|
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| ZrCl4 | |
| Молярная масса | 233,04 г / моль |
| Внешность | белые кристаллы гигроскопичный |
| Плотность | 2,80 г / см3 |
| Температура плавления | 437 ° С (819 ° F, 710 К) (тройная точка) |
| Точка кипения | 331 ° С (628 ° F, 604 К) (сублимированные) |
| гидролиз | |
| Растворимость | концентрированный HCl (с реакцией) |
| Структура | |
| Моноклиника, mP10 | |
| П12 / с1, № 13 | |
| Термохимия | |
Теплоемкость (C) | 125,38 Дж К−1 моль−1 |
Стандартный моляр энтропия (S | 181,41 Дж К−1 моль−1 |
Станд. Энтальпия формирование (ΔжЧАС⦵298) | -980,52 кДж / моль |
| Опасности | |
| Паспорт безопасности | MSDS |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | Негорючий |
| Смертельная доза или концентрация (LD, LC): | |
LD50 (средняя доза) | 1688 мг / кг (перорально, крысы) 655 мг / кг (мышь, перорально)[1] |
| Родственные соединения | |
Другой анионы | Фторид циркония (IV) Бромид циркония (IV) Иодид циркония (IV) |
Другой катионы | Тетрахлорид титана Тетрахлорид гафния |
Родственные соединения | Хлорид циркония (II), Хлорид циркония (III) |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Хлорид циркония (IV), также известный как тетрахлорид циркония, (ZrCl4) является неорганическое соединение часто используется в качестве предшественника других соединений циркония. Это белое тугоплавкое твердое вещество быстро гидролизуется во влажном воздухе.
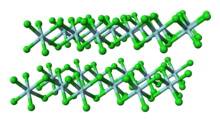
Структура
В отличие от молекулярного TiCl4, твердый ZrCl4 имеет полимерную структуру, в которой каждый Zr координирован октаэдрически. Эта разница в структурах является причиной несоответствия их свойств: TiCl
4 можно перегонять, но ZrCl
4 твердое тело. В твердом состоянии ZrCl4 имеет линейную полимерную структуру в виде ленты - такую же структуру использует HfCl4. Этот полимер легко разлагается при обработке Базы Льюиса, которые расщепляют связи Zr-Cl-Zr.[3]
Синтез
Это преобразование влечет за собой обработку оксида углеродом в качестве «геттера» оксида и хлора.
- ZrO2 + 2 С + 2 Cl2 → ZrCl4 + 2 СО
В процессе лабораторного масштаба используются четыреххлористый углерод вместо углерода и хлора:[4]
- ZrO2 + 2 CCl4 → ZrCl4 + 2 COCl2
Приложения
Предшественник металлического Zr
ZrCl4 является промежуточным звеном в превращении минералов циркония в металлический цирконий посредством Кролл процесс. В природе минералы циркония неизменно существуют в виде оксидов (что также отражено в тенденции всех хлоридов циркония к гидролизу). Для преобразования в объемный металл эти тугоплавкие оксиды сначала превращаются в тетрахлорид, который можно перегонять при высоких температурах. Очищенный ZrCl4 может быть восстановлен металлическим Zr для производства хлорид циркония (III).
Другое использование
ZrCl4 является наиболее распространенным предшественником химическое осаждение из паровой фазы из диоксид циркония и диборид циркония.[5]
В органическом синтезе тетрахлорид циркония используется как слабый Кислота Льюиса для Реакция Фриделя-Крафтса, то Реакция Дильса-Альдера и реакции внутримолекулярной циклизации.[6] Он также используется для водоотталкивающей обработки текстиль и другие волокнистые материалы.
Свойства и реакции
Гидролиз ZrCl4 дает гидратированный гидроксихлоридный кластер, называемый цирконил хлорид. Эта реакция быстрая и практически необратимая, что соответствует высокому оксофильность циркония (IV). По этой причине манипуляции с ZrCl4 обычно требуется безвоздушные методы.
ZrCl4 является основным исходным соединением для синтеза многих металлоорганических комплексов циркония.[7] Из-за своей полимерной структуры ZrCl4 перед использованием обычно превращается в молекулярный комплекс. Он образует комплекс 1: 2 с тетрагидрофуран: CAS [21959-01-3], т.пл. 175–177 ° C.[8] NaC5ЧАС5 реагирует с ZrCl4(THF)2 давать дихлорид цирконоцена, ZrCl2(C5ЧАС5)2, универсальный цирконийорганический комплекс.[9] Одно из самых любопытных свойств ZrCl4 его высокая растворимость в присутствии метилированных бензолов, таких как дюрен. Эта солюбилизация происходит за счет образования π-комплексов.[10]
Логарифм (основание 10) давления пара тетрахлорида циркония (от 480 до 689 К) определяется уравнением: log10(P) = -5400 / T + 11,766, где давление измеряется в торрс и температура в кельвины. Логарифм (основание 10) давления пара твердого тетрахлорида циркония (от 710 до 741 К) определяется уравнением log10(P) = -3427 / T + 9,088. Давление в точке плавления составляет 14 500 торр.[11]
| Викискладе есть медиафайлы по теме хлорид циркония (IV). |
Рекомендации
- ^ «Соединения циркония (в виде Zr)». Немедленно опасные для жизни и здоровья концентрации (IDLH). Национальный институт охраны труда и здоровья (NIOSH).
- ^ "New Environment Inc. - NFPA Chemicals". newenv.com. Получено 2017-04-26.
- ^ Н. Н. Гринвуд и А. Эрншоу, Химия элементов (2-е изд.), Баттерворт-Хайнеманн, Оксфорд, 1997.
- ^ Hummers, W. S .; Tyree, S. Y .; Йоллес, С. (1953). «Тетрахлориды циркония и гафния». Неорганические синтезы. IV. McGraw-Hill Book Company, Inc. стр. 121. Дои:10.1002 / 9780470132357.ch41. ISBN 9780470132357.
- ^ Рэндич, Э. (1 ноября 1979 г.). "Химические осажденные из паровой фазы бориды формы (Ti, Zr) B2 и (Ta, Ti) B2". Тонкие твердые пленки. 63 (2): 309–313. Bibcode:1979TSF .... 63..309R. Дои:10.1016/0040-6090(79)90034-8.
- ^ Бора У. (2003). «Тетрахлорид циркония». Synlett (7): 1073–1074. Дои:10.1055 / с-2003-39323.
- ^ Илан Марек, изд. (2005). Новые аспекты цирконийсодержащих органических соединений. Разделы металлоорганической химии. 10. Спрингер: Берлин, Гейдельберг, Нью-Йорк. Дои:10.1007 / b80198. ISBN 978-3-540-22221-7. ISSN 1436-6002.
- ^ Л. Э. Манзер; Джо Дитон (1982). Тетрагидрофурановые комплексы отдельных металлов с ранним переходом. Неорганические синтезы. 21. С. 135–140. Дои:10.1002 / 9780470132524.ch31. ISBN 978-0-470-13252-4.
- ^ Уилкинсон, Г.; Бирмингем, Дж. Г. (1954). «Бис-циклопентадиенильные соединения Ti, Zr, V, Nb и Ta». Варенье. Chem. Soc. 76 (17): 4281–4284. Дои:10.1021 / ja01646a008.
- ^ Musso, F .; Solari, E .; Floriani, C .; Шенк, К. (1997). «Активация углеводородов с помощью галогенидов металлов: тетрахлорид циркония, катализирующий реакцию Якобсена и способствующий тримеризации алкинов посредством образования η6-Арен-циркониевые (IV) комплексы ». Металлоорганические соединения. 16 (22): 4889–4895. Дои:10.1021 / om970438g.
- ^ Палко, А. А .; Ryon, A.D .; Кун, Д. В. (март 1958 г.). «Давление паров тетрахлорида циркония и тетрахлорида гафния». J. Phys. Chem. 62 (3): 319–322. Дои:10.1021 / j150561a017. HDL:2027 / mdp.39015086513051.
