WikiDer > Спектроскопия ядерного магнитного резонанса тройного резонанса
Эксперименты с тройным резонансом представляют собой набор многомерных спектроскопия ядерного магнитного резонанса (ЯМР) эксперименты, которые связывают три типа атомные ядра, чаще всего состоящий из 1ЧАС, 15N и 13C. Эти эксперименты часто используются для назначения определенных резонансных сигналов определенным атомам в изотопно-обогащенном белке. Впервые методика описана в работах Ad Bax, Мицухико Икура и Льюис Кей в 1990 г.,[1][2] а затем к набору экспериментов были добавлены дальнейшие эксперименты. Многие из этих экспериментов с тех пор стали стандартным набором экспериментов, используемых для последовательного определения резонансов ЯМР при определении структура белка по данным ЯМР. Теперь они являются неотъемлемой частью ЯМР-исследования белков в растворе, и их также можно использовать в твердотельный ЯМР.[3][4]
Фон
Существует два основных метода определения структуры белка на атомном уровне. Первый из них Рентгеновская кристаллография, начиная с 1958 г., когда кристаллическая структура миоглобин был определен. Второй метод - ЯМР, который начался в 1980-х годах, когда Курт Вютрих изложил основы для определения структуры белков ЯМР и решил структуру небольших глобулярных белков.[5] Ранний метод определения структуры белка с помощью ЯМР основывался на протонной гомоядерной ЯМР-спектроскопии, в которой размер белка, который может быть определен, ограничен ~ 10 кДа. Это ограничение связано с необходимостью присвоения сигналов ЯМР от большого количества ядер в белке - в большем белке большее количество ядер приводит к переполнению резонансов, а увеличение размера белка также расширяет сигналы, создавая резонанс. задание сложное. Эти проблемы могут быть решены путем использования гетероядерной ЯМР-спектроскопии, которая позволяет редактировать спектр протонов относительно 15N и 13C химические сдвиги, а также уменьшает перекрытие резонансов за счет увеличения числа измерений спектра. В 1990 году Эд Бакс и его коллеги разработали технологию тройного резонанса и экспериментировали с белками, изотопно меченными 15N и 13C,[1] В результате спектры значительно упрощаются, что значительно облегчает процесс определения резонанса и увеличивает размер белка, который может быть определен с помощью ЯМР.
Эти эксперименты с тройным резонансом используют относительно большой магнитный муфты между определенными парами ядер, чтобы установить их связь. В частности, 1JNH, 1JCH, 1JCC, и 1JCN связи используются для установления пути скалярной связи между ядрами. Процесс переноса намагниченности происходит через несколько эффективных этапов переноса намагниченности с одной связью, а не за один этап через меньшие и переменные 3JHH муфты. Относительно большой размер и хорошая однородность связей с одной связью позволили разработать эффективные схемы переноса намагниченности, которые эффективно однородны для данного белка, почти независимо от конформации.[3] Эксперименты с тройным резонансом, включающие 31п также могут быть использованы для исследований нуклеиновых кислот.[6]
Набор экспериментов
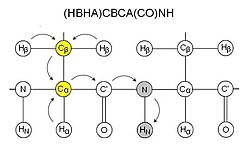
Эти эксперименты обычно называются ядрами (H, N и C), участвующими в эксперименте. СО относится к карбонильный углерод, а CA и CB относятся к Cα и Cβ соответственно, аналогично HA и HB для Hα и Hβ (примеры экспериментов см. на диаграмме). Ядра в названии упорядочены в той же последовательности, что и в пути передачи намагниченности, ядра, помещенные в круглые скобки, участвуют в пути передачи намагниченности, но не регистрируются. Из соображений чувствительности эти эксперименты обычно начинаются на протоне и заканчиваются на протоне, обычно через INEPT и обратные шаги INEPT. Следовательно, многие из этих экспериментов можно назвать экспериментами «туда и обратно», где, хотя это и не указано в названии, намагниченность передается обратно стартовому протону для получения сигнала.
Некоторые из экспериментов используются в тандеме для определения резонанса белка, например, HNCACB может использоваться вместе с CBCA (CO) NH в качестве пары экспериментов. Не все эти эксперименты необходимо записывать для последовательного назначения (это может быть выполнено всего с двумя), однако дополнительные пары экспериментов полезны для независимой оценки правильности назначения, а избыточность информации может потребоваться, когда в заданиях есть двусмысленность. Другие эксперименты также необходимы, чтобы полностью определить резонансы боковой цепи.
TROSY существуют версии многих из этих экспериментов для улучшения чувствительности.[7] Эксперименты с тройным резонансом также могут быть использованы для определения резонанса основной цепи для конкретной последовательности вращение под магическим углом Спектры ЯМР в твердотельный ЯМР.[4][8]
Было проведено большое количество экспериментов с тройным резонансом ЯМР, и эксперименты, перечисленные ниже, не являются исчерпывающими.
HNCO
Эксперимент устанавливает связи между амидом остатка с карбонильным углеродом предыдущих остатков.[2] Это самый чувствительный из экспериментов с тройным резонансом. Сайдчейны карбоксамиды из аспарагин и глутамин также видны в этом эксперименте. Кроме того, гуанидино группа аргинин, который имеет аналогичную константу взаимодействия с карбоксамидной группой, также может появиться в этом спектре. Этот эксперимент иногда используют вместе с HN (CA) CO.
HN (CA) CO
Здесь амидный резонанс остатка коррелирует с карбонильным углеродом того же остатка, а также предыдущего остатка. Резонансы внутри остатков обычно сильнее, чем резонансы между остатками.[9]
HN (CO) CA
Этот эксперимент коррелирует резонансы амида остатка с Cα предыдущего остатка. Этот эксперимент часто используют вместе с HNCA.[10]
HNCA
Этот эксперимент коррелирует химический сдвиг амида остатка с Cα того же остатка, а также смещения предыдущего остатка.[2] Каждая полоска дает два пика, пики Cα между остатками и внутри остатков. Пик от предыдущего Cα может быть идентифицирован из эксперимента HN (CO) CA, который дает только Cα между остатками.
CBCA (CO) NH
CBCA (CO) NH или, альтернативно, HN (CO) CACB, коррелирует резонансы амида остатка с Cα и Cβ предыдущего остатка.[11] Таким образом, для каждого остатка видны два пика, соответствующие Cα и Cβ. Этот эксперимент обычно используется вместе с HNCACB. Карбоксамид боковой цепи глутаминов и аспарагинов также появляется в этих спектрах в этом эксперименте. CBCA (CO) NH иногда более точно называют (HBHA) CBCA (CO) NH, поскольку он начинается с алифатических протонов и заканчивается амидным протоном, и поэтому не является постоянным экспериментом, как HN (CO) CACB.
HNCACB
HNCACB или, альтернативно, CBCANH, коррелирует химический сдвиг амида остатка Cα и Cβ того же остатка, что и предыдущего остатка.[12] На каждой полоске могут быть видны четыре пика - 2 от одного и того же остатка и 2 от предыдущего остатка. Пики от предыдущего остатка обычно слабее и могут быть идентифицированы с помощью CBCA (CO) NH. В этом эксперименте пики Cα и Cβ находятся в противоположной фазе, т.е. если Cα появляется как положительный пик, то Cβ будет отрицательным, что упрощает идентификацию Cα и Cβ. Дополнительная информация о Cβ из серии экспериментов CBCA (CO) NH / HNCACB упрощает определение типа остатка, чем HN (CO) CA / HNCA, однако HNCACB является менее чувствительным экспериментом и может не подходить для некоторых белков.
Эксперимент CBCANH менее подходит для более крупного белка, поскольку он более подвержен проблеме ширины линии, чем HNCACB.
CBCACO (CA) HA
Этот эксперимент обеспечивает связи между Cα и Cβ с карбонильным углеродом и атомами Hα в одном и том же остатке.[13] Сайдчейн карбоксил группа аспартата и глутамата может проявляться в этом спектре слабо.
CC (CO) NH
Этот эксперимент обеспечивает связь между амидом остатка и алифатическими атомами углерода предыдущего остатка.[14]
H (CCO) NH
Этот эксперимент обеспечивает связь между амидом остатка и атомами водорода, присоединенными к алифатическому атому углерода предыдущего остатка.
HBHA (CO) NH
Этот эксперимент коррелирует амидный резонанс с Hα и Hβ предыдущего остатка.[15]
Последовательное присвоение
Для последовательного назначения обычно используются пары экспериментов, например, пара HNCACB и CBCA (CO) NH или HNCA и HNC (CO) CA. Спектры обычно анализируются как полосы пиков, и полосы из пары экспериментов могут быть представлены вместе рядом или как наложение двух спектров. В спектрах HNCACB обычно присутствуют 4 пика в каждой полосе, Cα и Cβ одного остатка, а также пика его предыдущего остатка. Пики от предыдущего остатка могут быть идентифицированы в эксперименте CBCA (CO) NH. Таким образом, каждая полоса пиков может быть связана со следующей полоской пиков от соседнего остатка, что позволяет последовательно соединять полоски. Тип остатка можно определить по химическому сдвигу пиков, некоторые, например серин, треонин, глицин и аланин, идентифицировать намного легче, чем другие. Затем можно определить резонансы путем сравнения последовательности пиков с аминокислотной последовательностью белка.
Рекомендации
- ^ а б Икура М; Кей ЛЭ; Bax A (1990). "Новый подход к последовательному назначению 1ЧАС, 13C и 15N-спектры белков: трехмерная гетероядерная ЯМР-спектроскопия тройного резонанса. Применение к кальмодулину ». Биохимия. 29 (19): 4659–67. Дои:10.1021 / bi00471a022. PMID 2372549.
- ^ а б c Льюис Э. Кей; Мицухико Икура; Рольф Чудин, Ad Bax (1990). «Трехмерная тройная резонансная ЯМР-спектроскопия белков, обогащенных изотопами». Журнал магнитного резонанса. 89 (3): 496–514. Bibcode:1990JMagR..89..496K. Дои:10.1016/0022-2364(90)90333-5.
- ^ а б Ad Bax (2011). «Трехмерный ЯМР белка с тройным резонансом: до того, как он стал черным ящиком». Журнал магнитного резонанса. 213 (2): 442–5. Bibcode:2011JMagR.213..442B. Дои:10.1016 / j.jmr.2011.08.003. ЧВК 3235243. PMID 21885307.
- ^ а б Юнчао Су; Лорен Андреас и Роберт Гриффин (2015). "ЯМР белков с вращением под магическим углом: высокочастотная динамическая поляризация ядра и обнаружение 1H". Ежегодный обзор биохимии. 84: 485–497. Дои:10.1146 / annurev-biochem-060614-034206. PMID 25839340. - через Annual Reviews (требуется подписка)
- ^ Курт Вютрих (2001). «Путь к ЯМР-структурам белков». Структурная биология природы. 8 (11): 923–925. Дои:10.1038 / nsb1101-923. PMID 11685234. S2CID 26153265.
- ^ Габриэле Варани; Фарид Абул-эла; Фредерик Аллен и Чарльз С. Габсер (1995). "Роман трехмерный 1H−13C−31P эксперименты с тройным резонансом для последовательных корреляций остова нуклеиновых кислот ». Журнал биомолекулярного ЯМР. 5 (3): 315–320. Дои:10.1007 / BF00211759. PMID 7540446. S2CID 31239207.
- ^ Майкл Зальцманн; Герхард Уидер; Константин Первушин; Ханс Сенн и Курт Вултрих (1999). «Эксперименты с тройным резонансом типа TROSY для последовательного определения ЯМР больших белков» (PDF). Журнал Американского химического общества. 121 (4): 844–848. Дои:10.1021 / ja9834226.
- ^ Барбет-Массин; и другие. (2014). «Быстрое определение ЯМР с обнаружением протонов для белков с быстрым вращением под магическим углом». Журнал Американского химического общества. 136 (35): 12489–12497. Дои:10.1021 / ja507382j. ЧВК 4156866. PMID 25102442.
- ^ Роберт Т. Клабб; В. Танабал; Герхард Вагнер (1992). "Трехмерная импульсная схема тройного резонанса с постоянным временем для корреляции внутри остатка 1ЧАСN, 15N и 13C ′ химические сдвиги в 15N /13С-меченые белки ". Журнал магнитного резонанса. 97 (1): 213–217. Bibcode:1992JMagR..97..213C. Дои:10.1016/0022-2364(92)90252-3. HDL:2027.42/30326.
- ^ Ад Бакс и Мицухико Икура (1991). "Эффективный метод 3D ЯМР для корреляции протона и 15Амид N основной цепи резонирует с α-углеродом предыдущего остатка в однородной 15N /13Белки, обогащенные С ». Журнал биомолекулярного ЯМР. 1 (1): 99–104. Дои:10.1007 / BF01874573. PMID 1668719. S2CID 20037190.
- ^ Стефан Гржесик, Ad Bax (1992). «Корреляция резонансов амида основной цепи и боковой цепи в более крупных белках с помощью многократного ретрансляции тройного резонанса ЯМР». Журнал Американского химического общества. 114 (16): 6291–6293. Дои:10.1021 / ja00042a003.
- ^ Стефан Гржезек, Ad Bax (1992). «Эффективный эксперимент по последовательному отнесению к остову белков, обогащенных изотопами среднего размера». Журнал магнитного резонанса. 99 (1): 201–207. Bibcode:1992JMagR..99..201G. Дои:10.1016/0022-2364(92)90169-8.
- ^ Кей, Льюис Э. (1993). "Трехмерный ЯМР-эксперимент с импульсным градиентом поля для корреляции 13Cα / β, 13C 'и 1Химические сдвиги Hα в однородно меченных углеродом-13 белках, растворенных в воде ». Журнал Американского химического общества. 115 (5): 2055–2058. Дои:10.1021 / ja00058a072.
- ^ С. Гжесиек; Дж. Англистер; А. Бакс (1993). «Корреляция резонансов амида основной цепи и алифатических боковых цепей в 13C /15N-обогащенные белки путем изотропного смешивания 13C Намагничивание ». Журнал магнитного резонанса, серия B. 101 (1): 114–119. Bibcode:1993JMRB..101..114G. Дои:10.1006 / jmrb.1993.1019.
- ^ Стефан Гржесик и Эд Бакс (1993). «Определение типа аминокислот в процедуре последовательного назначения равномерно 13C /15N-обогащенные белки ». Журнал биомолекулярного ЯМР. 3 (2): 185–204. Дои:10.1007 / BF00178261. PMID 8477186. S2CID 1324255.