WikiDer > Разобщающий белок
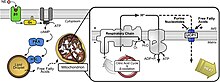
An разобщающий белок (UCP) представляет собой белок внутренней мембраны митохондрий, который является регулируемым протонным каналом или переносчиком. Таким образом, разобщающий белок способен рассеивать протон градиент создано НАДН-силовая перекачка протонов из митохондриального матрикса в митохондриальное межмембранное пространство. Энергия, теряемая при рассеянии протонного градиента через UCP, не используется для биохимической работы. Вместо этого выделяется тепло. Это то, что связывает UCP с термогенезом. Однако не все типы UCP связаны с термогенезом. Хотя UCP2 и UCP3 тесно связаны с UCP1, UCP2 и UCP3 не влияют на терморегуляторные способности позвоночных.[1] UCP расположены на той же мембране, что и АТФ-синтаза, который также является протонным каналом. Таким образом, два белка работают параллельно: один генерирует тепло, а другой генерирует АТФ из АДФ и неорганического фосфата, что является последним этапом в окислительного фосфорилирования.[2] Дыхание митохондрий связано с синтезом АТФ (фосфорилирование АДФ), но регулируется UCP.[3] UCP принадлежат к митохондриальный носитель (SLC25) семейство.
Расщепление белков играет роль в нормальной физиологии, например, при воздействии холода или спячка, потому что энергия используется для выработки тепла (см. термогенез) вместо того, чтобы производить АТФ. Некоторые виды растений используют тепло, выделяемое при расщеплении белков, для специальных целей. Восточная скунсовая капуста, например, поддерживает температуру своих шипов на 20 ° C выше, чем температура окружающей среды, распространяя запах и привлекая насекомых, удобряющих цветы.[4] Однако другие вещества, такие как 2,4-динитрофенол и карбонилцианид м-хлорфенилгидразон, также выполняют ту же функцию разъединения. Салициловая кислота также является разобщающим агентом (главным образом в растениях) и снижает выработку АТФ и повышает температуру тела, если принимать его в чрезмерном избытке.[5] Расщепляющие белки увеличиваются гормон щитовидной железы, норэпинефрин, адреналин, и лептин.[6]
История
Ученые наблюдали термогенную активность в коричневая жировая ткань, что в конечном итоге привело к открытию UCP1, первоначально известного как «Uncoupling Protein».[3] Коричневая ткань показала повышенные уровни дыхания митохондрий и другого дыхания, не связанного с синтезом АТФ, что символизировало сильную термогенную активность.[3] UCP1 был обнаруженным белком, ответственным за активацию протонного пути, который не был связан с фосфорилированием АДФ (обычно осуществляется через АТФ-синтаза).[3]
У млекопитающих
У млекопитающих известно пять гомологов UCP. Хотя каждый из них выполняет уникальные функции, определенные функции выполняются несколькими гомологами. Гомологи следующие:
- UCP1, также известный как термогенин или SLC25A7
- UCP2, также известный как SLC25A8
- UCP3, также известный как SLC25A9
- UCP4, также известный как SLC25A27
- UCP5, также известный как SLC25A14
Поддержание температуры тела
Первый обнаруженный разобщающий белок, UCP1, был обнаружен в коричневая жировая ткань из спящие и мелких грызунов, которые обеспечивают этим животным не дрожащее тепло.[3] Эти коричневые жировые ткани необходимы для поддержания температуры тела мелких грызунов, и исследования с (UCP1) -нокаутные мыши показывают, что эти ткани не функционируют правильно без функционирования разобщающих белков.[3] Фактически, эти исследования показали, что холодовая акклиматизация невозможна для этих мышей с нокаутом, что указывает на то, что UCP1 является важным фактором производства тепла в этих коричневых жировых тканях.[7][8]
Известно, что в других частях тела разобщающая активность белков влияет на температуру в микросредах.[9][10] Считается, что это влияет на активность других белков в этих областях, хотя все еще требуется работа, чтобы определить истинные последствия градиентов температуры, вызванных разобщением внутри клеток.[9]
Роль в концентрациях АТФ
Влияние UCP2 и UCP3 на концентрацию АТФ варьируется в зависимости от типа клеток.[9] Например, бета-клетки поджелудочной железы испытывать уменьшение АТФ концентрация с повышенной активностью UCP2.[9] Это связано с дегенерацией клеток, уменьшением инсулин секреция и диабет II типа.[9][11] И наоборот, UCP2 в гиппокамп клетки и UCP3 в мышечных клетках стимулируют выработку митохондрии.[9][12] Большее количество митохондрий увеличивает общую концентрацию ADP и АТФ, что фактически приводит к чистому увеличению концентрации АТФ, когда эти разобщающие белки становятся связанными (то есть механизм, позволяющий протекать протонам, ингибируется).[9][12]
Поддержание концентрации активных форм кислорода
Полный перечень функций UCP2 и UCP3 неизвестен.[13] Однако исследования показывают, что эти белки участвуют в петля отрицательной обратной связи ограничение концентрации активные формы кислорода (ROS).[14] Текущий научный консенсус утверждает, что UCP2 и UCP3 осуществляют перенос протонов только тогда, когда активация виды присутствуют.[15] Среди этих активаторов - жирные кислоты, АФК и некоторые побочные продукты АФК, которые также являются реактивными.[14][15] Следовательно, более высокие уровни ROS прямо или косвенно вызывают повышение активности UCP2 и UCP3.[14] Это, в свою очередь, увеличивает утечку протонов из митохондрий, снижая протонодвижущую силу через митохондриальные мембраны, активируя цепь переноса электронов.[13][14][15] Ограничение движущей силы протона посредством этого процесса приводит к отрицательной обратной связи, которая ограничивает производство АФК.[14] В частности, UCP2 снижает трансмембранный потенциал митохондрий, тем самым уменьшая продукцию ROS. Таким образом, раковые клетки могут увеличивать продукцию UCP2 в митохондриях.[16] Эта теория подтверждается независимыми исследованиями, которые показывают повышенную продукцию ROS у мышей с нокаутом UCP2 и UCP3.[15]
Этот процесс важен для здоровья человека, поскольку считается, что высокие концентрации АФК участвуют в развитии дегенеративных заболеваний.[15]
Функции нейронов
Обнаружив связанный мРНК, UCP2, UCP4 и UCP5, как было показано, располагаются в нейронах центральной нервной системы человека.[17] Эти белки играют ключевую роль в функции нейронов.[9] Хотя результаты многих исследований остаются противоречивыми, некоторые из них получили широкое признание.[9]
Например, UCP изменяют концентрацию свободного кальция в нейроне.[9] Митохондрии являются основным местом хранения кальция в нейронах, и емкость накопления увеличивается с потенциалом через митохондриальные мембраны.[9][18] Следовательно, когда разобщающие белки снижают потенциал через эти мембраны, ионы кальция высвобождаются в окружающую среду нейрона.[9] Из-за высокой концентрации митохондрий вблизи терминалы аксонов, это означает, что UCP играют роль в регулировании концентрации кальция в этой области.[9] Учитывая, что ионы кальция играют большую роль в нейротрансмиссии, ученые предсказывают, что эти UCP напрямую влияют на нейротрансмиссию.[9]
Как обсуждалось выше, нейроны в гиппокампе испытывают повышенные концентрации АТФ в присутствии этих разобщающих белков.[9][12] Это заставляет ученых предположить, что UCP улучшают синаптическую пластичность и передачу.[9]
Рекомендации
- ^ Gaudry MJ, Jastroch M (март 2019). «Молекулярная эволюция разобщающих белков и последствия для функции мозга». Письма о неврологии. 696: 140–145. Дои:10.1016 / j.neulet.2018.12.027. PMID 30582970.
- ^ Nedergaard J, Ricquier D, Kozak LP (октябрь 2005 г.). «Разобщение белков: современное состояние и терапевтические перспективы». EMBO отчеты. 6 (10): 917–21. Дои:10.1038 / sj.embor.7400532. ЧВК 1369193. PMID 16179945.
- ^ а б c d е ж Rousset S, Alves-Guerra MC, Mozo J, Miroux B, Cassard-Doulcier AM, Bouillaud F, Ricquier D (февраль 2004 г.). «Биология митохондриальных разобщающих белков». Сахарный диабет. 53 (приложение 1): S130-5. Дои:10.2337 / диабет.53.2007.S130. PMID 14749278.
- ^ Гарретт Р.Х., Гришем К.М. (2013). Биохимия (Пятое издание, международное издание). Китай: Мэри Финч. п. 668. ISBN 978-1-133-10879-5.
- ^ «Калифорнийская система борьбы с отравлениями: салицилаты». Архивировано из оригинал на 2014-08-02.
- ^ Гонг Д.В., Хе И, Карас М., Рейтман М. (сентябрь 1997 г.). «Разобщающий белок-3 является медиатором термогенеза, регулируемого тироидным гормоном, бета3-адренергическими агонистами и лептином».. Журнал биологической химии. 272 (39): 24129–32. Дои:10.1074 / jbc.272.39.24129. PMID 9305858.
- ^ Хаген Т., Видаль-Пуч А. (февраль 2002 г.). «Митохондриальные разобщающие белки в физиологии и болезни человека». Минерва Медика. 93 (1): 41–57. PMID 11850613.
- ^ Feldmann HM, Golozoubova V, Cannon B, Nedergaard J (февраль 2009 г.). «Абляция UCP1 вызывает ожирение и устраняет термогенез, вызванный диетой, у мышей, освобожденных от теплового стресса за счет термонейтральности». Клеточный метаболизм. 9 (2): 203–9. Дои:10.1016 / j.cmet.2008.12.014. PMID 19187776.
- ^ а б c d е ж грамм час я j k л м п о п Эндрюс З. Б., Диано С., Хорват Т. Л. (ноябрь 2005 г.). «Митохондриальные разобщающие белки в ЦНС: в поддержку функции и выживания». Обзоры природы. Неврология. 6 (11): 829–40. Дои:10.1038 / №1767. PMID 16224498.
- ^ Хорват Т.Л., надзиратель С.Х., Хаджос М., Ломбарди А., Гоглиа Ф., Диано С. (декабрь 1999 г.). «Разобщающий белок 2 мозга: несвязанные митохондрии нейронов предсказывают тепловые синапсы в гомеостатических центрах». Журнал неврологии. 19 (23): 10417–27. PMID 10575039.
- ^ Zhang CY, Baffy G, Perret P, Krauss S, Peroni O, Grujic D, et al. (Июнь 2001 г.). «Несвязанный белок-2 отрицательно регулирует секрецию инсулина и является основным звеном между ожирением, дисфункцией бета-клеток и диабетом 2 типа». Клетка. 105 (6): 745–55. Дои:10.1016 / s0092-8674 (01) 00378-6. PMID 11440717.
- ^ а б c Диано С., Мэтьюз Р. Т., Патрило П., Ян Л., Бил М. Ф., Барнстейбл С. Дж., Хорват Т. Л. (ноябрь 2003 г.). «Разобщающий белок 2 предотвращает гибель нейронов, в том числе происходящую во время припадков: механизм предварительного кондиционирования». Эндокринология. 144 (11): 5014–21. Дои:10.1210 / en.2003-0667. PMID 12960023.
- ^ а б Ястроч М., Дивакаруни А.С., Мукерджи С., Треберг-младший, бренд-MD (14.06.2010). «Митохондриальные протоны и утечки электронов». Очерки биохимии. 47: 53–67. Дои:10.1042 / bse0470053. ЧВК 3122475. PMID 20533900.
- ^ а б c d е Mailloux RJ, Harper ME (сентябрь 2011 г.). «Разобщение белков и контроль митохондриальной продукции активных форм кислорода». Свободная радикальная биология и медицина. 51 (6): 1106–15. Дои:10.1016 / j.freeradbiomed.2011.06.022. PMID 21762777.
- ^ а б c d е Бренд MD, Esteves TC (август 2005 г.). «Физиологические функции митохондриальных разобщающих белков UCP2 и UCP3». Клеточный метаболизм. 2 (2): 85–93. Дои:10.1016 / j.cmet.2005.06.002. PMID 16098826.
- ^ Сридхар А., Чжао Ю. (май 2017 г.). «Разъединение белка 2 и метаболические заболевания». Митохондрия. 34: 135–140. Дои:10.1016 / j.mito.2017.03.005. ЧВК 5477468. PMID 28351676.
- ^ Ричард Д., Клавель С., Хуанг К., Санчис Д., Рикье Д. (ноябрь 2001 г.). «Разобщающий белок 2 в головном мозге: распределение и функции». Сделки Биохимического Общества. 29 (Пт 6): 812–7. Дои:10.1042 / bst0290812. PMID 11709080.
- ^ Николс Д.Г., Ward MW (апрель 2000 г.). «Митохондриальный мембранный потенциал и нейрональная эксайтотоксичность глутамата: смертность и милливольты». Тенденции в неврологии. 23 (4): 166–74. Дои:10.1016 / s0166-2236 (99) 01534-9. PMID 10717676.