WikiDer > Креатинкиназа - Википедия
| Креатинкиназа | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 2.7.3.2 | ||||||||
| Количество CAS | 9001-15-4 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
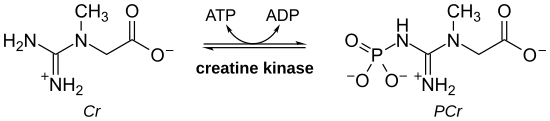
Креатинкиназа (СК), также известный как креатинфосфокиназа (CPK) или же фосфокреатинкиназа, является фермент (EC 2.7.3.2) экспрессируется различными тканями и типами клеток. СК катализирует превращение креатин и использует аденозинтрифосфат (ATP) для создания фосфокреатин (PCr) и аденозиндифосфат (ADP). Эта ферментативная реакция CK обратима, и поэтому АТФ может генерироваться из PCr и ADP.
В тканях и клетках, которые быстро потребляют АТФ, особенно скелетные мышцы, но и мозг, фоторецепторные клетки из сетчатка, волосковые клетки из внутреннее ухо, сперматозоиды и гладкая мышца, PCr служит резервуаром энергии для быстрой буферизации и регенерации АТФ. на месте, а также для внутриклеточного транспорта энергии с помощью шаттла или цепи PCr.[2] Таким образом, креатин киназа является важным ферментом в таких тканях.[3]
Клинически креатинкиназа определяется в анализах крови как маркер повреждения ткани, богатой CK, например, в инфаркт миокарда (острое сердечно-сосудистое заболевание), рабдомиолиз (сильное разрушение мышц), мышечная дистрофия, аутоиммунный миозитиды, и острая травма почек.[4]
Типы
В клетках «цитозольные» ферменты ЦК состоят из двух субъединиц, которые могут быть либо B (тип мозга) или M (тип мышц). Таким образом, существует три разных изоферменты: CK-MM, CK-BB и CK-MB. Гены этих субъединиц расположены на разных хромосомы: B на 14q32 и M на 19q13. В дополнение к этим трем цитозольный Изоформ СК, существует две митохондриальный изоферменты креатинкиназы, повсеместно и саркомерный форма. Функциональная единица последних двух изоформ ЦК митохондрий представляет собой октамер, состоящий из четырех димеров каждый.[5]
В то время как митохондриальная креатинкиназа непосредственно участвует в образовании фосфо-креатина из митохондриального АТФ, цитозольные ЦК регенерируют АТФ из АДФ с помощью PCr. Это происходит во внутриклеточных сайтах, где АТФ используется в клетке, причем ЦК действует как на местеРегенератор АТФ.
| ген | белок |
|---|---|
| CKB | креатинкиназа, мозг, BB-CK |
| CKBE | креатинкиназа, эктопическая экспрессия |
| CKM | креатинкиназа, мышца, MM-CK |
| CKMT1A, CKMT1B | креатинкиназа митохондриальная 1; повсеместный mtCK; или же тыmtCK |
| CKMT2 | креатинкиназа митохондриальная 2; саркомерный mtCK; или же smtCK |
Структура изоферментов различается в тканях. Скелетные мышцы экспрессируют CK-MM (98%) и низкие уровни CK-MB (1%). В миокард (сердечная мышца), напротив, экспрессирует CK-MM на 70% и CK-MB на 25-30%. CK-BB преимущественно экспрессируется в головном мозге и гладких мышцах, включая ткани сосудов и матки.
Атомная структура
Первой атомной структурой собственно креатинкиназы, решенной с помощью рентгеновской кристаллографии белков, была структура октамерного, саркомерного митохондриального мышечного типа CK (s-mtCK) в 1996 году. [6], а затем структура повсеместных митохондриальных CK (u-mtCK) в 2000 году.[7] Обе изоформы mt-CK образуют октамерные структуры (построенные из 4-х банановидных димеров) с четырехкратной симметрией и центральным каналом.[8][9][10]Атомная структура димерного цитозольного мозга BB-CK в форме банана была решена в 1999 году с разрешением 1,4Å.[11] Цитозольные BB-CK, а также MM-CK мышечного типа образуют симметричные димеры банановой формы с одним каталитическим активным центром в каждой субъединице.[12]
Функции
В митохондриальный креатинкиназа (CKм) присутствует в митохондриальном межмембранном пространстве, где регенерирует фосфокреатин (PCr) из митохондриально генерируемого АТФ и креатин (Cr) импортировано из цитозоль. Помимо двух форм митохондриальных изоферментов CK, то есть повсеместного mtCK (присутствующего в немышечных тканях) и саркомерного mtCK (присутствующего в саркомерной мышце), в цитозоле присутствуют три цитозольные изоформы CK, в зависимости от ткани. В то время как MM-CK экспрессируется в саркомерной мышце, то есть в скелетных и сердечных мышцах, MB-CK экспрессируется в сердечной мышце, а BB-CK экспрессируется в гладких мышцах и в большинстве немышечных тканей. Митохондриальные mtCK и цитозольные CK связаны в так называемый PCr / Cr-челнок или цепь. PCr, генерируемый mtCK в митохондриях, перемещается в цитозольные CK, которые связаны с АТФ-зависимыми процессами, например АТФазы, такие как актомиозиновая АТФаза и кальциевая АТФаза, участвующие в сокращении мышц, и АТФаза натрия / калия, участвующие в задержке натрия в почках. Связанный цитозольный CK принимает PCr, перемещающийся через клетку, и использует ADP для регенерации ATP, который затем может использоваться в качестве источника энергии для ATPases (CK тесно связан с ATPases, образуя функционально связанный микрокомпартмент). PCr является не только энергетическим буфером, но и формой клеточного транспорта энергии между субклеточными участками производства энергии (АТФ) (митохондрии и гликолиз) и участками утилизации энергии (АТФазы).[2]Таким образом, CK усиливает сократительную способность скелета, сердца и гладких мышц и участвует в генерации артериальное давление.[13] Кроме того, действие креатинкиназы по улавливанию АДФ подразумевается в кровотечение; Люди с сильно повышенным уровнем КК в плазме могут быть предрасположены к сильному кровотечению.[14]
Лабораторные испытания
| Креатинкиназа сыворотки | |
|---|---|
| Контрольный диапазон | 60 и 400 МЕ / л |
| Цель | Обнаружение повреждение мышц.[15] |
| Испытание | Количество креатинкиназы в крови.[15] |
КК часто обычно определяют в медицинская лаборатория. Раньше его определяли именно у пациентов с грудная боль но этот тест был заменен на тропонин. Нормальные значения в состоянии покоя обычно составляют от 60 до 400 МЕ /L,[16] где одна единица ферментная активность, более конкретно количество фермента, которое будет катализировать 1 мкмоль субстрата в минуту при определенных условиях (температура, pH, концентрации субстрата и активаторы.[17]) Этот тест не предназначен для тип CK, который повышен.
Креатинкиназа в крови может быть высокой при здоровье и болезни. Физические упражнения увеличивают отток креатинкиназы в кровоток на срок до недели, и это наиболее частая причина высокого уровня КФК в крови.[18] Кроме того, высокий уровень CK в крови может быть связан с высоким внутриклеточным CK, например, у лиц африканского происхождения.[19]
Наконец, высокое содержание CK в крови может указывать на повреждение богатой CK ткани, например, в рабдомиолиз, инфаркт миокарда, миозит и миокардит. Это означает, что уровень креатинкиназы в крови может быть повышен в широком диапазоне клинических состояний, включая использование таких лекарств, как статины; эндокринные расстройства, такие как гипотиреоз;[20] и заболевания и расстройства скелетных мышц, включая злокачественная гипертермия,[21] и злокачественный нейролептический синдром.[22]
Кроме того, определение изофермента широко используется в качестве показания для повреждения миокарда при сердечных приступах. Тропонин Измерение в значительной степени заменило это во многих больницах, хотя некоторые центры все еще полагаются на CK-MB.

Смотрите также
Рекомендации
- ^ Бонг С.М., Мун Дж. Х., Нам К. Х., Ли К. С., Чи Ю. М., Хван К. Ю. (ноябрь 2008 г.). «Структурные исследования креатинкиназы человеческого мозга в комплексе с комплексом аналога переходного состояния АДФ-Mg2 + -NO3- -креатин». Письма FEBS. 582 (28): 3959–65. Дои:10.1016 / j.febslet.2008.10.039. PMID 18977227.
- ^ а б Валлиманн Т., Висс М., Брдичка Д., Николай К., Эппенбергер Х.М. (январь 1992 г.). «Внутриклеточная компартментация, структура и функция изоферментов креатинкиназы в тканях с высокими и колеблющимися потребностями в энергии:« фосфокреатиновый контур »для гомеостаза клеточной энергии». Биохимический журнал. 281 (Pt 1) (1): 21–40. Дои:10.1042 / bj2810021. ЧВК 1130636. PMID 1731757.
- ^ Валлиманн Т., Хеммер В. (1994). «Креатинкиназа в немышечных тканях и клетках». Молекулярная и клеточная биохимия. 133-134 (1): 193–220. Дои:10.1007 / BF01267955. eISSN 1573-4919. PMID 7808454.
- ^ Moghadam-Kia S, Oddis CV, Aggarwal R (январь 2016 г.). «Подход к бессимптомному повышению креатинкиназы». Кливлендский медицинский журнал клиники. 83 (1): 37–42. Дои:10.3949 / ccjm.83a.14120. ЧВК 4871266. PMID 26760521.
- ^ Шлаттнер У., Токарска-Шлаттнер М, Валлиманн Т. (февраль 2006 г.). «Митохондриальная креатинкиназа в здоровье и болезни человека». Biochimica et Biophysica Acta (BBA) - Молекулярная основа болезни. 1762 (2): 164–80. Дои:10.1016 / j.bbadis.2005.09.004. PMID 16236486.
- ^ Fritz-Wolf et al. 1996 г. http://publicationslist.org/data/theo.wallimann/ref-135/Fritz-Wolf-sMtCK%20structure.pdf
- ^ Eder et al. 2000 г. http://publicationslist.org/data/theo.wallimann/ref-101/Eder-X-ray.uMtCK.pdf
- ^ Schnyder et al. 1990 г. http://publicationslist.org/data/theo.wallimann/ref-184/Schnyder%201990%20Crystallization%20and%20preterior%20X-ray%20of%20MtCk%20J%20Mol%20Biol.pdf
- ^ Schnyder et al. 1991 г. http://publicationslist.org/data/theo.wallimann/ref-180/SchnyderT_Gross-MtCK-crystal-EMs.pdf
- ^ Eder et al. 2000 г. http://publicationslist.org/data/theo.wallimann/ref-101/Eder-X-ray.uMtCK.pdf
- ^ Эдер, Майкл; Шлаттнер, Уве; Валлиманн, Тео; Беккер, Андреас; Кабш, Вольфганг; Фриц-Вольф, Карин (31 декабря 2008 г.). «Кристаллическая структура креатинкиназы мозгового типа с разрешением 1,41 Å». Белковая наука. Вайли. 8 (11): 2258–2269. Дои:10.1110 / пс. 8.11.2258. ISSN 0961-8368. ЧВК 2144193. PMID 10595529.
- ^ Hornemann et al. 2000 г. http://publicationslist.org/data/theo.wallimann/ref-96/Hornmann-CK-dimer.pdf
- ^ Брюстер Л.М., Майруху Г., Биндрабан Н.Р., Купманс Р.П., Кларк Дж.Ф., ван Монфранс Г.А. (ноябрь 2006 г.). «Активность креатинкиназы связана с кровяным давлением». Тираж. 114 (19): 2034–9. Дои:10.1161 / CIRCULATIONAHA.105.584490. PMID 17075013.
- ^ Брюстер Л.М. (июнь 2020 г.). «Креатин внеклеточная креатинкиназа может модулировать пуринергическую передачу сигналов». Пуринергическая передача сигналов. Дои:10.1007 / s11302-020-09707-0. PMID 32572751.
- ^ а б «Креатинкиназа (СК)». labtestsonline.org. Получено 2019-12-24.
- ^ Армстронг А.В., Голан Д.Е. (2008). «Фармакология гемостаза и тромбозов». In Golan DE, Tashjian AH, Armstrong EJ, Armstrong AW (ред.). Принципы фармакологии: патофизиологические основы лекарственной терапии. Филадельфия: Липпинкотт Уильямс и Уилкинс. п. 388. ISBN 978-0-7817-8355-2. OCLC 76262148.
- ^ Епископ ML, Fody EP, Schoeff LE, ред. (2004). Клиническая химия: принципы, процедуры, соотношения. Филадельфия: Липпинкотт Уильямс и Уилкинс. п. 243. ISBN 978-0-7817-4611-3. OCLC 56446391.
- ^ Йонсен С.Х., Лилленг Х., Вильсгаард Т., Беккелунд С.И. (январь 2011 г.). «Активность креатинкиназы и артериальное давление в нормальной популяции: исследование Тромсё». Журнал гипертонии. 29 (1): 36–42. Дои:10.1097 / HJH.0b013e32834068e0. PMID 21063205.
- ^ Брюстер Л. М., Коронель С. М., Слюитер В., Кларк Дж. Ф., ван Монфранс, Джорджия (16 марта 2012 г.). Сакс В (ред.). «Этнические различия в активности тканевой креатинкиназы: обсервационное исследование». PLOS ONE. 7 (3): e32471. Bibcode:2012PLoSO ... 732471B. Дои:10.1371 / journal.pone.0032471. ЧВК 3306319. PMID 22438879.
- ^ Хекимсой З., Октем И.К. (2005). «Уровни креатинкиназы в сыворотке при явном и субклиническом гипотиреозе». Эндокринные исследования. 31 (3): 171–5. Дои:10.1080/07435800500371706. PMID 16392619.
- ^ Johannsen S, Berberich C, Metterlein T, Roth C, Reiners K, Roewer N, Schuster F (май 2013 г.). «Скрининговый тест на злокачественную гипертермию у пациентов со стойкой гиперэкемией: пилотное исследование». Мышцы и нервы. 47 (5): 677–81. Дои:10.1002 / mus.23633. PMID 23400941.
- ^ О'Дуайер AM, Шеппард Н.П. (май 1993 г.). «Роль креатинкиназы в диагностике злокачественного нейролептического синдрома». Психологическая медицина. 23 (2): 323–6. Дои:10,1017 / с0033291700028415. PMID 8101383.
внешняя ссылка
- Просто указано на mdausa.org
- Креатин + киназа в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Тест на изоферменты КФК Энциклопедия MedlinePlus: 003504
- СК в Лабораторные тесты онлайн