WikiDer > Cas9
| CRISPR-ассоциированная эндонуклеаза Cas9 | |||||||
|---|---|---|---|---|---|---|---|
 Кристаллическая структура S pyogenes Cas9 в комплексе с sgRNA и его целевой ДНК с разрешением 2,5.[1] | |||||||
| Идентификаторы | |||||||
| Организм | |||||||
| Символ | cas9 | ||||||
| Альт. символы | SpCas9 | ||||||
| Entrez | 901176 | ||||||
| PDB | 4OO8 | ||||||
| RefSeq (мРНК) | NC_002737.2 | ||||||
| RefSeq (Prot) | NP_269215.1 | ||||||
| UniProt | Q99ZW2 | ||||||
| Прочие данные | |||||||
| Номер ЕС | 3.1.-.- | ||||||
| Хромосома | Геномный: 0,85 - 0,86 МБ | ||||||
| |||||||
Cas9 (CРИСПР в качествесвязанный белок 9, ранее назывался Cas5, Csn1 или Csx12) - это 160 килодальтон белок который играет жизненно важную роль в иммунологической защите некоторых бактерий от ДНК-вирусы и плазмиды, и широко используется в приложениях генной инженерии. Его основная функция - разрезать ДНК и тем самым изменить геном клетки. Методика редактирования генома CRISPR-Cas9 внесла значительный вклад в Нобелевская премия по химии в 2020 году награжден Эммануэль Шарпантье и Дженнифер Дудна.[2]
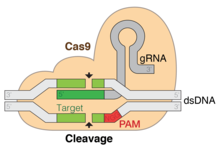
Технически Cas9 - это двойная РНК-управляемый ДНК эндонуклеаза фермент связанные с кластерными регулярными короткими палиндромными повторами (CRISPR) адаптивной иммунной системы в Streptococcus pyogenes.[3][4] S. pyogenes использует CRISPR для запоминания и Cas9 для последующего опроса и расщепления чужеродной ДНК, например вторжения бактериофаг ДНК или плазмидная ДНК.[4][5][6][7] Cas9 выполняет этот опрос, раскручивая чужеродную ДНК и проверяя сайты, комплементарные спейсерной области из 20 пар оснований. направляющая РНК. Если ДНК-субстрат комплементарен направляющей РНК, Cas9 расщепляет вторгающуюся ДНК. В этом смысле механизм CRISPR-Cas9 имеет ряд параллелей с механизмом РНК-интерференция (РНКи) механизм у эукариот.
Помимо своей первоначальной функции в бактериальном иммунитете, белок Cas9 широко используется в качестве инструмента геномной инженерии для индукции сайт-направленных двухцепочечных разрывов ДНК. Эти разрывы могут приводить к инактивации генов или внедрению гетерологичных генов через негомологичное соединение концов и гомологичная рекомбинация соответственно во многих лабораторных модельных организмах. Наряду с нуклеазы цинковых пальцев и Эффекторная нуклеаза, подобная активатору транскрипции (Talen), Cas9 становится важным инструментом в области редактирования генома.
Cas9 приобрел популярность в последние годы, поскольку он может расщеплять практически любую последовательность, комплементарную направляющей РНК.[4] Поскольку целевая специфичность Cas9 проистекает из направляющей РНК: комплементарности ДНК, а не модификаций самого белка (таких как TALEN и цинковые пальцы), создание Cas9 для нацеливания на новую ДНК несложно.[8] Версии Cas9, которые связывают, но не расщепляют родственную ДНК, можно использовать для определения места транскрипции. активатор или же репрессоры к конкретным последовательностям ДНК, чтобы контролировать активацию и репрессию транскрипции.[9][10] Для нативного Cas9 требуется направляющая РНК, состоящая из двух разрозненных РНК, которые связываются - РНК CRISPR (crRNA) и трансактивирующей crRNA (tracrRNA).[3] Нацеливание на Cas9 было упрощено за счет создания химерной одиночной направляющей РНК (chiRNA). Ученые предположили, что на основе Cas9 генные диски может редактировать геномы целых популяций организмов.[11] В 2015 году Cas9 впервые использовали для модификации генома человеческих эмбрионов.[12]
CRISPR-опосредованный иммунитет
Чтобы выжить во множестве сложных, негостеприимных мест обитания, наполненных бактериофаги, бактерии и археи разработали методы, чтобы уклоняться от хищных вирусы. Сюда входит система адаптивного иммунитета CRISPR. На практике системы CRISPR / Cas действуют как самопрограммируемые рестрикционные ферменты. Локусы CRISPR состоят из коротких палиндромных повторов, которые встречаются через равные промежутки времени, и состоят из альтернативных повторов CRISPR и переменных спейсеров CRISPR длиной от 24 до 48 нуклеотидов. Эти локусы CRISPR обычно сопровождаются соседними генами, связанными с CRISPR (cas). В 2005 году три отдельные группы обнаружили, что спейсерные области гомологичны чужеродным элементам ДНК, включая плазмиды и вирусы. Эти отчеты предоставили первое биологическое свидетельство того, что CRISPR могут функционировать как иммунная система.
Cas9 часто использовался как инструмент редактирования генома. Cas9 был использован в недавних разработках для предотвращения манипулирования вирусами ДНК хозяев. Поскольку CRISPR-Cas9 был разработан на основе систем бактериального генома, его можно использовать для нацеливания на генетический материал вирусов. Использование фермента Cas9 может стать решением многих вирусных инфекций. Cas9 обладает способностью нацеливаться на определенные вирусы путем нацеливания на определенные цепи вирусной генетической информации. Более конкретно, фермент Cas9 нацелен на определенные участки вирусного генома, что мешает вирусу выполнять свои нормальные функции.[13] Cas9 также использовался для разрушения вредных цепей ДНК и РНК, которые вызывают заболевания и мутировавшие цепи ДНК. Cas9 уже показал многообещающие результаты в подавлении эффектов ВИЧ-1. Было показано, что Cas9 подавляет экспрессию длинных концевых повторов в ВИЧ-1. При введении в геном ВИЧ-1 Cas9 показал способность мутировать цепи ВИЧ-1.[14][15] Cas9 также использовался при лечении гепатита В путем нацеливания на концы некоторых из длинных концевых повторов в геноме вируса гепатита В.[16] Cas9 был использован для исправления мутаций, вызывающих катаракту у мышей.
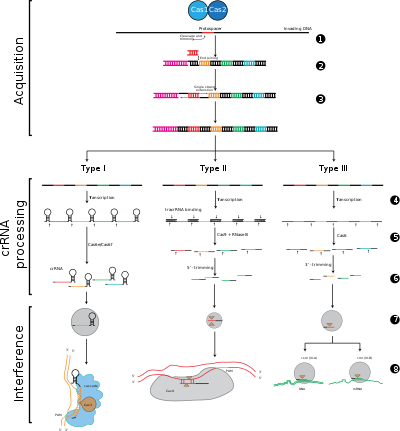
Системы CRISPR-Cas делятся на три основных типа (тип I, тип II и тип III) и двенадцать подтипов, в зависимости от их генетического содержания и структурных различий. Однако основными определяющими характеристиками всех систем CRISPR-Cas являются гены cas и их белки: cas1 и cas2 универсальны для разных типов и подтипов, тогда как cas3, cas9 и cas10 являются генами-сигнатурами для типа I, типа II и типа III соответственно.
Этапы защиты CRISPR-Cas
Приспособление
Приспособление вовлекает распознавание и интеграцию спейсеров между двумя соседними повторами в локусе CRISPR. «Протоспейсер» относится к последовательности вирусного генома, которая соответствует спейсеру. Короткий участок консервативных нуклеотидов существует проксимальнее протоспейсера, который называется мотивом, прилегающим к протоспейсеру (PAM). PAM - это мотив узнавания, который используется для получения фрагмента ДНК.[7] При типе II Cas9 распознает PAM во время адаптации, чтобы гарантировать получение функциональных спейсеров.[5]
Обработка CRISPR / биогенез
Выражение CRISPR включает транскрипция первичного транскрипта, называемого CRISPR РНК (пре-crRNA), который транскрибируется из локуса CRISPR с помощью РНК-полимеразы. Специфический эндорибонуклеазы затем расщепить пре-crRNA на малые CRISPR-РНК (crRNA).[17]
Помехи / невосприимчивость
Интерференция вовлекает crRNA в мультибелковом комплексе под названием CASCADE, который может распознавать и специфически соединять пары оснований с участками вставки комплементарной чужеродной ДНК. Комплекс crRNA-чужеродная нуклеиновая кислота затем расщепляется, однако, если есть несоответствия между спейсером и целевой ДНК или если есть мутации в PAM, то расщепление не начнется. В последнем случае чужеродная ДНК не является мишенью для атаки клетки, поэтому репликация вируса продолжается, и хозяин не застрахован от вирусной инфекции. Этап вмешательства может механически и временно отличаться от приобретения и выражения CRISPR, однако для полноценного функционирования в качестве защитной системы все три этапа должны быть функциональными.[18]
Этап 1: интеграция спейсера CRISPR. Протоспейсеры и связанные с протоспейсерами мотивы (показаны красным) приобретаются на «ведущем» конце массива CRISPR в ДНК хозяина. Массив CRISPR состоит из последовательностей спейсеров (показаны в цветных прямоугольниках), окруженных повторами (черные ромбы). Этот процесс требует Cas1 и Cas2 (и Cas9 в типе II[5]), которые закодированы в cas locus, которые обычно расположены рядом с массивом CRISPR.
Этап 2: выражение CRISPR. Пре-crРНК транскрибируется, начиная с лидерной области, с помощью РНК-полимеразы хозяина, а затем расщепляется белками Cas на меньшие crRNA, содержащие один спейсер и частичный повтор (показаны в виде шпилечной структуры с окрашенными спейсерами).
Этап 3: вмешательство CRISPR. crRNA со спейсером, который имеет сильную комплементарность с входящей чужеродной ДНК, начинает событие расщепления (изображено ножницами), для которого требуются белки Cas. Расщепление ДНК препятствует репликации вируса и обеспечивает иммунитет хозяину. Этап интерференции может функционально и временно отличаться от получения и выражения CRISPR (обозначен белой линией, разделяющей ячейку).
Деактивация транскрипции с помощью dCas9
dCas9, также называемый дефицитным по эндонуклеазе Cas9, может быть использован для редактирования экспрессии гена при применении к сайту связывания транскрипции желаемой части гена. Оптимальная функция dCas9 объясняется его принципом действия. Экспрессия генов подавляется, когда нуклеотиды больше не добавляются к цепи РНК и, следовательно, прекращают удлинение этой цепи, и в результате влияет на процесс транскрипции. Этот процесс происходит, когда dCas9 производится массово, поэтому он может воздействовать на большинство генов в любой момент времени через специфичную для последовательности молекулу направляющей РНК. Поскольку dCas9, по-видимому, подавляет экспрессию генов, это действие усиливается еще больше, когда он используется в сочетании с репрессивными доменами модификатора хроматина.[19] Белок dCas9 выполняет другие функции, помимо регуляции экспрессии генов. К белку dCas9 может быть добавлен промотор, который позволяет им работать друг с другом, чтобы стать эффективными при запуске или остановке транскрипции в различных последовательностях вдоль цепи ДНК. Эти два белка специфичны в том, где они действуют на ген. Это преобладает у определенных типов прокариот, когда промотор и dCas9 выравниваются вместе, чтобы препятствовать удлинению полимера нуклеотидов, соединяющихся вместе, с образованием транскрибируемого фрагмента ДНК. Без промотора белок dCas9 не имеет такого же эффекта сам по себе или с телом гена.[20]
При дальнейшем изучении эффектов репрессии транскрипции, H3K27, аминокислотный компонент гистона, становится метилированным в результате взаимодействия dCas9 и пептида, называемого FOG1. По сути, это взаимодействие вызывает репрессию гена на C + N-концевом участке аминокислотного комплекса в определенном месте соединения гена и, как следствие, прекращает транскрипцию.[21]
dCas9 также оказался эффективным, когда дело доходит до изменения определенных белков, которые могут вызывать заболевания. Когда dCas9 присоединяется к форме РНК, называемой направляющей РНК, он предотвращает распространение повторяющихся кодонов и последовательностей ДНК, которые могут быть вредными для генома организма. По сути, когда продуцируются множественные повторяющиеся кодоны, это вызывает ответ или привлекает большое количество dCas9 для борьбы с избыточной продукцией этих кодонов и приводит к остановке транскрипции. dCas9 работает синергетически с гРНК и напрямую влияет на ДНК-полимеразу II, продолжая транскрипцию.
Дальнейшее объяснение того, как работает белок dCas9, можно найти в их использовании геномов растений путем регулирования выработки генов в растениях для увеличения или уменьшения определенных характеристик. Система CRISPR-CAS9 может либо активировать, либо подавлять гены. Белки dCas9 являются компонентом системы CRISPR-CAS9, и эти белки могут репрессировать определенные области гена растения. Это происходит, когда dCAS9 связывается с репрессорными доменами, а в случае растений действительно происходит дезактивация регуляторного гена, такого как AtCSTF64.[22]
Бактерии также являются еще одним направлением использования белков dCas9. Поскольку эукариоты имеют более крупный состав ДНК и геном; с гораздо более мелкими бактериями легко манипулировать. В результате эукариоты используют dCas9 для подавления РНК-полимеразы продолжения процесса транскрипции генетического материала.[23]
Структурно-биохимические исследования
Кристальная структура
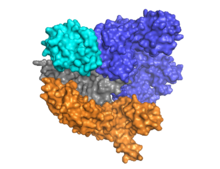
Cas9 имеет двухлепестковую архитектуру с направляющей РНК, расположенной между альфа-спиральной долей (синий) и долей нуклеазы (голубой, оранжевый и серый). Эти две доли соединены одной мостовой спиралью. Есть два нуклеазных домена, расположенных в доле многодоменной нуклеазы: RuvC (серый), который расщепляет нецелевую цепь ДНК, и нуклеазный домен HNH (голубой), который расщепляет целевую цепь ДНК. Домен RuvC кодируется последовательно разнесенными сайтами, которые взаимодействуют в третичной структуре с образованием домена расщепления RuvC (см. Правый рисунок).
Ключевой особенностью ДНК-мишени является то, что она должна содержать мотив, прилегающий к протоспейсеру (PAM), состоящий из трехнуклеотидной последовательности - NGG. Этот PAM распознается взаимодействующим с PAM доменом (домен PI, оранжевый), расположенным рядом с C-концевым концом Cas9. Cas9 претерпевает явные конформационные изменения между состояниями апо, связанными направляющими РНК и связанными направляющими РНК: ДНК.
Cas9 признает стебель-петля архитектура, присущая локусу CRISPR, которая опосредует созревание crRNA-tracrRNA рибонуклеопротеин сложный.[25] Cas9 в комплексе с CRISPR РНК (crRNA) и трансактивирующей crRNA (tracrRNA) дополнительно распознает и разрушает целевую дцДНК.[26] В представленной здесь сокристаллической структуре комплекс crRNA-tracrRNA заменен на химерный однонаправленная РНК (sgRNA, выделена красным), которая, как было доказано, выполняет ту же функцию, что и природный комплекс РНК.[4] Основание sgRNA в паре с целевой ssDNA закреплено Cas9 в виде Т-образной архитектуры. Эта кристаллическая структура ДНК-связанного фермента Cas9 выявляет отчетливые конформационные изменения в альфа-спиральной доле по отношению к доле нуклеазы, а также расположение домена HNH. Белок состоит из доли узнавания (REC) и доли нуклеазы (NUC). Все области, кроме HNH, образуют тесные взаимодействия друг с другом и комплексом sgRNA-ssDNA, в то время как домен HNH образует мало контактов с остальной частью белка. В другой конформации комплекса Cas9, наблюдаемой в кристалле, домен HNH не виден. Эти структуры предполагают конформационную гибкость домена HNH.
На сегодняшний день изучено и опубликовано не менее трех кристаллических структур. Один, представляющий конформацию Cas9 в состоянии апо,[24] и два представляют Cas9 в связанном с ДНК состоянии.[27][1]
Взаимодействие с sgRNA
В комплексе sgRNA-Cas9, основываясь на кристаллической структуре, домены REC1, BH и PI имеют важные контакты с остовом или основаниями как в области повтора, так и в области спейсера.[1][27] Были протестированы несколько мутантов Cas9, включая делецию доменов REC1 или REC2 и мутации остатков в BH. Мутанты, родственные REC1 и BH, проявляют более низкую активность или ее отсутствие по сравнению с диким типом, что указывает на то, что эти два домена имеют решающее значение для распознавания sgRNA в повторяющейся последовательности и стабилизации всего комплекса. Хотя взаимодействия между последовательностью спейсера и Cas9, а также доменом PI и районом повтора нуждаются в дальнейших исследованиях, сокристалл демонстрирует четкую границу раздела между Cas9 и sgRNA.
Расщепление ДНК
Предыдущий анализ последовательности и биохимические исследования показали, что Cas9 содержит два нуклеазных домена: McrA-подобный нуклеазный домен HNH и RuvC-подобный нуклеазный домен.[28] Эти HNH- и RuvC-подобные нуклеазные домены ответственны за расщепление комплементарной / целевой и некомплементарной / нецелевой цепей ДНК, соответственно.[4] Несмотря на низкое сходство последовательностей, последовательность, подобная РНКазе H, имеет складку RuvC (один член семейства РНКазы H), а область HNH складывается как T4 Endo VII (один член семейства эндонуклеаз HNH).[нужна цитата]
Дикого типа S. pyogenes Cas9 требует магния (Mg2+) кофакторы для РНК-опосредованного расщепления ДНК; однако было показано, что Cas9 проявляет различные уровни активности в присутствии других двухвалентный ионы металлов.[4] Например, Cas9 в присутствии марганца (Mn2+) было показано, что он способен к РНК-независимому расщеплению ДНК.[29] В кинетика расщепления ДНК с помощью Cas9 представляют большой интерес для научного сообщества, поскольку эти данные позволяют лучше понять тонкости реакции. Хотя было показано, что расщепление ДНК РНК-связанным Cas9 происходит относительно быстро (k ≥ 700 с−1) выход продуктов расщепления происходит очень медленно (т1/2 = ln (2) /k ≈ 43-91 ч), по существу превращая Cas9 в одно-оборот фермент.[30] Дополнительные исследования кинетики Cas9 показали: спроектированный Cas9 для эффективного снижения мимо эффекты путем изменения скорости реакции.[31][32]
Проблемы, которые бактерии создают для редактирования Cas9
Большинство археи и бактерии упорно отказываются позволить cas9 редактировать их геном. Это потому, что они могут прикреплять чужеродную ДНК, которая не влияет на них, в свой геном. Другой способ, которым эти клетки игнорируют Cas9, - это система процесса рестрикционной модификации (RM). Когда бактериофаг попадает в бактериальную клетку или клетку архей, он становится мишенью для системы RM. Затем система RM разрезает ДНК бактериофагов на отдельные части рестрикционными ферментами и использует эндонуклеазы для дальнейшего разрушения цепей ДНК. Это создает проблему для редактирования Cas9, потому что система RM также нацелена на чужеродные гены, добавленные процессом Cas9.[33]
Применение Cas9 для настройки транскрипции
Вмешательство в транскрипцию с помощью dCas9
Благодаря уникальной способности Cas9 связываться практически с любой последовательностью комплемента в любом геном, исследователи хотели использовать этот фермент для подавления транскрипция различных геномных места. Для этого два критических каталитических остатка домена RuvC и HNH можно мутировать на аланин устранение всей эндонуклеазной активности Cas9. Полученный в результате белок, обозначенный как «мертвый» Cas9 или для краткости «dCas9», все еще может прочно связываться с дцДНК. Этот каталитически Неактивный вариант Cas9 использовался как для механистических исследований вопросительного связывания ДНК Cas9, так и в качестве общего программируемого ДНК-связывающего комплекса РНК-белок.
Взаимодействие dCas9 с целевой дцДНК настолько сильное, что молярность мочевина денатурирующий белок не может полностью диссоциировать комплекс dCas9 РНК-белок от мишени dsDNA.[34] dCas9 был нацелен с помощью сконструированных однонаправляющих РНК к сайтам инициации транскрипции любых локусов, где dCas9 может конкурировать с РНК-полимеразой на промоторах, останавливая транскрипцию.[35] Кроме того, dCas9 может быть нацелен на кодирующую область локусов, так что ингибирование РНК-полимеразы происходит во время фазы элонгации транскрипции.[35] У эукариот подавление экспрессии генов может быть увеличено путем нацеливания dCas9 на энхансерные последовательности, где dCas9 может блокировать сборку факторов транскрипции, приводя к подавлению экспрессии специфических генов.[10] Более того, направляющие РНК, предоставленные для dCas9, могут быть разработаны таким образом, чтобы включать определенные несовпадения с его комплементарной родственной последовательностью, что количественно ослабит взаимодействие dCas9 с его запрограммированной родственной последовательностью, что позволит исследователю настроить степень подавления гена, применяемого к интересующему гену.[35]Эта технология принципиально похожа на РНКи так что экспрессия гена модулируется на уровне РНК. Однако подход dCas9 получил большую популярность, поскольку существует меньше нецелевых эффектов и в целом большие и более воспроизводимые эффекты сайленсинга за счет использования dCas9 по сравнению с экранами RNAi.[36] Более того, поскольку подход dCas9 к подавлению гена может контролироваться количественно, исследователь теперь может точно контролировать степень репрессии интересующего гена, что позволяет задать больше вопросов о регуляции генов и генах. стехиометрия нужно ответить.
Помимо прямого связывания dCas9 с транскрипционно чувствительными позициями локусов, dCas9 может быть слит с множеством модулирующих белковых доменов для выполнения множества функций. Недавно dCas9 был объединен с хроматин ремоделирующие белки (HDAC / HAT) для реорганизации структуры хроматина вокруг различных локусов.[35] Это важно для нацеливания на различные интересующие эукариотические гены, поскольку структуры гетерохроматина препятствуют связыванию Cas9. Кроме того, поскольку Cas9 может реагировать на гетерохроматин, предполагается, что этот фермент может быть в дальнейшем применен для изучения структуры хроматина различных локусов.[35] Кроме того, dCas9 использовался в полногеномном скрининге репрессии генов. Используя большие библиотеки направляющих РНК, способных воздействовать на тысячи генов, был проведен генетический скрининг всего генома с использованием dCas9.[37]
Другой метод подавления транскрипции с помощью Cas9 - это прямое расщепление продуктов мРНК с помощью каталитически активного фермента Cas9.[38] Этот подход стал возможным благодаря гибридизации оцДНК с комплементарной последовательностью PAM с оцРНК, позволяющей создать сайт дцДНК-РНК PAM для связывания Cas9. Эта технология дает возможность выделять эндогенные РНК-транскрипты в клетках без необходимости индуцировать химические модификации РНК или методов маркировки РНК.
Активация транскрипции слитыми белками dCas9
В отличие от генов сайленсинга, dCas9 может также использоваться для активации генов при слиянии с факторами активации транскрипции.[35] Эти факторы включают субъединицы бактериальной РНК-полимеразы II и традиционные факторы транскрипции у эукариот. Недавно были также проведены скрининг активации транскрипции по всему геному с использованием для активации слитых dCas9, названных «CRISPRa».[37]
Смотрите также
- Система активации DCas9
- CRISPR
- Редактирование генов CRISPR
- Редактирование генома
- Нуклеаза цинкового пальца
- Эффекторная нуклеаза, подобная активатору транскрипции
Рекомендации
- ^ а б c Нисимасу Х., Ран Ф.А., Сюй П.Д., Конерманн С., Шехата С.И., Дохмае Н., Ишитани Р., Чжан Ф., Нуреки О. (февраль 2014 г.). «Кристаллическая структура Cas9 в комплексе с направляющей РНК и целевой ДНК». Клетка. 156 (5): 935–49. Дои:10.1016 / j.cell.2014.02.001. ЧВК 4139937. PMID 24529477.
- ^ «Нобелевская премия по химии 2020 года». NobelPrize.org. Получено 2020-10-07.
- ^ а б Дельчева Е., Чилински К., Шарма К.М., Гонсалес К., Чао Ю., Пирзада З.А., Экерт М.Р., Фогель Дж., Шарпантье Е. (март 2011 г.). «Созревание РНК CRISPR с помощью транскодируемой малой РНК и фактора хозяина РНКазы III». Природа. 471 (7340): 602–607. Bibcode:2011Натура.471..602D. Дои:10.1038 / природа09886. ЧВК 3070239. PMID 21455174.
- ^ а б c d е ж Джинек М., Чилински К., Фонфара И., Хауэр М., Дудна Дж. А., Шарпантье Е. (август 2012 г.). «Программируемая двойная РНК-управляемая ДНК-эндонуклеаза в адаптивном бактериальном иммунитете». Наука. 337 (6096): 816–21. Bibcode:2012Sci ... 337..816J. Дои:10.1126 / наука.1225829. ЧВК 6286148. PMID 22745249.
- ^ а б c Хелер Р., Самай П., Моделл Дж. В., Вайнер С., Голдберг Г. В., Бикард Д., Марраффини Л. А. (март 2015 г.). «Cas9 определяет функциональные вирусные мишени во время адаптации CRISPR-Cas». Природа. 519 (7542): 199–202. Bibcode:2015Натура.519..199H. Дои:10.1038 / природа14245. ЧВК 4385744. PMID 25707807.
- ^ Баррангу Р., Фремо С., Дево Х., Ричардс М., Боявал П., Муано С. и др. (Март 2007 г.). «CRISPR обеспечивает приобретенную устойчивость к вирусам у прокариот». Наука. 315 (5819): 1709–12. Bibcode:2007Научный ... 315.1709B. Дои:10.1126 / science.1138140. HDL:20.500.11794/38902. PMID 17379808.
- ^ а б Гарно Дж. Э., Дюпюи М., Виллион М., Ромеро Д. А., Баррангу Р., Боявал П., Фремо С., Хорват П., Магадан А. Х., Мойно С. (ноябрь 2010 г.). «Бактериальная иммунная система CRISPR / Cas расщепляет бактериофаговую и плазмидную ДНК». Природа. 468 (7320): 67–71. Bibcode:2010 Натур.468 ... 67G. CiteSeerX 10.1.1.451.9645. Дои:10.1038 / природа09523. PMID 21048762.
- ^ Мали П., Эсвелт К.М., Church GM (октябрь 2013 г.). «Cas9 как универсальный инструмент инженерной биологии». Методы природы. 10 (10): 957–63. Дои:10.1038 / nmeth.2649. ЧВК 4051438. PMID 24076990.
- ^ Мали П., Аач Дж., Странджес ПБ, Эсвелт К.М., Моосбернер М., Косури С., Ян Л., Черч Дж. М. (сентябрь 2013 г.). «Активаторы транскрипции CAS9 для скрининга целевой специфичности и парные никазы для совместной геномной инженерии». Природа Биотехнологии. 31 (9): 833–8. Дои:10.1038 / nbt.2675. ЧВК 3818127. PMID 23907171.
- ^ а б Гилберт Л.А., Ларсон М.Х., Морсут Л., Лю З., Брар Г.А., Торрес С.Е., Стерн-Гиноссар Н., Брэндман О., Уайтхед Е.Х., Дудна Д.А., Лим В.А., Вайсман Д.С., Ци Л.С. (июль 2013 г.). «CRISPR-опосредованная модульная РНК-управляемая регуляция транскрипции у эукариот». Клетка. 154 (2): 442–51. Дои:10.1016 / j.cell.2013.06.044. ЧВК 3770145. PMID 23849981.
- ^ Эсвелт К.М., Смидлер А.Л., Каттеручча Ф., Черч Г.М. (июль 2014 г.). «Относительно РНК-управляемых генов для изменения диких популяций». eLife. 3. Дои:10.7554 / eLife.03401. ЧВК 4117217. PMID 25035423.
- ^ Сираноски Д., Рирдон С. (22 апреля 2015 г.). «Китайские ученые генетически модифицируют человеческие эмбрионы». Природа. Дои:10.1038 / природа.2015.17378.
- ^ Дудна Дж. А., Мали П. (2016). CRISPR-Cas: лабораторное руководство. Колд-Спринг-Харбор, Нью-Йорк. ISBN 9781621821304. OCLC 922914104.
- ^ Чен В., Пейдж-Маккоу PS (март 2019 г.). «Редактирование гена CRISPR / Cas9». AccessScience. McGraw-Hill Education. Дои:10.1036/1097-8542.168060.
- ^ Эбина Х., Мисава Н., Канемура Й., Коянаги Й. (26.08.2013). «Использование системы CRISPR / Cas9 для уничтожения латентного провируса ВИЧ-1». Научные отчеты. 3 (1): 2510. Дои:10.1038 / srep02510. ЧВК 3752613. PMID 23974631.
- ^ Ли Х, Шэн Ц, Ван С, Ян Л, Лян И, Хуанг И, Лю Х, Ли П, Ян Ц, Ян Х, Цзя Л, Се Дж, Ван Л, Хао Р, Ду Х, Сюй Д, Чжоу Дж. , Ли М, Сун И, Тонг И, Ли Кью, Цю С., Сон Х (2017-03-22). «Удаление интегрированной ДНК вируса гепатита B с помощью CRISPR-Cas9». Границы клеточной и инфекционной микробиологии. 7: 91. Дои:10.3389 / fcimb.2017.00091. ЧВК 5360708. PMID 28382278.
- ^ Хорват П., Баррангу Р. (январь 2010 г.). «CRISPR / Cas, иммунная система бактерий и архей». Наука. 327 (5962): 167–70. Bibcode:2010Sci ... 327..167H. Дои:10.1126 / science.1179555. PMID 20056882.
- ^ Каргинов Ф.В., Хэннон Г.Дж. (январь 2010 г.). «Система CRISPR: защита с помощью малых РНК у бактерий и архей». Молекулярная клетка. 37 (1): 7–19. Дои:10.1016 / j.molcel.2009.12.033. ЧВК 2819186. PMID 20129051.
- ^ Йенсен Э.Д., Феррейра Р., Якочюнас Т., Арсовска Д., Чжан Дж., Динг Л. и др. (Март 2017 г.). «Транскрипционное репрограммирование в дрожжах с использованием стратегии dCas9 и комбинаторной гРНК». Фабрики микробных клеток. 16 (1): 46. Дои:10.1186 / s12934-017-0664-2. ЧВК 5353793. PMID 28298224.
- ^ Пинто Б.С., Саксена Т., Оливейра Р., Мендес-Гомес Х.Р., Клири Д.Д., Денес Л.Т., МакКоннелл О., Арболеда Дж., Ся Джи, Суонсон М.С., Ван ET (ноябрь 2017 г.). "Препятствие транскрипции расширенных микросателлитных повторов деактивированным Cas9". Молекулярная клетка. 68 (3): 479–490.e5. Дои:10.1016 / j.molcel.2017.09.033. ЧВК 6013302. PMID 29056323.
- ^ О'Джин Х., Рен С., Николет С.М., Перес А.А., Халмай Дж., Ле В.М., Маккей Дж. П., Фарнхэм П. Дж., Сигал Диджей (сентябрь 2017 г.). «Редактирование эпигенома на основе dCas9 предполагает, что приобретение метилирования гистонов недостаточно для репрессии целевого гена». Исследования нуклеиновых кислот. 45 (17): 9901–9916. Дои:10.1093 / nar / gkx578. ЧВК 5622328. PMID 28973434.
- ^ Лоудер Л.Г., Пол Дж. У., Ци И (2017). Мультиплексная активация или репрессия транскрипции в растениях с использованием систем на основе CRISPR-dCas9. Методы молекулярной биологии. 1629. С. 167–184. Дои:10.1007/978-1-4939-7125-1_12. ISBN 978-1-4939-7124-4. PMID 28623586.
- ^ Баррангу Р., Хорват П. (июнь 2017 г.). «Десятилетие открытий: функции и приложения CRISPR». Природная микробиология. 2 (7): 17092. Дои:10.1038 / nmicrobiol.2017.92. PMID 28581505.
- ^ а б Jinek M, Jiang F, Taylor DW, Sternberg SH, Kaya E, Ma E, Anders C., Hauer M, Zhou K, Lin S., Kaplan M, Iavarone AT, Charpentier E, Nogales E, Doudna JA (март 2014 г.). «Структуры эндонуклеаз Cas9 обнаруживают РНК-опосредованную конформационную активацию». Наука. 343 (6176): 1247997. Дои:10.1126 / science.1247997. ЧВК 4184034. PMID 24505130.
- ^ Виденхефт Б., Штернберг С.Х., Дудна Ю.А. (февраль 2012 г.). «РНК-управляемые системы генетического сайленсинга у бактерий и архей». Природа. 482 (7385): 331–8. Bibcode:2012Натура 482..331Вт. Дои:10.1038 / природа10886. PMID 22337052.
- ^ Ран Ф.А., Сюй П.Д., Райт Дж., Агарвала В., Скотт Д.А., Чжан Ф. (ноябрь 2013 г.). «Геномная инженерия с использованием системы CRISPR-Cas9». Протоколы природы. 8 (11): 2281–2308. Дои:10.1038 / nprot.2013.143. ЧВК 3969860. PMID 24157548.
- ^ а б Андерс С., Невоехнер О., Дюрст А., Янек М. (сентябрь 2014 г.). «Структурные основы распознавания PAM-зависимой целевой ДНК эндонуклеазой Cas9». Природа. 513 (7519): 569–73. Дои:10.1038 / природа13579. ЧВК 4176945. PMID 25079318.
- ^ Макарова К.С., Гришин Н.В., Шабалина С.А., Вольф Ю.И., Кунин Е.В. (март 2006 г.). «Предполагаемая иммунная система прокариот, основанная на РНК-интерференции: компьютерный анализ предсказанного ферментативного механизма, функциональные аналогии с эукариотической РНКи и гипотетические механизмы действия». Биология Директ. 1 (1): 7. Дои:10.1186/1745-6150-1-7. ЧВК 1462988. PMID 16545108.
- ^ Сундаресан Р., Парамешваран ХП, Йогеша С.Д., Кейлбарт М.В., Раджан Р. (декабрь 2017 г.). «РНК-независимая активность расщепления ДНК Cas9 и Cas12a». Отчеты по ячейкам. 21 (13): 3728–3739. Дои:10.1016 / j.celrep.2017.11.100. ЧВК 5760271. PMID 29281823.
- ^ Raper AT, Stephenson AA, Suo Z (февраль 2018 г.). «Функциональные идеи, обнаруженные кинетическим механизмом CRISPR / Cas9». Журнал Американского химического общества. 140 (8): 2971–2984. Дои:10.1021 / jacs.7b13047. PMID 29442507.
- ^ Ли JK, Jeong E, Lee J, Jung M, Shin E, Kim YH и др. (Август 2018 г.). «Направленная эволюция CRISPR-Cas9 для повышения его специфичности». Nature Communications. 9 (1): 3048. Bibcode:2018NatCo ... 9.3048L. Дои:10.1038 / с41467-018-05477-х. ЧВК 6078992. PMID 30082838.
- ^ Сингх Д., Ван И, Мэллон Дж., Ян О, Фей Дж., Поддар А. и др. (Апрель 2018 г.). «Механизмы повышенной специфичности сконструированных Cas9, выявленные методом FRET-анализа на одной молекуле». Структурная и молекулярная биология природы. 25 (4): 347–354. Дои:10.1038 / s41594-018-0051-7. ЧВК 6195204. PMID 29622787.
- ^ Кусано К., Наито Т., Ханда Н., Кобаяси И. (ноябрь 1995 г.). «Системы рестрикции и модификации как геномные паразиты в конкуренции за определенные последовательности». Труды Национальной академии наук Соединенных Штатов Америки. 92 (24): 11095–9. Bibcode:1995PNAS ... 9211095K. Дои:10.1073 / пнас.92.24.11095. ЧВК 40578. PMID 7479944.
- ^ Штернберг Ш., Реддинг С., Джинек М., Грин Э. К., Дудна Дж. А. (март 2014 г.). "Исследование ДНК с помощью CRISPR-управляемой РНК эндонуклеазы Cas9". Природа. 507 (7490): 62–7. Дои:10.1038 / природа13011. ЧВК 4106473. PMID 24476820.
- ^ а б c d е ж Бикард Д., Цзян В., Самай П., Хохшильд А., Чжан Ф., Марраффини Л.А. (август 2013 г.). «Программируемая репрессия и активация экспрессии бактериальных генов с использованием разработанной системы CRISPR-Cas». Исследования нуклеиновых кислот. 41 (15): 7429–37. Дои:10.1093 / nar / gkt520. ЧВК 3753641. PMID 23761437.
- ^ Хайнце Дж, Люфт С, Кеттелер Р (2013). «CRISPR CASe для высокопроизводительного подавления шума». Границы генетики. 4: 193. Дои:10.3389 / fgene.2013.00193. ЧВК 3791873. PMID 24109485.
- ^ а б Гилберт Л.А., Хорлбек М.А., Адамсон Б., Вильялта Дж. Э., Чен Ю., Уайтхед Е. Х., Гимарайнш С., Паннинг Б., Плоег Г. Л., Бассик М. С., Ци Л. С., Кампманн М., Вайсман Дж. С. (октябрь 2014 г.). "Контроль репрессии и активации генов, опосредованный CRISPR в масштабе генома". Клетка. 159 (3): 647–61. Дои:10.1016 / j.cell.2014.09.029. ЧВК 4253859. PMID 25307932.
- ^ О'Коннелл М.Р., Оукс Б.Л., Штернберг С.Х., Ист-Селецкий А., Каплан М., Дудна Д.А. (декабрь 2014 г.). «Программируемое распознавание и расщепление РНК с помощью CRISPR / Cas9». Природа. 516 (7530): 263–6. Дои:10.1038 / природа13769. ЧВК 4268322. PMID 25274302.
дальнейшее чтение
- Кеннеди Э.М., Каллен Б.Р. (май 2015 г.). «Бактериальные эндонуклеазы ДНК CRISPR / Cas: революционная технология, которая может существенно повлиять на исследования и лечение вирусов». Вирусология. 479–480: 213–20. Дои:10.1016 / j.virol.2015.02.024. ЧВК 4424069. PMID 25759096.
- Abbott TR, Dhamdhere G, Liu Y, Lin X, Goudy L, Zeng L и др. (Май 2020 г.). «Разработка CRISPR как противовирусной стратегии для борьбы с SARS-CoV-2 и гриппом». Клетка. 181: 1–12. Дои:10.1016 / j.cell.2020.04.020. Сложить резюме – ПРОВОДНОЙ.