WikiDer > Germane
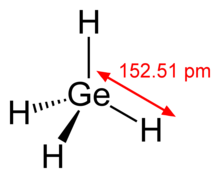 | |||
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Germane | |||
| Другие имена Тетрагидрид германия Германометан Monogermane | |||
| Идентификаторы | |||
3D модель (JSmol) | |||
| ЧЭБИ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.029.055 | ||
| КЕГГ | |||
PubChem CID | |||
| Номер RTECS |
| ||
| UNII | |||
| Номер ООН | 2192 | ||
| |||
| |||
| Характеристики | |||
| GeH4 | |||
| Молярная масса | 76.62 г / моль | ||
| Внешность | Бесцветный газ | ||
| Запах | Острый[1] | ||
| Плотность | 3.3 кг / м3 | ||
| Температура плавления | -165 ° С (-265 ° F, 108 К) | ||
| Точка кипения | -88 ° С (-126 ° F, 185 К) | ||
| Низкий | |||
| Давление газа | >1 банкомат[1] | ||
| Вязкость | 17,21 мкПа · с (теоретическая оценка)[2] | ||
| Структура | |||
| Тетраэдр | |||
| 0 D | |||
| Опасности | |||
| Главный опасности | Токсичен, легко воспламеняется, может самовоспламеняться на воздухе | ||
| Паспорт безопасности | ICSC 1244 | ||
| NFPA 704 (огненный алмаз) | |||
| NIOSH (Пределы воздействия на здоровье в США): | |||
PEL (Допустимо) | Никто[1] | ||
REL (Рекомендуемые) | TWA 0.2 частей на миллион (0,6 мг / м3)[1] | ||
IDLH (Непосредственная опасность) | N.D.[1] | ||
| Родственные соединения | |||
Родственные соединения | Метан Силан Станнан Plumbane | ||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Germane это химическое соединение с формулой GeЧАС4, а германий аналог из метан. Это простейший гидрид германия и одно из наиболее полезных соединений германия. Как родственные соединения силан и метан, герман четырехгранный. Он горит на воздухе, чтобы произвести GeO2 и воды. Джерман - это группа 14 гидрид.
Вхождение
Germane был обнаружен в атмосфере Юпитер.[3]
Синтез
Герман обычно получают путем восстановления соединений германия, особенно диоксид германия, с гидридными реагентами, такими как борогидрид натрия, борогидрид калия, борогидрид лития, литийалюминийгидрид, алюмогидрид натрия. Реакция с боргидридами катализируется различными кислотами и может проводиться как в водной, так и в органической среде. растворитель. В лабораторных условиях герман можно получить реакцией соединений Ge (IV) с этими гидрид реагенты.[4][5] Типичный синтез включал реакцию Na2GeO3 с участием борогидрид натрия.[6]
- Na2GeO3 + NaBH4 + H2O → GeH4 + 2 NaOH + NaBO2
Другие методы синтеза германа включают: электрохимическое восстановление и плазма-основанный метод.[7] Метод электрохимического восстановления предполагает нанесение Напряжение к металлу германия катод погружен в водный электролит решение и анод противоэлектрод, состоящий из металла, такого как молибден или кадмий. В этом методе германия и водород газы выделяются из катода, в то время как анод реагирует с образованием твердого оксид молибдена или оксиды кадмия. Метод плазменного синтеза включает бомбардировку металлического германия атомами водорода (H), которые генерируются с использованием высокой частота источник плазмы для производства германа и Digermane.
Реакции
Джермане слабо кислый. В жидком аммиаке GeH4 ионизируется с образованием NH4+ и GeH3−.[8] Со щелочными металлами в жидком аммиаке GeH4 реагирует с образованием белого кристаллического MGeH3 соединения. Калий (гермил калия KGeH3) и соединения рубидия (рубидий гермил RbGeH3) иметь хлорид натрия структура, предполагающая свободное вращение GeH3− анион, соединение цезия, CsGeH3 напротив, имеет искаженную структуру хлорида натрия TlI.[8]
Использование в полупроводниковой промышленности
Газ разлагается около 600K (327 ° C; 620 ° F) на германий и водород. Из-за своего теплового лабильность, герман используется в полупроводник промышленность для эпитаксиальный рост германия за счет MOVPE или химико-лучевая эпитаксия.[9] Прекурсоры органогермания (например, изобутилгерман, трихлориды алкилгермания и трихлорид диметиламиногермания) были исследованы как менее опасные жидкие альтернативы герману для осаждения Ge-содержащих пленок методом MOVPE.[10]
Безопасность
Джерман очень легковоспламеняющийсяпотенциально пирофорный,[11] и высокотоксичный газ. В 1970 г. Американская конференция государственных специалистов по промышленной гигиене (ACGIH) опубликовал последние изменения и установил пороговое значение профессионального воздействия на уровне 0,2 промилле для 8-часового среднего взвешенного по времени.[12]В LC50 для крыс на 1 час воздействия составляет 622 ppm.[13] Вдыхание или воздействие может вызвать недомогание, головную боль, головокружение, обморок, одышку, тошноту, рвоту, повреждение почек и гемолитические эффекты.[14][15][16]
В Министерство транспорта США класс опасности составляет 2.3 Ядовитый газ.[12]
Рекомендации
- ^ а б c d е Карманный справочник NIOSH по химической опасности. "#0300". Национальный институт охраны труда и здоровья (NIOSH).
- ^ Yaws, Карл Л. (1997), Справочник по вязкости: Том 4: Неорганические соединения и элементы, Gulf Professional Publishing, ISBN 978-0123958501
- ^ Kunde, V .; Hanel, R .; Maguire, W .; Gautier, D .; Baluteau, J. P .; Marten, A .; Chedin, A .; Husson, N .; Скотт, Н. (1982). "Газовый состав тропосферы северного экваториального пояса Юпитера (NH3, PH3, CH3D, GeH4, H2O) и изотопное отношение Юпитера D / H ». Астрофизический журнал. 263: 443–467. Bibcode:1982ApJ ... 263..443K. Дои:10.1086/160516.
- ^ W. L. Jolly "Получение летучих гидридов групп IVA и VA с помощью водного гидробората" Журнал Американского химического общества, 1961 г., том 83, стр. 335-7.
- ^ Патент США 4,668,502
- ^ Girolami, G.S .; Rauchfuss, T. B .; Анджеличи, Р. Дж. (1999). Синтез и техника в неорганической химии. Милл-Вэлли, Калифорния: Университетские научные книги.
- ^ Патент США 7087102 (2006).
- ^ а б Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. ISBN 978-0-08-037941-8.
- ^ Venkatasubramanian, R .; Пикетт, Р. Т .; Тиммонс, М. Л. (1989). «Эпитаксия германия с использованием германа в присутствии тетраметилгермания». Журнал прикладной физики. 66 (11): 5662–5664. Bibcode:1989JAP .... 66,5662V. Дои:10.1063/1.343633.
- ^ Woelk, E .; Шенай-Хатхате, Д. В .; DiCarlo, R. L. Jr .; Амамчян, А .; Power, M. B .; Lamare, B .; Beaudoin, G .; Саньес, И. (2006). "Разработка новых германиевых прекурсоров MOVPE для пленок германия высокой чистоты". Журнал роста кристаллов. 287 (2): 684–687. Bibcode:2006JCrGr.287..684W. Дои:10.1016 / j.jcrysgro.2005.10.094.
- ^ Брауэр, 1963, Том 1, 715
- ^ а б Паспорт безопасности материалов Praxair по состоянию на сентябрь 2011 г.
- ^ NIOSH Germane Реестр токсического действия химических веществ (RTECS) по состоянию на сентябрь 2011 г.
- ^ Гуськова Е.И. (1974). "К токсикологии гидрида германия". Гигиена Труда И Профессиональные Заболевания (на русском). 18 (2): 56–57. PMID 4839911.
- ^ US EPA Germane
- ^ Paneth, F .; Иоахимоглу, Г. (1924). "Uber die Pharmakologischen Eigenschaften des Zinnwasserstoffs und Germaniumwasserstoffs" [О фармакологических характеристиках гидрида олова и гидрида германия]. Berichte der Deutschen Chemischen Gesellschaft (на немецком). 57 (10): 1925–1930. Дои:10.1002 / cber.19240571027.
внешняя ссылка
| Искать немецкий в Викисловаре, бесплатном словаре. |
- Лист данных Metaloids (производитель)
- Технические данные Arkonic Specialty Gases, Китай (производитель)
- Лицензинторг Россия (продажа технологической техники)
- Honjo Chemical Japan (производитель)
- Технические данные Praxair
- Энциклопедия воздуха сжиженного газа запись
- CDC - Карманный справочник NIOSH по химической опасности
- Voltaix (производитель) лист данных
- Foshan Huate Gas Co., Ltd. (производитель)
- Horst Technologies, Россия (производитель)









