WikiDer > Протеопатия
| Протеопатия | |
|---|---|
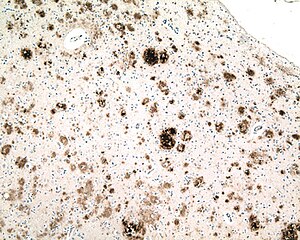 | |
| Микрофотография секции кора головного мозга от человека с Болезнь Альцгеймера, иммуноокрашенный антитело к амилоид бета (коричневый), фрагмент белка, который накапливается в старческие бляшки и церебральная амилоидная ангиопатия. Объектив микроскопа 10X. |
В лекарство, протеопатия (/прoʊтяˈɒпəθя/; от протео- [pref. белок]; -патия [суть. болезнь]; протеопатии pl.; протеопатический прил) относится к классу болезни в котором определенные белки становятся структурно ненормальными и тем самым нарушают функцию клетки, ткани и органы тела.[1][2] Часто белки не справляются с сложить в их нормальную конфигурацию; в этом неправильно свернутом состоянии белки могут каким-то образом стать токсичными (токсичный усиление функции) или они могут потерять свою нормальную функцию.[3] Протеопатии (также известные как протеинопатии, белковые конформационные нарушения, или болезни неправильной упаковки белка) включают такие заболевания как Болезнь Крейтцфельдта-Якоба и другие прионные болезни, Болезнь Альцгеймера, болезнь Паркинсона, амилоидоз, множественная системная атрофия, а также широкий спектр других расстройств.[2][4][5][6][7][8] Период, термин протеопатия был впервые предложен в 2000 г. Лэри Уокер и Гарри Левин.[1]
Концепция протеопатии восходит к середине XIX века, когда в 1854 году Рудольф Вирхов ввел термин амилоид («крахмалоподобный») для описания вещества в церебральном тела амилацеи который показал химическую реакцию, напоминающую реакцию целлюлоза. В 1859 г. Фридрейх и Кекуле продемонстрировали, что «амилоид» не состоит из целлюлозы, а на самом деле богат белком.[9] Последующие исследования показали, что многие различные белки могут образовывать амилоид, и что все амилоиды обнаруживают двулучепреломление в перекрестномполяризованный свет после окрашивания красителем Конго красный, также как и фибриллярный ультраструктура при просмотре с электронный микроскоп.[9] Однако некоторые белковые образования лишены двойного лучепреломления и содержат мало или совсем не содержат классических амилоидных фибрилл, например, диффузные отложения бета-амилоидного (Aβ) белка в мозге людей с болезнью Альцгеймера.[10] Кроме того, появились доказательства того, что небольшие нефибриллярные белковые агрегаты, известные как олигомеры токсичны для клеток пораженного органа, и что амилоидогенные белки в их фибриллярной форме могут быть относительно доброкачественными.[11][12]
Патофизиология
В большинстве, если не во всех протеопатиях, изменение трехмерного фолдинга (конформации) увеличивает тенденцию конкретного белка связываться с самим собой.[5] В этой агрегированной форме белок устойчив к клиренсу и может нарушать нормальную способность пораженных органов. В некоторых случаях неправильная укладка белка приводит к потере его обычной функции. Например, кистозный фиброз вызвано дефектным регулятор трансмембранной проводимости при муковисцидозе (CFTR) белок,[3] и при боковом амиотрофическом склерозе / лобно-височной долевой дегенерации (FTLD) определенные генно-регулирующие белки ненадлежащим образом агрегируются в цитоплазме и, таким образом, неспособны выполнять свои обычные задачи в ядре.[13][14] Поскольку белки имеют общую структурную особенность, известную как полипептид позвоночника, все белки при некоторых обстоятельствах могут неправильно складываться.[15] Однако только относительно небольшое количество белков связано с протеопатическими нарушениями, возможно, из-за структурных идиосинкразий уязвимых белков. Например, белки, которые обычно развернуты или относительно нестабильны, как мономеры (то есть, как отдельные несвязанные белковые молекулы) с большей вероятностью неправильно сворачиваются в аномальную конформацию.[5][15][16] Почти во всех случаях молекулярная конфигурация, вызывающая заболевание, связана с увеличением бета-лист вторичная структура белка.[5][15][17][18] Было показано, что аномальные белки при некоторых протеопатиях складываются в несколько трехмерных форм; В этих вариантах белковые структуры определяются различными патогенными, биохимическими и конформационными свойствами.[19] Наиболее полно они изучены в отношении прионная болезнь, и называются белком напряжения.[20][21]

Вероятность развития протеопатии увеличивается за счет определенных факторы риска которые способствуют самосборке белка. К ним относятся дестабилизирующие изменения в первичной аминокислота последовательность белка, посттрансляционные модификации (такие как гиперфосфорилирование), изменения температуры или pH, увеличение производства белка или уменьшение его клиренса.[1][5][15] Пожилой возраст - сильный фактор риска,[1] как черепно-мозговая травма.[22][23] В стареющем мозге несколько протеопатий могут перекрываться.[24] Например, помимо таупатия и Aβ-амилоидоз (которые сосуществуют как ключевые патологические признаки болезни Альцгеймера), многие пациенты с болезнью Альцгеймера имеют сопутствующую синуклеинопатию (Тела Леви) в мозгу.[25]
Предполагается, что шапероны и ко-шапероны (белки, которые помогают сворачивание белка) может противодействовать протеотоксичности во время старения и при заболеваниях, связанных с неправильной упаковкой белка, для поддержания протеостаз.[26][27][28]
Посевная индукция
Некоторые белки могут быть индуцированы к формированию аномальных сборок путем воздействия того же (или аналогичного) белка, который превратился в вызывающую болезнь конформацию, процесс, называемый «посевом» или «разрешающим шаблоном».[29][30] Таким образом, болезненное состояние может быть вызвано у уязвимых хозяин путем введения экстракта пораженной ткани больного донора. Самая известная форма такой индуцибельной протеопатии - это прионная болезнь,[31] которые могут передаваться при воздействии на организм хозяина очищенного прионного белка в вызывающей заболевание конформации.[32][33] В настоящее время есть доказательства того, что другие протеопатии могут быть вызваны аналогичным механизмом, включая Aβ амилоидоз, амилоид А (AA) амилоидоз и амилоидоз аполипопротеина AII,[30][34] таупатия,[35] синуклеинопатия,[36][37][38][39] и совокупность супероксиддисмутаза-1 (СОД1),[40][41] полиглутамин,[42][43] и ДНК-связывающий белок TAR-43 (ТДП-43).[44]
Во всех этих случаях патогенным агентом является сама аберрантная форма белка. В некоторых случаях отложение одного типа белка может быть экспериментально индуцировано агрегированными ансамблями других белков, которые богаты структурой β-слоя, возможно, из-за структурной комплементарности белковых молекул. Например, амилоидоз АК может стимулироваться у мышей такими разнообразными макромолекулы как шелк, дрожжи амилоид Sup35 и кудряшки от бактерии кишечная палочка.[45] Кроме того, амилоид аполипопротеина AII может быть индуцирован у мышей с помощью различных амилоидных фибрилл, богатых β-слоями,[46] а церебральная таупатия может быть вызвана экстрактами мозга, которые богаты агрегированным Aβ.[47] Имеются также экспериментальные данные о перекрестном посеве между прионным белком и Aβ.[48] В общем, такой гетерологичный посев менее эффективен, чем посев поврежденной формой того же самого белка.
Список протеопатий
Управление
Разработка эффективных методов лечения многих протеопатий была сложной задачей.[73][74] Поскольку протеопатии часто связаны с разными белками, происходящими из разных источников, стратегии лечения должны быть адаптированы к каждому заболеванию; однако общие терапевтические подходы включают поддержание функции пораженных органов, уменьшение образования вызывающих заболевание белков, предотвращение неправильной укладки и / или агрегации белков или содействие их удалению.[75][73][76] Например, при болезни Альцгеймера исследователи ищут способы снизить выработку связанного с заболеванием белка Aβ путем ингибирования ферменты которые освобождают его от родительского белка.[74] Другая стратегия - использовать антитела нейтрализовать определенные белки активными или пассивными иммунизация.[77] При некоторых протеопатиях может быть полезным подавление токсических эффектов белковых олигомеров.[78] Амилоидоз амилоида A (AA) можно уменьшить путем лечения воспалительный состояние, при котором увеличивается количество белка в крови (называемое сыворотка амилоид А, или SAA).[73] В легкая цепь иммуноглобулина амилоидоз (AL amyloidosis), химиотерапия может использоваться для снижения количества клеток крови, которые производят белок легкой цепи, который образует амилоид в различных органах тела.[79] Транстиретин (TTR) амилоидоз (ATTR) возникает в результате отложения неправильно свернутого TTR во многих органах.[80] Поскольку TTR в основном производится в печень, Амилоидоз TTR может быть замедлен у некоторых наследственный случаи по печени трансплантация.[81] Амилоидоз TTR также можно лечить, стабилизируя нормальные сборки белка (называемого тетрамеры потому что они состоят из четырех TTR молекулы связаны вместе). Стабилизация предотвращает ускользание, неправильное сворачивание и агрегацию отдельных молекул TTR в амилоид.[82][83]
Некоторые другие стратегии лечения протеопатий изучаются, в том числе: маленькие молекулы и биологический лекарства, такие как малые интерферирующие РНК, антисмысловые олигонуклеотиды, пептиды, и спроектировал иммунные клетки.[82][79][84][85] В некоторых случаях для повышения эффективности можно комбинировать несколько терапевтических агентов.[79][86]
Дополнительные изображения
Смотрите также
использованная литература
- ^ а б c d Уокер Л.К., Левин Х (2000). «Церебральные протеопатии». Нейробиология старения. 21 (4): 559–61. Дои:10.1016 / S0197-4580 (00) 00160-3. PMID 10924770.
- ^ а б Уокер Л.К., Левин Х (2000). «Церебральные протеопатии: нейродегенеративные нарушения конформации и сборки белков». Молекулярная нейробиология. 21 (1–2): 83–95. Дои:10.1385 / MN: 21: 1-2: 083. PMID 11327151.
- ^ а б Лухеши Л.М., Кроутер, округ Колумбия, Добсон С.М. (февраль 2008 г.). «Неправильная укладка белков и болезни: от пробирки к организму». Современное мнение в области химической биологии. 12 (1): 25–31. Дои:10.1016 / j.cbpa.2008.02.011. PMID 18295611.
- ^ Чити Ф, Добсон CM (2006). «Неправильная упаковка белка, функциональный амилоид и болезнь человека». Ежегодный обзор биохимии. 75 (1): 333–66. Дои:10.1146 / annurev.biochem.75.101304.123901. PMID 16756495.
- ^ а б c d е Каррелл Р.В., Ломас Д.А. (июль 1997 г.). «Конформационное заболевание». Ланцет. 350 (9071): 134–8. Дои:10.1016 / S0140-6736 (97) 02073-4. PMID 9228977.
- ^ Вестермарк П., Бенсон, доктор медицины, Буксбаум Дж., Коэн А.С., Франжионе Б., Икеда С., Мастерс С.Л., Мерлини Дж., Сараива М.Дж., Сайпе Дж. Д. (сентябрь 2007 г.). «Праймер амилоидной номенклатуры». Амилоид. 14 (3): 179–83. Дои:10.1080/13506120701460923. PMID 17701465.
- ^ Westermark GT, Fändrich M, Lundmark K, Westermark P (январь 2018 г.). «Нецеребральные амилоидозы: аспекты посева, кросс-посева и передачи». Перспективы Колд-Спринг-Харбор в медицине. 8 (1): a024323. Дои:10.1101 / cshperspect.a024323. PMID 28108533.
- ^ Прусинер С.Б. (2013). «Биология и генетика прионов, вызывающих нейродегенерацию». Ежегодный обзор генетики. 47: 601–23. Дои:10.1146 / annurev-genet-110711-155524. ЧВК 4010318. PMID 24274755.
- ^ а б Сайпе Дж. Д., Коэн А. С. (июнь 2000 г.). «Обзор: история амилоидного фибриллы». Журнал структурной биологии. 130 (2–3): 88–98. Дои:10.1006 / jsbi.2000.4221. PMID 10940217.
- ^ Вишневски Х.М., Садовски М., Якубовска-Садовска К., Тарнавски М., Вегель Дж. (Июль 1998 г.). «Диффузные озерные отложения бета-амилоида в парвопирамидном слое предубикулума при болезни Альцгеймера». Журнал невропатологии и экспериментальной неврологии. 57 (7): 674–83. Дои:10.1097/00005072-199807000-00004. PMID 9690671.
- ^ Glabe CG (апрель 2006 г.). «Общие механизмы патогенеза амилоидных олигомеров при дегенеративных заболеваниях». Нейробиология старения. 27 (4): 570–5. Дои:10.1016 / j.neurobiolaging.2005.04.017. PMID 16481071.
- ^ Гадад Б.С., Бриттон Г.Б., Рао К.С. (2011). «Ориентация на олигомеры при нейродегенеративных расстройствах: уроки α-синуклеина, тау и амилоид-β пептида». Журнал болезни Альцгеймера. 24 Дополнение 2: 223–32. Дои:10.3233 / JAD-2011-110182. PMID 21460436.
- ^ Ито Д., Сузуки Н. (октябрь 2011 г.). «Объединенные патологические каскады, опосредованные ALS / FTLD-U связанными РНК-связывающими белками TDP-43 и FUS». Неврология. 77 (17): 1636–43. Дои:10.1212 / WNL.0b013e3182343365. ЧВК 3198978. PMID 21956718.
- ^ Волозин Б, Apicco D (2015). «РНК-связывающие белки и генез нейродегенеративных заболеваний». Достижения экспериментальной медицины и биологии. Успехи экспериментальной медицины и биологии. 822: 11–5. Дои:10.1007/978-3-319-08927-0_3. ISBN 978-3-319-08926-3. ЧВК 4694570. PMID 25416971.
- ^ а б c d Добсон CM (сентябрь 1999 г.). «Неправильная укладка белков, эволюция и болезни». Тенденции в биохимических науках. 24 (9): 329–32. Дои:10.1016 / S0968-0004 (99) 01445-0. PMID 10470028.
- ^ а б Джакер М, Walker LC (сентябрь 2013 г.). «Самораспространение патогенных белковых агрегатов при нейродегенеративных заболеваниях». Природа. 501 (7465): 45–51. Дои:10.1038 / природа12481. ЧВК 3963807. PMID 24005412.
- ^ Selkoe DJ (декабрь 2003 г.). «Фатальное сворачивание белков». Природа. 426 (6968): 900–4. Дои:10.1038 / природа02264. PMID 14685251.
- ^ Айзенберг Д, Джакер М (Март 2012 г.). «Амилоидный статус белков при заболеваниях человека». Ячейка. 148 (6): 1188–203. Дои:10.1016 / j.cell.2012.02.022. ЧВК 3353745. PMID 22424229.
- ^ Walker LC (ноябрь 2016 г.). «Протеопатические штаммы и гетерогенность нейродегенеративных заболеваний». Ежегодный обзор генетики. 50: 329–346. Дои:10.1146 / annurev-genet-120215-034943. ЧВК 6690197. PMID 27893962.
- ^ Коллиндж Дж., Кларк АР (ноябрь 2007 г.). «Общая модель штаммов прионов и их патогенности». Наука. 318 (5852): 930–6. Дои:10.1126 / science.1138718. PMID 17991853.
- ^ Колби Д.В., Прусинер С.Б. (сентябрь 2011 г.). «Создание de novo штаммов прионов». Обзоры природы. Микробиология. 9 (11): 771–7. Дои:10.1038 / nrmicro2650. ЧВК 3924856. PMID 21947062.
- ^ ДеКоски С.Т., Икономович М.Д., Ганди С. (сентябрь 2010 г.). «Черепно-мозговая травма - футбол, военные действия и отдаленные последствия». Медицинский журнал Новой Англии. 363 (14): 1293–6. Дои:10.1056 / NEJMp1007051. PMID 20879875.
- ^ McKee AC, Stein TD, Kiernan PT, Alvarez VE (май 2015 г.). «Невропатология хронической травматической энцефалопатии». Патология головного мозга. 25 (3): 350–64. Дои:10.1111 / bpa.12248. ЧВК 4526170. PMID 25904048.
- ^ Nelson PT, Alafuzoff I, Bigio EH, Bouras C, Braak H, Cairns NJ, Castellani RJ, Crain BJ, Davies P, Del Tredici K, Duyckaerts C, Frosch MP, Haroutunian V, Hof PR, Hulette CM, Hyman BT, Iwatsubo Т, Джеллингер К.А., Джича Г.А., Кёвари Э., Кукулл В.А., Леверенц Дж.Б., Лав С., Маккензи И.Р., Манн Д.М., Маслия Э., Макки А.С., Монтин Т.Дж., Моррис Дж.С., Шнайдер Дж. А., Соннен Дж. Troncoso JC, Wisniewski T, Woltjer RL, Beach TG (май 2012 г.). «Корреляция нейропатологических изменений болезни Альцгеймера с когнитивным статусом: обзор литературы». Журнал невропатологии и экспериментальной неврологии. 71 (5): 362–81. Дои:10.1097 / NEN.0b013e31825018f7. ЧВК 3560290. PMID 22487856.
- ^ Мрак Р. Э., Гриффин В. С. (2007). «Деменция с тельцами Леви: определение, диагностика и патогенетическая связь с болезнью Альцгеймера». Психоневрологические заболевания и лечение. 3 (5): 619–25. ЧВК 2656298. PMID 19300591.
- ^ Дуглас PM, Саммерс DW, Cyr DM (2009). «Молекулярные шапероны противодействуют протеотоксичности, дифференциально модулируя пути агрегации белков». Прион. 3 (2): 51–8. Дои:10.4161 / pri.3.2.8587. ЧВК 2712599. PMID 19421006.
- ^ Бреме М., Войзин С., Роллан Т., Вачи С., Сопер Дж. Х., Чжу Й., Ортон К., Виллелла А., Гарза Д., Видаль М., Ге Г., Моримото Р. И. (ноябрь 2014 г.). «Подсеть шапером защищает протеостаз при старении и нейродегенеративных заболеваниях». Отчеты по ячейкам. 9 (3): 1135–50. Дои:10.1016 / j.celrep.2014.09.042. ЧВК 4255334. PMID 25437566.
- ^ Brehme M, Voisine C (август 2016 г.). «Модельные системы заболеваний, связанных с неправильным сворачиванием белков, обнаруживают модификаторы протеотоксичности шаперонов». Модели и механизмы заболеваний. 9 (8): 823–38. Дои:10.1242 / дмм.024703. ЧВК 5007983. PMID 27491084.
- ^ Харди Дж (август 2005 г.). «Экспрессия патогенных белков с нормальной последовательностью при нейродегенеративном заболевании способствует увеличению риска заболевания:« разрешительный шаблон »как общий механизм, лежащий в основе нейродегенерации». Сделки биохимического общества. 33 (Pt 4): 578–81. Дои:10.1042 / BST0330578. PMID 16042548.
- ^ а б Уокер Л.С., Левин Х., Мэтсон МП, Джакер М (Август 2006 г.). «Индуцибельные протеопатии». Тенденции в неврологии. 29 (8): 438–43. Дои:10.1016 / j.tins.2006.06.010. PMID 16806508.
- ^ Прусинер С.Б. (май 2001 г.). «Лекция Шаттука - нейродегенеративные заболевания и прионы». Медицинский журнал Новой Англии. 344 (20): 1516–26. Дои:10.1056 / NEJM200105173442006. PMID 11357156.
- ^ Zou WQ, Gambetti P (апрель 2005 г.). «От микробов до прионов - окончательное доказательство гипотезы прионов». Ячейка. 121 (2): 155–7. Дои:10.1016 / j.cell.2005.04.002. PMID 15851020.
- ^ Ма Дж (2012). «Роль кофакторов в распространении прионов и инфекционности». PLoS Патогены. 8 (4): e1002589. Дои:10.1371 / journal.ppat.1002589. ЧВК 3325206. PMID 22511864.
- ^ Meyer-Luehmann M, Coomaraswamy J, Bolmont T., Kaeser S, Schaefer C., Kilger E, Neuenschwander A, Abramowski D, Frey P, Jaton AL, Vigouret JM, Paganetti P, Walsh DM, Mathews PM, Ghiso J, M, Staufen Уокер LC, Джакер М (Сентябрь 2006 г.). «Экзогенная индукция церебрального бета-амилоидогенеза регулируется агентом и хозяином». Наука. 313 (5794): 1781–4. Дои:10.1126 / science.1131864. PMID 16990547.
- ^ Клавагера Ф., Болмонт Т., Кроутер Р.А., Абрамовски Д., Франк С., Пробст А., Фрейзер Дж., Сталдер А.К., Бейбель М., Штауфенбиль М., Джакер М, Goedert M, Толнай М. (июль 2009). «Передача и распространение таупатии в мозге трансгенных мышей». Природа клеточной биологии. 11 (7): 909–13. Дои:10.1038 / ncb1901. ЧВК 2726961. PMID 19503072.
- ^ Desplats P, Lee HJ, Bae EJ, Patrick C, Rockenstein E, Crews L, Spencer B, Masliah E, Lee SJ (август 2009 г.). «Формирование включения и гибель нейронных клеток посредством передачи альфа-синуклеина от нейрона к нейрону». Труды Национальной академии наук Соединенных Штатов Америки. 106 (31): 13010–5. Дои:10.1073 / pnas.0903691106. ЧВК 2722313. PMID 19651612.
- ^ Хансен К., Ангот Э., Бергстрём А.Л., Штайнер Дж. А., Пиери Л., Пол Дж., Отейро Т.Ф., Мелки Р., Каллунки П., Фог К., Ли Дж. Ю., Брундин П. (февраль 2011 г.). «α-Синуклеин распространяется от мозга мыши к привитым дофаминергическим нейронам и агрегация семян в культивируемых клетках человека». Журнал клинических исследований. 121 (2): 715–25. Дои:10.1172 / JCI43366. ЧВК 3026723. PMID 21245577.
- ^ Кордауэр Дж. Х., Додия Х. Б., Кордауэр А. М., Терпстра Б., Помье К., Мадхаван Л., Сортвелл С., Стис-Коллиер К., Коллиер Т. Дж. (Сентябрь 2011 г.). «Перенос альфа-синуклеина, производного от хозяина, на трансплантированные дофаминергические нейроны у крысы». Нейробиология болезней. 43 (3): 552–7. Дои:10.1016 / j.nbd.2011.05.001. ЧВК 3430516. PMID 21600984.
- ^ Кордовер Дж. Х., Чу Й., Хаузер Р. А., Фриман ТБ, Оланов К. В. (май 2008 г.). «Патология, похожая на тельца Леви, при длительной трансплантации эмбрионального ниграла при болезни Паркинсона». Природа Медицина. 14 (5): 504–6. Дои:10,1038 / нм 1747. PMID 18391962.
- ^ Чиа Р., Таттум М. Х., Джонс С., Коллиндж Дж., Фишер Е. М., Джексон Г. С. (май 2010 г.). Фини МБ (ред.). «Супероксиддисмутаза 1 и tgSOD1 фибриллы семян спинного мозга мыши, предполагающие механизм размножения клеточной гибели при боковом амиотрофическом склерозе». PLOS One. 5 (5): e10627. Дои:10.1371 / journal.pone.0010627. ЧВК 2869360. PMID 20498711.
- ^ Мюнч К., О'Брайен Дж, Бертолотти А. (март 2011 г.). «Прионоподобное распространение неправильной укладки мутантной супероксиддисмутазы-1 в нейрональных клетках». Труды Национальной академии наук Соединенных Штатов Америки. 108 (9): 3548–53. Дои:10.1073 / pnas.1017275108. ЧВК 3048161. PMID 21321227.
- ^ Ren PH, Lauckner JE, Kachirskaia I, Heuser JE, Melki R, Kopito RR (февраль 2009 г.). «Проникновение в цитоплазму и стойкое инфицирование клеток млекопитающих агрегатами полиглутамина». Природа клеточной биологии. 11 (2): 219–25. Дои:10.1038 / ncb1830. ЧВК 2757079. PMID 19151706.
- ^ Пирс М.М., Копито Р.Р. (февраль 2018 г.). «Прионоподобные характеристики белков, содержащих полиглутамин». Перспективы Колд-Спринг-Харбор в медицине. 8 (2): a024257. Дои:10.1101 / cshperspect.a024257. ЧВК 5793740. PMID 28096245.
- ^ Фурукава Ю., Канеко К., Ватанабе С., Яманака К., Нукина Н. (май 2011 г.). «Реакция посева повторяет внутриклеточное образование включений нерастворимого в саркозиле трансактивационного элемента ответа (TAR) ДНК-связывающего белка-43». Журнал биологической химии. 286 (21): 18664–72. Дои:10.1074 / jbc.M111.231209. ЧВК 3099683. PMID 21454603.
- ^ Lundmark K, Westermark GT, Olsén A, Westermark P (апрель 2005 г.). «Белковые фибриллы в природе могут усиливать амилоидоз амилоидного протеина А у мышей: перекрестный посев как механизм заболевания». Труды Национальной академии наук Соединенных Штатов Америки. 102 (17): 6098–102. Дои:10.1073 / pnas.0501814102. ЧВК 1087940. PMID 15829582.
- ^ Фу Х, Коренага Т, Фу Л, Син И, Го З, Мацусита Т, Хосокава М, Наики Х, Баба С., Кавата И, Икеда С., Исихара Т, Мори М., Хигучи К. (апрель 2004 г.). «Индукция амилоидоза AApoAII различными гетерогенными амилоидными фибриллами». Письма FEBS. 563 (1–3): 179–84. Дои:10.1016 / S0014-5793 (04) 00295-9. PMID 15063745.
- ^ Bolmont T, Clavaguera F, Meyer-Luehmann M, Herzig MC, Radde R, Staufenbiel M, Lewis J, Hutton M, Tolnay M, Джакер М (Декабрь 2007 г.). «Вызвание патологии тау путем внутримозгового вливания экстракта мозга, содержащего бета-амилоид, и путем отложения бета-амилоида у трансгенных мышей APP x Tau». Американский журнал патологии. 171 (6): 2012–20. Дои:10.2353 / ajpath.2007.070403. ЧВК 2111123. PMID 18055549.
- ^ Моралес Р., Эстрада Л.Д., Диас-Эспиноза Р., Моралес-Шейхинг Д., Хара М.С., Кастилья Дж., Сото С. (март 2010 г.). «Молекулярная перекрестная связь между неправильно свернутыми белками в животных моделях болезни Альцгеймера и прионных заболеваний». Журнал неврологии. 30 (13): 4528–35. Дои:10.1523 / JNEUROSCI.5924-09.2010. ЧВК 2859074. PMID 20357103.
- ^ а б c d Ревес Т., Гизо Дж., Лэшли Т., Плант G, Ростаньо А., Франджоне Б., Холтон Дж. Л. (сентябрь 2003 г.). «Церебральные амилоидные ангиопатии: патологический, биохимический и генетический взгляд». Журнал невропатологии и экспериментальной неврологии. 62 (9): 885–98. Дои:10.1093 / jnen / 62.9.885. PMID 14533778.
- ^ Guo L, Salt TE, Luong V, Wood N, Cheung W., Maass A, Ferrari G, Russo-Marie F, Sillito AM, Cheetham ME, Moss SE, Fitzke FW, Cordeiro MF (август 2007 г.). «Ориентация на бета-амилоид в лечении глаукомы». Труды Национальной академии наук Соединенных Штатов Америки. 104 (33): 13444–9. Дои:10.1073 / pnas.0703707104. ЧВК 1940230. PMID 17684098.
- ^ Прусинер, С.Б. (2004). Прионная биология и болезни (2-е изд.). Колд-Спринг-Харбор, Нью-Йорк: Лаборатория Колд-Спринг-Харбор. ISBN 0-87969-693-1.
- ^ Goedert M, Spillantini MG, Del Tredici K, Braak H (январь 2013 г.). «100 лет патологии Леви». Обзоры природы. Неврология. 9 (1): 13–24. Дои:10.1038 / nrneurol.2012.242. PMID 23183883.
- ^ Клавагера Ф, Хенч Дж, Goedert M, Толнай М. (февраль 2015). «Приглашенный обзор: прионоподобная передача и распространение тау-патологии». Невропатология и прикладная нейробиология. 41 (1): 47–58. Дои:10.1111 / нан.12197. PMID 25399729.
- ^ а б Манн Д.М., Сноуден Дж.С. (ноябрь 2017 г.). «Лобно-височная долевая дегенерация: патогенез, патология и пути к фенотипу». Патология головного мозга. 27 (6): 723–736. Дои:10.1111 / bpa.12486. PMID 28100023.
- ^ Град Л.И., Фернандо С.М., Кашман Н.Р. (май 2015 г.). «От молекулы к молекуле и от клетки к клетке: прионоподобные механизмы при боковом амиотрофическом склерозе». Нейробиология болезней. 77: 257–65. Дои:10.1016 / j.nbd.2015.02.009. PMID 25701498.
- ^ Ludolph AC, Brettschneider J, Weishaupt JH (октябрь 2012 г.). "Боковой амиотрофический склероз". Текущее мнение в неврологии. 25 (5): 530–5. Дои:10.1097 / WCO.0b013e328356d328. PMID 22918486.
- ^ Orr HT, Zoghbi HY (июль 2007 г.). «Расстройства тринуклеотидных повторов». Ежегодный обзор нейробиологии. 30 (1): 575–621. Дои:10.1146 / annurev.neuro.29.051605.113042. PMID 17417937.
- ^ Алмейда Б., Фернандес С., Абреу И.А., Маседо-Рибейро С. (2013). «Тринуклеотидные повторы: структурная перспектива». Границы неврологии. 4: 76. Дои:10.3389 / fneur.2013.00076. ЧВК 3687200. PMID 23801983.
- ^ Spinner NB (март 2000 г.). «КАДАСИЛ: дефект передачи сигналов Notch или проблема с накоплением белка?». Журнал клинических исследований. 105 (5): 561–2. Дои:10.1172 / JCI9511. ЧВК 292459. PMID 10712425.
- ^ Куинлан Р.А., Бреннер М., Голдман Дж. Э., Мессинг А. (июнь 2007 г.). «GFAP и его роль в болезни Александра». Экспериментальные исследования клеток. 313 (10): 2077–87. Дои:10.1016 / j.yexcr.2007.04.004. ЧВК 2702672. PMID 17498694.
- ^ Ито Д., Сузуки Н. (январь 2009 г.). «Сейпинопатия: новое заболевание, связанное со стрессом эндоплазматического ретикулума». Мозг. 132 (Pt 1): 8–15. Дои:10.1093 / мозг / awn216. PMID 18790819.
- ^ а б c d е ж г час я j k л м п о п q р s т ты v ш Икс y z аа Сайпе Дж. Д., Бенсон, доктор медицины, Буксбаум, Дж. Н., Икеда С. И., Мерлини Дж., Сараива М. Дж., Вестермарк П. (декабрь 2016 г.). «Белки амилоидных фибрилл и амилоидоз: химическая идентификация и клиническая классификация. Руководство по номенклатуре Международного общества амилоидоза, 2016 г.». Амилоид. 23 (4): 209–213. Дои:10.1080/13506129.2016.1257986. PMID 27884064.
- ^ Ломас Д.А., Каррелл Р.В. (октябрь 2002 г.). «Серпинопатии и конформационные деменции». Природа Обзоры Генетика. 3 (10): 759–68. Дои:10.1038 / nrg907. PMID 12360234.
- ^ Мукерджи А., Сото С. (май 2017 г.). «Прионоподобные белковые агрегаты и диабет 2 типа». Перспективы Колд-Спринг-Харбор в медицине. 7 (5): a024315. Дои:10.1101 / cshperspect.a024315. ЧВК 5411686. PMID 28159831.
- ^ Асканас В., Энгель В.К. (январь 2006 г.). «Миозит с включенными тельцами: миодегенеративное конформационное расстройство, связанное с Abeta, неправильным сворачиванием белков и ингибированием протеасом». Неврология. 66 (2 Прил.1): S39-48. Дои:10.1212 / 01.wnl.0000192128.13875.1e. PMID 16432144.
- ^ Ecroyd H, Carver JA (январь 2009 г.). «Кристаллиновые белки и амилоидные фибриллы». Клеточные и молекулярные науки о жизни. 66 (1): 62–81. Дои:10.1007 / s00018-008-8327-4. PMID 18810322.
- ^ Сургучев А, Сургучов А (январь 2010). «Конформационные заболевания: взгляд в глаза». Бюллетень исследований мозга. 81 (1): 12–24. Дои:10.1016 / j.brainresbull.2009.09.015. PMID 19808079.
- ^ Huilgol SC, Ramnarain N, Carrington P, Leigh IM, Black MM (май 1998 г.). «Цитокератины при первичном кожном амилоидозе». Австралазийский журнал дерматологии. 39 (2): 81–5. Дои:10.1111 / j.1440-0960.1998.tb01253.x. PMID 9611375.
- ^ Яниг Э., Штумптнер С., Фуксбихлер А., Денк Х., Затлукал К. (март 2005 г.). «Взаимодействие стрессовых белков с неправильно свернутыми кератинами». Европейский журнал клеточной биологии. 84 (2–3): 329–39. Дои:10.1016 / j.ejcb.2004.12.018. PMID 15819411.
- ^ Д'Суза А., Тайс Дж. Д., Врана Дж. А., Доган А. (июнь 2014 г.). «Фармацевтический амилоидоз, связанный с подкожным введением инсулина и энфувиртида». Амилоид. 21 (2): 71–5. Дои:10.3109/13506129.2013.876984. ЧВК 4021035. PMID 24446896.
- ^ Мэн Х, Клубок Дж., Каргас В., Ван Х, Ford RC (январь 2017 г.). «Регулятор трансмембранной проводимости при муковисцидозе (CFTR) и его стабильность». Клеточные и молекулярные науки о жизни. 74 (1): 23–38. Дои:10.1007 / s00018-016-2386-8. ЧВК 5209436. PMID 27734094.
- ^ Стюарт MJ, Нагель RL (2004). "Серповидноклеточная анемия". Ланцет. 364 (9442): 1343–60. Дои:10.1016 / S0140-6736 (04) 17192-4. PMID 15474138.
- ^ а б c Пепис МБ (2006). "Амилоидоз". Анну Рев Мед. 57: 223–241. Дои:10.1146 / annurev.med.57.121304.131243. PMID 16409147.
- ^ а б Хольцман Д.М., Моррис Дж. К., Козел А. М. (2011). «Болезнь Альцгеймера: вызов второго века». Sci Transl Med. 3 (77): 77ср1. Дои:10.1126 / scitranslmed.3002369. ЧВК 3130546. PMID 21471435.
- ^ Пепис МБ (2001). «Патогенез, диагностика и лечение системного амилоидоза». Фил Транс Р Соц Лондон Б. 356: 203–211. Дои:10.1098 / rstb.2000.0766. ЧВК 1088426. PMID 11260801.
- ^ Уокер LC, LeVine H 3rd (2002). «Протеопатия: следующий терапевтический рубеж?». Curr Opin исследует наркотики. 3 (5): 782–7. PMID 12090553.
- ^ Брачинский А.К., Шульц Дж. Б., Бах Дж. П. (2017). «Стратегии вакцинации при таупатиях и синуклеинопатиях». J Neurochem. 143 (5): 467–488. Дои:10.1111 / jnc.14207. PMID 28869766.
- ^ Кляйн WL (2013). «Синаптотоксические олигомеры амилоида-β: молекулярная основа причины, диагностики и лечения болезни Альцгеймера?». J Alzheimers Dis. 33 (Приложение 1): S49-65. Дои:10.3233 / JAD-2012-129039. PMID 22785404.
- ^ а б c Бадар Т., Д'Суза А., Хари П. (2018). «Последние достижения в понимании и лечении амилоидоза легкой цепи иммуноглобулина». F1000Res. 7: 1348. Дои:10.12688 / f1000research.15353.1. ЧВК 6117860. PMID 30228867.
- ^ Карвалью А., Роша А., Лобато Л. (2015). «Трансплантация печени при транстиретиновом амилоидозе: проблемы и проблемы». Трансплантация печени. 21 (3): 282–292. Дои:10.1002 / lt.24058. PMID 25482846.
- ^ Suhr OB, Herlenius G, Friman S, Ericzon BG (2000). «Трансплантация печени при наследственном транстиретиновом амилоидозе». Трансплантация печени. 6 (3): 263–276. Дои:10.1053 / lv.2000.6145. PMID 10827225.
- ^ а б Suhr OB, Larsson M, Ericzon BG, Wilczek HE, et al. (2016). «Выживаемость после трансплантации у пациентов с мутациями, отличными от Val30Met: Выписки из Всемирного реестра трансплантатов FAP». Трансплантация. 100 (2): 373–381. Дои:10.1097 / TP.0000000000001021. ЧВК 4732012. PMID 26656838.
- ^ Коэльо Т. и др. (2016). «Механизм действия и клиническое применение тафамида при наследственном транстиретиновом амилоидозе». Neurol Ther. 5 (1): 1–25. Дои:10.1007 / s40120-016-0040-х. ЧВК 4919130. PMID 26894299.
- ^ Ю.Д. и др. (2012). «Одноцепочечные РНК используют РНКи для сильного и аллель-селективного подавления экспрессии мутантного хантингтина». Ячейка. 150 (5): 895–908. Дои:10.1016 / j.cell.2012.08.002. ЧВК 3444165. PMID 22939619.
- ^ Nuvolone M, Merlini G (2017). «Новые терапевтические цели, которые в настоящее время исследуются для лечения системного амилоидоза». Экспертное мнение Ther Target. 21 (12): 1095–1110. Дои:10.1080/14728222.2017.1398235. PMID 29076382.
- ^ Джозеф NS, Кауфман JL (2018). «Новые подходы к лечению амилоидоза AL». Curr Hematol Malig Rep. 13 (3): 212–219. Дои:10.1007 / s11899-018-0450-1. PMID 29951831.
