WikiDer > Лизоцим
| Лизоцим | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Кристаллы лизоцима, окрашенные метиленовый синий. | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 3.2.1.17 | ||||||||
| Количество CAS | 9001-63-2 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
Лизоцим, также известная как мурамидаза или N-ацетилмурамидгликангидролаза, является противомикробный фермент, производимый животными, который является частью врожденная иммунная система. Лизоцим - это гликозид гидролаза что катализирует гидролиз 1,4-бета-связей между N-ацетилмурамовая кислота и N-ацетил-D-глюкозамин остатки в пептидогликан, который является основным компонентом грамположительные бактерии клеточная стенка.[1] Этот гидролиз, в свою очередь, нарушает целостность стенок бактериальных клеток, вызывая лизис бактерий.
Лизоцим богат выделения включая слезы, слюна, грудное молоко, и слизь. Он также присутствует в цитоплазматический гранулы макрофаги и полиморфноядерные нейтрофилы (PMN). Большое количество лизоцима содержится в Яичный белок. Лизоцимы С-типа тесно связаны с альфа-лактальбумин в последовательности и структуре, что делает их частью одного и того же семейство гликозидгидролаз 22.[2] У человека фермент лизоцима С-типа кодируется LYZ ген.[3][4]
Лизоцим куриного яичного белка термостабилен, температура плавления достигая 72 ° C при pH 5,0.[5] Однако лизоцим грудного молока очень быстро теряет активность при такой температуре.[6] Лизоцим куриного яичного белка сохраняет свою активность в широком диапазоне pH (6-9).[7] Его изоэлектрическая точка составляет 11,35.[8] Изоэлектрическая точка лизоцима грудного молока составляет 10,5-11.[9]
Функция и механизм
В фермент функционирует путем атаки, гидролиза и разрыва гликозидных связей в пептидогликаны. Фермент также может нарушить гликозидные связи в хитин, хотя и не так эффективно, как правда хитиназы.[10]
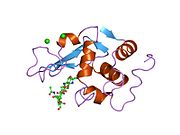
Активный сайт лизоцимов связывает пептидогликан молекула в заметной щели между двумя ее доменами. Он атакует пептидогликаны (обнаруженные в клеточных стенках бактерий, особенно Грамположительные бактерии), его естественный субстрат, между N-ацетилмурамовая кислота (NAM) и четвертый атом углерода N-ацетилглюкозамин (НАГ).
Короче сахариды как и тетрасахарид, также оказались жизнеспособными субстратами, но через промежуточное соединение с более длинной цепью.[11] Также было показано, что хитин является жизнеспособным субстратом лизоцима. Искусственные субстраты также были разработаны и используются в лизоциме.[12]
Механизм
Филлипс
Механизм Филлипса предполагал, что каталитическая сила фермента проистекает как из стерической нагрузки на связанный субстрат, так и за счет электростатической стабилизации оксо-карбений средний. На основе данных рентгеновской кристаллографии Филлипс предложил активный центр фермента, где связывается гексасахарид. Лизоцим искажает четвертый сахар (в субсайте D или -1) в гексасахариде в конформацию полукресла. В этом напряженном состоянии гликозидная связь легче разрывается.[13] Ионный интермедиат, содержащий оксо-карбений создается в результате разрыва гликозидной связи.[14] Таким образом, искажение, заставляющее молекулу субстрата принимать напряженную конформацию, аналогичную конформации переходного состояния, снижает энергетический барьер реакции.[15]
Предполагалось, что предложенный оксокарбониевый интермедиат электростатически стабилизируется остатками аспартата и глутамата в активном центре за счет Арие Варшел в 1978 г. Аргумент электростатической стабилизации был основан на сравнении с объемной водой, переориентация диполей воды может компенсировать стабилизирующую энергию зарядового взаимодействия. В модели Варшела фермент действует как суперрастворитель, который фиксирует ориентацию ионных пар и обеспечивает супер-сольватация (очень хорошая стабилизация ионных пар), и особенно понижают энергию, когда ионы находятся близко друг к другу.[16]
В этап определения ставки(RDS) в этом механизме связана с образованием оксо-карбений средний. Получены противоречивые результаты, указывающие на точное значение RDS. Отслеживая формирование продукта (п-нитрофенол), было обнаружено, что RDS может изменяться при разных температурах, что и явилось причиной этих противоречивых результатов. При более высокой температуре RDS представляет собой образование промежуточного гликозильного фермента, а при более низкой температуре - разрушение этого промежуточного продукта.[17]

Кошланд
В ходе ранних дебатов в 1969 году Дальквист предложил ковалентный механизм для лизоцима, основанный на кинетический изотопный эффект,[19] но долгое время более распространенным был ионный механизм. В 2001 году Vocadlo предложил пересмотренный механизм через ковалентный, но не ионный промежуточный продукт. Свидетельства из ESI-РС анализ показал ковалентный промежуточный продукт. 2-фторзамещенный субстрат использовали для снижения скорости реакции и накопления промежуточного продукта для характеристики.[20] Было обнаружено, что боковые аминокислоты глутаминовой кислоты 35 (Glu35) и аспартата 52 (Asp52) имеют решающее значение для активности этого фермента. Glu35 действует как донор протонов гликозидной связи, расщепляя связь C-O в субстрате, тогда как Asp52 действует как нуклеофил для образования промежуточного гликозильного фермента. Glu35 реагирует с водой с образованием гидроксил-иона, более сильного нуклеофил чем вода, которая затем атакует промежуточный гликозильный фермент, давая продукт гидролиза и оставляя фермент неизменным.[21] Этот ковалентный механизм был назван в честь Кошланд, который первым предложил этот тип механизма.[22]
Совсем недавно квантовая механика / молекулярная механика (QM / MM) молекулярная динамика моделирования были с использованием кристалла HEWL и предсказывают существование ковалентного промежуточного продукта.[23] Доказательства ESI-MS и рентгеновских структур указывают на существование ковалентного промежуточного соединения, но в первую очередь полагаются на использование менее активного мутанта или ненативного субстрата. Таким образом, молекулярная динамика QM / MM обеспечивает уникальную возможность непосредственно исследовать механизм HEWL дикого типа и нативного субстрата. Расчеты показали, что ковалентный интермедиат по механизму Кошланда на ~ 30 ккал / моль более стабилен, чем ионный интермедиат по механизму Филлипса.[23] Эти расчеты демонстрируют, что ионный промежуточный продукт является чрезвычайно энергетически невыгодным, а ковалентные промежуточные продукты, наблюдаемые в экспериментах с использованием менее активных мутантных или ненативных субстратов, обеспечивают полезное понимание механизма HEWL дикого типа.
Торможение
Имидазол производные могут образовывать зарядно-переносной комплекс с некоторыми остатками (в активном центре или за его пределами) для достижения конкурентного ингибирования лизоцима.[24] В Грамотрицательные бактерии, то липополисахарид действует как неконкурентный ингибитор за счет высокоэффективного связывания с лизоцимом.[25]
Неферментативное действие
Несмотря на то, что мурамидазная активность лизоцима, как предполагается, играет ключевую роль в его антибактериальных свойствах, также сообщалось о его неферментативном действии. Например, блокирование каталитической активности лизоцима путем мутации критической аминокислоты в активном центре (52-Жерех -> 52-Сер) не устраняет его антимикробную активность.[26] О лектин-подобной способности лизоцима распознавать бактериальный углеводный антиген без литической активности сообщалось для тетрасахарида, относящегося к липополисахарид из Клебсиелла пневмонии.[27] Также лизоцим взаимодействует с антителами и Рецепторы Т-клеток.[28]
Изменения конформации фермента
Лизоцим имеет две конформации: открытое активное состояние и закрытое неактивное состояние. Каталитическая значимость была исследована с помощью одностенных углеродные нанотрубки (SWCN) полевые транзисторы (FET), в которых единственный лизоцим был связан с SWCN FET.[29] Электронный мониторинг лизоцима показал две конформации: открытый активный сайт и закрытый неактивный сайт. В активном состоянии лизоцим способен процессивно гидролизовать субстрат, разрывая в среднем 100 связей со скоростью 15 в секунду. Для связывания нового субстрата и перехода из закрытого неактивного состояния в открытое активное состояние требуется два ступенчатых изменения конформации, а для инактивации требуется один этап.
Роль в болезни и терапии
| семейство лизоцимов | |||||||
|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||
| Псевдонимы | Glyco_hydro_22_lysIPR000974лизоцим, лизоцим, 1,4-N-ацетилмурамидаза, дельвозим, глобулин G1, лидиум-KLP, мукопептид, глюкогидролаза, мурамидаза, N, O-диацетилмурамидаза, пептидогидролимурамидаза, пептидогидролимурамидаза, пептидогидолимурамидаза, ацетил-ацетил-ацетил-ацетил-ацетил-ацетил-ацетил-ацетил-ацетил-ацетил-ацетил-ацетил-ацетил-ацетил-ацетил-ацетил-ацетилмурамидаза. | ||||||
| Внешние идентификаторы | Генные карты: [1] | ||||||
| Ортологи | |||||||
| Разновидность | Человек | Мышь | |||||
| Entrez |
|
| |||||
| Ансамбль |
|
| |||||
| UniProt |
|
| |||||
| RefSeq (мРНК) |
|
| |||||
| RefSeq (белок) |
|
| |||||
| Расположение (UCSC) | н / д | н / д | |||||
| PubMed поиск | н / д | н / д | |||||
| Викиданные | |||||||
| |||||||
Лизоцим является частью врожденной иммунной системы. Снижение уровня лизоцима было связано с бронхолегочная дисплазия у новорожденных.[30] Поросята, которых кормили молоком с лизоцимом человека, могут вылечиться от диарейного заболевания, вызванного: Кишечная палочка Быстрее. Концентрация лизоцима в материнском молоке в 1600–3000 раз превышает концентрацию в молоке домашнего скота. Лизоцим человека более активен, чем лизоцим белка куриного яйца. А трансгенный линия коз (с основатель под названием «Артемида») были разработаны для производства молока с человеческим лизоцимом для защиты детей от диареи, если они не могут получить преимущества грудного вскармливания человека.[31][32]
Поскольку лизоцим является естественной формой защиты от Грамположительный патогены как Бациллы и Стрептококк,[33] он играет важную роль в иммунологии грудных детей при вскармливании грудным молоком.[34] В то время как кожа является защитным барьером из-за ее сухости и кислотности, конъюнктива (мембрана, покрывающая глаз) вместо этого защищена секретируемыми ферментами, в основном лизоцимом и дефенсин. Однако, когда эти защитные барьеры выходят из строя, конъюнктивит полученные результаты.
При некоторых формах рака (особенно при миеломоноцитарном лейкозе) чрезмерное производство лизоцима раковыми клетками может привести к токсическому уровню лизоцима в крови. Высокий уровень лизоцима в крови может привести к почечной недостаточности и низкому уровню калия в крови - состояниям, которые могут улучшиться или исчезнуть при лечении первичного злокачественного новообразования.
Лизоцим сыворотки гораздо менее специфичен для диагностики саркоидоза, чем сывороточный ангиотензин-превращающий фермент; однако, поскольку он более чувствителен, он используется как маркер активности болезни саркоидоза и подходит для мониторинга болезни в доказанных случаях.[35]
Химический синтез
Первый химический синтез лизоцимного протеина был предпринят профессором Джорджем Кеннером и его группой в Ливерпульском университете в Англии.[36] Это было наконец достигнуто в 2007 году Томасом Дуреком в лаборатории Стива Кента в Чикагском университете, который создал синтетическую функциональную молекулу лизоцима.[37]
Другие приложения
Кристаллы лизоцима использовались для выращивания других функциональных материалов для катализа и биомедицинских приложений.[38][39][40] Лизоцим - это обычно используемый фермент для лизирования грамположительных бактерий.[41] Благодаря уникальной функции лизоцима он может переваривать клеточную стенку и вызывать осмотический шок (взорвать ячейку, внезапно изменив концентрацию растворенного вещества вокруг ячейки и, таким образом, осмотическое давление), лизоцим обычно используется в лабораторных условиях для высвобождения белков из бактерий. периплазма в то время как внутренняя мембрана остается закрытой в виде пузырьков, называемых сферопласт.[42][43]
Например, Кишечная палочка можно лизировать с использованием лизоцима, чтобы высвободить содержимое периплазматический Космос. Это особенно полезно в лабораторных условиях при попытке собрать содержимое периплазмы.[1] Обработка лизоцимом оптимальна при определенных температурах, диапазонах pH и концентрациях солей. Активность лизоцима увеличивается с повышением температуры, до 60 градусов Цельсия, с диапазоном pH 6,0-7,0. Присутствующие соли также влияют на обработку лизоцимом, при этом некоторые заявляют об ингибирующем действии, а другие способствуют лизису посредством обработки лизоцимом. Хлорид натрия вызывает лизис, но при высоких концентрациях он является активным ингибитором лизиса. Аналогичные наблюдения были замечены при использовании солей калия. Имеются незначительные вариации из-за различий в штаммах бактерий.[44]
История
Антибактериальные свойства белка куриного яйца благодаря содержащемуся в нем лизоциму впервые были обнаружены Лащенко в 1909 г.[45] Убивающая бактерии активность слизистой носа была продемонстрирована в 1922 г. Александр Флеминг, первооткрыватель пенициллин, который ввел термин лизоцим.[46] Флеминг сообщил, говоря. «Поскольку это вещество имеет свойства, схожие со свойствами ферментов, я назвал его« лизоцимом »».[47] Далее Флеминг показал, что ферментное вещество присутствует в большом количестве секретов и способно быстро лизировать (то есть растворять) различные бактерии, в частности желтый «кокк», который он изучал ».[48]
Лизоцим был впервые кристаллизован Эдвард Абрахам в 1937 году, что позволило описать трехмерную структуру лизоцима белка куриного яйца Дэвид Чилтон Филлипс в 1965 году, когда он получил первые 2-ангстрем (200 вечера) модель разрешения через Рентгеновская кристаллография.[49][50] Структура была публично представлена на Королевский институт лекция 1965 г.[51]Лизоцим был второй структурой белка и первой структурой фермента, которую нужно было решить с помощью методов дифракции рентгеновских лучей, и первым полностью секвенированным ферментом, который содержит все двадцать распространенных аминокислот.[52]В результате выяснения структуры лизоцима Филлипсом это был также первый фермент, у которого был предложен подробный специфический механизм его каталитического действия.[53][54][55] Эта работа подтолкнула Филлипса к объяснению того, как ферменты ускорять химическую реакцию с точки зрения ее физических структур. Оригинальный механизм, предложенный Филлипсом, был недавно переработан.[20]
Смотрите также
Рекомендации
- ^ а б Манченко Г.П. (1994). «Лизоцим». Справочник по обнаружению ферментов на электрофоретических гелях. Бока-Ратон, Флорида: CRC Press. п.223. ISBN 978-0-8493-8935-1.
- ^ Уильямс С., Вокадло Д. «Семейство гликозидгидролаз 22». Казипедия. Получено 11 апреля 2017.
- ^ Йошимура К., Тойбана А., Накахама К. (январь 1988 г.). «Лизоцим человека: секвенирование кДНК, экспрессия и секреция Saccharomyces cerevisiae». Сообщения о биохимических и биофизических исследованиях. 150 (2): 794–801. Дои:10.1016 / 0006-291X (88) 90461-5. PMID 2829884.
- ^ Петерс К.В., Круз У., Поллвейн Р., Гжещик К.Х., Сиппель А.Е. (июль 1989 г.). «Ген лизоцима человека. Последовательность организации и хромосомная локализация». Европейский журнал биохимии. 182 (3): 507–16. Дои:10.1111 / j.1432-1033.1989.tb14857.x. PMID 2546758.
- ^ Venkataramani S, Truntzer J, Coleman DR (апрель 2013 г.). «Термическая стабильность лизоцима высокой концентрации при различных значениях pH: инфракрасное исследование с преобразованием Фурье». Журнал фармации и биологических наук. 5 (2): 148–53. Дои:10.4103/0975-7406.111821. ЧВК 3697194. PMID 23833521.
- ^ Чандан Р.К., Шахани К.М., Холли Р.Г. (октябрь 1964 г.). «Содержание лизоцима в человеческом молоке». Природа. 204 (4953): 76–7. Bibcode:1964Натура.204 ... 76С. Дои:10.1038 / 204076a0. PMID 14240122. S2CID 4215401.
- ^ «Лизоцим, информация о продукте» (PDF). Сигма-Олдрич.
- ^ «Лизоцим, информация о продукте» (PDF). Сигма-Олдрич.
- ^ Парри-младший RM, Чандан Р.С., Шахани К.М. (1969). «Выделение и характеристика лизоцима грудного молока». Arch Biochem Biophysics. 103 (1): 59–65. Дои:10.1016/0003-9861(69)90009-5. PMID 5778672.CS1 maint: использует параметр авторов (связь)
- ^ Skujiņś J, Puķite A, McLaren AD (декабрь 1973 г.). «Адсорбция и реакции хитиназы и лизоцима на хитине». Молекулярная и клеточная биохимия. 2 (2): 221–8. Дои:10.1007 / BF01795475. PMID 4359167. S2CID 27906558.
- ^ Шэрон Н. (апрель 1967). «Химическая структура субстратов лизоцима и их расщепление ферментом». Труды Лондонского королевского общества. Серия B, Биологические науки. 167 (1009): 402–15. Bibcode:1967RSPSB.167..402S. Дои:10.1098 / rspb.1967.0037. PMID 4382803. S2CID 31794497.
- ^ Höltje JV (1 января 1996 г.). «Субстраты лизоцима». Exs. Experientia Supplementum. 75: 105–10. Дои:10.1007/978-3-0348-9225-4_7. ISBN 978-3-0348-9952-9. PMID 8765297.
- ^ Блейк С.К., Джонсон Л.Н., Майр Г.А., Северный АС, Филлипс, округ Колумбия, Сарма В.Р. (апрель 1967). «Кристаллографические исследования активности лизоцима белка куриного яйца». Труды Лондонского королевского общества. Серия B, Биологические науки. 167 (1009): 378–88. Bibcode:1967RSPSB.167..378B. Дои:10.1098 / rspb.1967.0035. PMID 4382801. S2CID 35094695.
- ^ Далквист Ф.В., Ранд-Меир Т., Рафтери М.А. (октябрь 1969 г.). «Применение вторичных кинетических изотопных эффектов альфа-дейтерия для изучения ферментативного катализа. Гидролиз гликозидов лизоцимом и бета-глюкозидазой». Биохимия. 8 (10): 4214–21. Дои:10.1021 / bi00838a045. PMID 5388150.
- ^ Маккензи HA, Белый FH (1991). «Лизоцим и альфа-лактальбумин: структура, функции и взаимосвязь». Достижения в химии белков. 41: 173–315. Дои:10.1016 / s0065-3233 (08) 60198-9. ISBN 9780120342419. PMID 2069076.
- ^ Варшел А (ноябрь 1978 г.). «Энергетика ферментного катализа». Труды Национальной академии наук Соединенных Штатов Америки. 75 (11): 5250–4. Bibcode:1978PNAS ... 75,5 250 Вт. Дои:10.1073 / пнас.75.11.5250. ЧВК 392938. PMID 281676.
- ^ Вебер Дж. П., Финк А. Л. (октябрь 1980 г.). «Температурно-зависимое изменение лимитирующей стадии катализа бета-глюкозидазы». Журнал биологической химии. 255 (19): 9030–2. PMID 6773958.
- ^ http://proteopedia.org/wiki/index.php/Lysozyme#Covalent_intermediate_and_product_complex
- ^ Далквист Ф.В., Ранд-Меир Т., Рафтери М.А. (октябрь 1969 г.). «Применение вторичных кинетических изотопных эффектов альфа-дейтерия для изучения ферментативного катализа. Гидролиз гликозидов лизоцимом и бета-глюкозидазой». Биохимия. 8 (10): 4214–21. Дои:10.1021 / bi00838a045. PMID 5388150.
- ^ а б Vocadlo DJ, Davies GJ, Laine R, Withers SG (август 2001 г.). «Катализ лизоцимом куриного яичного белка протекает через ковалентный промежуточный продукт» (PDF). Природа. 412 (6849): 835–8. Bibcode:2001Натура.412..835В. Дои:10.1038/35090602. PMID 11518970. S2CID 205020153.
- ^ Гришем CM, Гарретт Р.Х. (2007). «Глава 14: Механизм действия ферментов». Биохимия. Австралия: Томсон Брукс / Коул. С. 467–9. ISBN 978-0-495-11912-8.
- ^ Кошланд Д.Е. (ноябрь 1953 г.). «Стереохимия и механизм ферментативных реакций». Биологические обзоры. 28 (4): 416–436. Дои:10.1111 / j.1469-185X.1953.tb01386.x. S2CID 86709302.
- ^ а б Боуман А.Л., Грант И.М., Малхолланд А.Дж. (октябрь 2008 г.). «Моделирование QM / MM предсказывает ковалентный промежуточный продукт в реакции лизоцима куриного яичного белка с его естественным субстратом». Химические коммуникации (37): 4425–7. Дои:10.1039 / b810099c. PMID 18802578.
- ^ Лебединое удостоверение (март 1972 г.). «Ингибирование лизоцима куриного яйца имидазолом и производными индола». Журнал молекулярной биологии. 65 (1): 59–62. Дои:10.1016/0022-2836(72)90491-3. PMID 5063023.
- ^ Оно Н, Моррисон, округ Колумбия (март 1989 г.). «Взаимодействие липополисахарида с лизоцимом. Связывание липополисахарида с лизоцимом и ингибирование ферментативной активности лизоцима». Журнал биологической химии. 264 (8): 4434–41. PMID 2647736.
- ^ Ибрагим Х.Р., Мацузаки Т., Аоки Т. (2001). «Генетические доказательства того, что антибактериальная активность лизоцима не зависит от его каталитической функции». Письма FEBS. 506 (1): 27–32. Дои:10.1016 / S0014-5793 (01) 02872-1. PMID 11591365. S2CID 21593262.
- ^ Чжан Р., Ву Л., Экерт Т., Бург-Родерфельд М., Рохас-Масиас М.А., Люттеке Т. (2017). «Лектиноподобные свойства лизоцима способствуют его функции иммунной защиты». Ежеквартальные обзоры биофизики. 50: e9. Дои:10.1017 / S0033583517000075. PMID 29233221.
- ^ Гривел Дж. К., Смит-Гилл С. Дж. (1996). Лизоцим: антигенная структура, определяемая по ответам антител и Т-клеток.. CRC Press. С. 91–144. ISBN 978-0-8493-9225-2.
- ^ Чой Ю., Moody IS, Sims PC, Hunt SR, Corso BL, Perez I, Weiss GA, Collins PG (январь 2012 г.). "Динамика одномолекулярного лизоцима, контролируемая электронной схемой". Наука. 335 (6066): 319–24. Bibcode:2012Sci ... 335..319C. Дои:10.1126 / science.1214824. ЧВК 3914775. PMID 22267809.
- ^ Ревенис М.Е., Калинер М.А. (август 1992 г.). «Дефицит лактоферрина и лизоцима в секрете дыхательных путей: связь с развитием бронхолегочной дисплазии». Журнал педиатрии. 121 (2): 262–70. Дои:10.1016 / S0022-3476 (05) 81201-6. PMID 1640295.
- ^ Купер CA, Гарас Клобас LC, Мага EA, Мюррей JD (2013). «Потребление трансгенного козьего молока, содержащего антимикробный протеин лизоцим, помогает избавиться от диареи у молодых свиней». PLOS ONE. 8 (3): e58409. Bibcode:2013PLoSO ... 858409C. Дои:10.1371 / journal.pone.0058409. ЧВК 3596375. PMID 23516474.
- ^ Molteni M (30 июня 2016 г.). "Пролитое молоко". Примеры использования: особенности новостей. Undark: правда, красота, наука. Получено 12 января 2017.
- ^ Нестер EW, Андерсон Д.Г., Робертс CE, Нестер MT (2007). Микробиология: взгляд человека (5-е изд.). Бостон, Массачусетс: Высшее образование Макгроу-Хилла. ISBN 978-0-07-110706-8.
- ^ Чандра РК (сентябрь 1978 г.). «Иммунологические аспекты грудного молока». Отзывы о питании. 36 (9): 265–72. Дои:10.1111 / j.1753-4887.1978.tb07393.x. PMID 362248.
- ^ Томита Х., Сато С., Мацуда Р., Сугиура Й., Кавагути Х., Ниими Т., Йошида С., Моришита М. (1999). «Уровни лизоцима в сыворотке и клинические особенности саркоидоза». Легкое. 177 (3): 161–7. Дои:10.1007 / pl00007637. PMID 10192763. S2CID 3999327.
- ^ Кеннер GW (июнь 1977 г.). «Бейкерская лекция. К синтезу белков». Труды Лондонского королевского общества. Серия B, Биологические науки. 197 (1128): 237–53. Bibcode:1977RSPSB.197..237K. Дои:10.1098 / rspb.1977.0068. PMID 19745. S2CID 170906912.
- ^ Дурек Т., Торбеев В.Ю., Кент С.Б. (март 2007 г.). «Конвергентный химический синтез и рентгеновская структура лизоцима человека с высоким разрешением». Труды Национальной академии наук Соединенных Штатов Америки. 104 (12): 4846–51. Bibcode:2007PNAS..104.4846D. Дои:10.1073 / pnas.0610630104. ЧВК 1829227. PMID 17360367.
- ^ Вэй Х, Ван З., Чжан Дж., Хаус С, Гао Ю. Г., Ян Л., Робинсон Х, Тан Л. Х., Син Х, Хоу С., Робертсон И. М., Цзо Дж. М., Лу И (февраль 2011 г.). «Зависящий от времени, направленный на белок рост наночастиц золота в монокристалле лизоцима». Природа Нанотехнологии. 6 (2): 93–7. Bibcode:2011НатНа ... 6 ... 93Вт. Дои:10.1038 / nnano.2010.280. PMID 21278750.
- ^ Сангхамитра, штат Нью-Джерси, Уэно Т. (май 2013 г.). «Расширение координационной химии от белка до сборки белка». Химические коммуникации. 49 (39): 4114–26. Дои:10.1039 / C2CC36935D. PMID 23211931.
- ^ Уэно Т. (июль 2013 г.). «Пористые кристаллы белка как реакционные сосуды». Химия. 19 (28): 9096–102. Дои:10.1002 / chem.201300250. PMID 23813903.
- ^ Репаске Р. (октябрь 1956 г.). «Лизис грамотрицательных бактерий лизоцимом». Biochimica et Biophysica Acta. 22 (1): 189–91. Дои:10.1016/0006-3002(56)90240-2. PMID 13373865.
- ^ Гунтон Дж., Ширяев А, Паган Д.Л. (2007). Конденсация белка: кинетические пути к кристаллизации и болезни. Кембридж: Издательство Кембриджского университета. стр.156–158. ISBN 9780511535321.
- ^ Нинфа А., Баллоу Д., Бенор М. (2010). Фундаментальные лабораторные подходы к биохимии и биотехнологии. Джон Вили. ISBN 978-0470087664.
- ^ Salton MR (июнь 1957 г.). «Свойства лизоцима и его действие на микроорганизмы». Бактериологические обзоры. 21 (2): 82–100. Дои:10.1128 / MMBR.21.2.82-100.1957. ЧВК 180888. PMID 13436356.
- ^ Лащенко П (1909). "Über die keimtötende und entwicklungshemmende Wirkung Hühnereiweiß" [Об уничтожении микробов и подавлении роста альбумина куриного яйца]. Z. Hyg. InfektKrankh. (на немецком). 64: 419–427. Дои:10.1007 / BF02216170. S2CID 456259.
- ^ Дакетт, С. (1999). "Дакетт С. Эрнест Дюшен и концепция противогрибковой терапии антибиотиками. Ланцетное отделение истории болезни 354 (9195): 2068-2071, 11 декабря 1999 г.". Ланцет. 354 (9195): 2068–71. Дои:10.1016 / S0140-6736 (99) 03162-1. PMID 10636385. S2CID 206011471.
- ^ Флеминг А. (май 1922 г.). «О замечательном бактериолитическом элементе, обнаруженном в тканях и выделениях». Труды Королевского общества B. 93 (653): 306–317. Bibcode:1922RSPSB..93..306F. Дои:10.1098 / rspb.1922.0023. JSTOR 80959.
- ^ Достижения в химии белков. Академическая пресса. 13 июня 1991. С. 176–. ISBN 978-0-08-058214-6.
- ^ Блейк С.К., Кениг Д.Ф., Майр Г.А., Северный АС, Филлипс, округ Колумбия, Сарма В.Р. (май 1965 г.). "Структура лизоцима куриного яйца-белка. Трехмерный синтез Фурье с разрешением 2 ангстрем". Природа. 206 (4986): 757–61. Дои:10.1038 / 206757a0. PMID 5891407. S2CID 4161467.
- ^ Джонсон Л.Н., Филлипс, округ Колумбия (май 1965 г.). «Структура некоторых кристаллических комплексов лизоцим-ингибитор, определенная с помощью рентгеноструктурного анализа с разрешением 6 ангстрем». Природа. 206 (4986): 761–3. Дои:10.1038 / 206761a0. PMID 5840126. S2CID 10234792.
- ^ Джонсон Л.Н. (ноябрь 1998 г.). «Ранняя история лизоцима». Структурная биология природы. 5 (11): 942–4. Дои:10.1038/2917. PMID 9808036. S2CID 2629199.
- ^ Canfield RE (август 1963 г.). «Аминокислотная последовательность лизоцима яичного белка». Журнал биологической химии. 238 (8): 2698–707. PMID 14063294.
- ^ Вернон, Калифорния (апрель 1967 г.). «Механизмы гидролиза гликозидов и их значение для реакций, катализируемых ферментами». Труды Лондонского королевского общества. Серия B, Биологические науки. 167 (1009): 389–401. Bibcode:1967RSPSB.167..389V. Дои:10.1098 / rspb.1967.0036. JSTOR 75680. PMID 4382802. S2CID 12870128.
- ^ Рупли JA (апрель 1967). «Связывание и расщепление лизоцимом олигосахаридов N-ацетилглюкозамина». Труды Лондонского королевского общества. Серия B, Биологические науки. 167 (1009): 416–28. Bibcode:1967RSPSB.167..416R. Дои:10.1098 / rspb.1967.0038. JSTOR 75682. PMID 4382804. S2CID 33906706.
- ^ Шэрон Н. (апрель 1967). «Химическая структура субстратов лизоцима и их расщепление ферментом». Труды Лондонского королевского общества. Серия B, Биологические науки. 167 (1009): 402–15. Bibcode:1967RSPSB.167..402S. Дои:10.1098 / rspb.1967.0037. JSTOR 75681. PMID 4382803. S2CID 31794497.
внешняя ссылка
- Мурамидаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- Proteopedia.org HEW лизоцим
- PDBe-KB предоставляет обзор всей структурной информации, доступной в PDB для человеческого лизоцима C.
- PDBe-KB предоставляет обзор всей информации о структуре, доступной в PDB для лизоцима C куриного яичного белка.