WikiDer > Уранилацетат - Википедия
Эта статья включает в себя список общих Рекомендации, но он остается в основном непроверенным, потому что ему не хватает соответствующих встроенные цитаты. (Июнь 2012 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
 | |
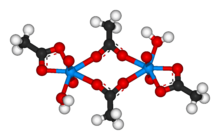 Структура дигидрата | |
| Имена | |
|---|---|
| Название ИЮПАК Бис ((ацетат) -O) диоксодигидрат урана | |
| Другие имена Уранилэтаноат; Дигидрат уранилацетата | |
| Идентификаторы | |
3D модель (JSmol) |
|
| ECHA InfoCard | 100.007.971 |
| UNII |
|
| |
| Характеристики | |
| UO2(CH3COO)2 (безводный) UO2(CH3COO)2· 2H2О (дигидрат) | |
| Молярная масса | 424,146 г / моль (дигидрат) |
| Внешность | желто-зеленые кристаллы (дигидрат) |
| Плотность | 2,89 г / см3 (дигидрат) |
| Температура плавления | разлагается при 80 ° C (дигидрат) |
| 7-8 г / 100 мл | |
| Растворимость | слабо растворим в этиловый спирт[1] |
| Опасности | |
| Паспорт безопасности | Внешний паспорт безопасности материалов |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Уранилацетат (UO2(CH3COO)2· 2H2O) - это ацетат соль уран; это желто-зеленый кристаллический твердое тело из ромбических кристаллы Имеет легкий уксусный запах. Это соединение является ядерное топливо дериватив, его использование и владение санкционированы международным правом.
Производство
Эта секция нуждается в расширении. Вы можете помочь добавляя к этому. (Март 2011 г.) |
Коммерческие препараты уранилацетата обычно получают из обедненный уран и получают реакцией металлического урана с уксусная кислота.
Использует
Уранилацетат широко используется в качестве отрицательного красителя в электронная микроскопия.[2] Большинство процедур электронной микроскопии для биологии требуют использования уранилацетата. Протоколы отрицательного окрашивания обычно обрабатывают образец водным раствором от 1% до 5%. Окрашивание уранилацетатом выполняется просто и быстро, и можно исследовать образец в течение нескольких минут после окрашивания. Некоторые биологические образцы не поддаются окрашиванию уранилацетатом и, в этих случаях, альтернативным методам окрашивания и или низковольтная электронная микроскопия техника может быть более подходящей.
1% и 2% растворы уранилацетата используются в качестве индикатор, а титрант в более сильных концентрациях в аналитическая химия, так как он образует нерастворимую соль с натрий (подавляющее большинство солей натрия растворимы в воде). Растворы уранилацетата демонстрируют чувствительность к свету, особенно к УФ, и при воздействии на них выпадают в осадок.
Уранилацетат также используется в стандартном тесте - Американской ассоциации государственных служащих автомобильных дорог и транспорта (AASHTO), обозначение T 299 - для щелочно-кремнеземная реакционная способность в заполнителях (щебень или гравий), рассматриваемых для использования в цементном бетоне.
Дигидрат уранилацетата использовался в качестве исходного реагента в экспериментальной неорганической химии, например [UO2Cl2(THF)2] (THF = тетрагидрофуран).[3]
Безопасность
Уранилацетат радиоактивен и токсичен. Обычные коммерческие запасы, полученные из обедненного урана, имеют типичный специфическая деятельность 0,37–0,51 микрокюри (14–19 кБк) на грамм. Это очень умеренный уровень радиоактивности, и его недостаточно, чтобы нанести вред, пока материал остается вне тела.
Уранилацетат очень токсичен при проглатывании, вдыхании в виде пыли или при контакте с кожей, если кожа порезана или истерта. Токсичность возникает из-за комбинированного действия химической токсичности и умеренной радиоактивности, и существует опасность кумулятивных эффектов от длительного воздействия.
Рекомендации
- ^ Лиде, Дэвид Р. (1998), Справочник по химии и физике (87 изд.), Бока Ратон, Флорида: CRC Press, стр. 3–566, ISBN 0-8493-0594-2
- ^ «Отрицательное окрашивание» Оксфордский университет
- ^ Полигалогениды уранила. Молекулярная структура [UO2(OAsPh3)4] (Br3)2] и [UO2(OPPh3)4](Я3)2], Многогранник, 2002, 21, 2755.
внешняя ссылка
| AcOH | Он | ||||||||||||||||||
| LiOAc | Быть (OAc)2 BeAcOH | B (OAc)3 | AcOAc ROAc | NH4OAc | AcOOH | FAc | Ne | ||||||||||||
| NaOAc | Mg (OAc)2 | Al (OAc)3 АЛСОЛ Al (OAc)2ОЙ Al2ТАК4(OAc)4 | Si | п | S | ClAc | Ar | ||||||||||||
| KOAc | Ca (OAc)2 | Sc (OAc)3 | Ti (OAc)4 | VO (OAc)3 | Cr (OAc)2 Cr (OAc)3 | Mn (OAc)2 Mn (OAc)3 | Fe (OAc)2 Fe (OAc)3 | Co (OAc)2, Co (OAc)3 | Ni (OAc)2 | Cu (OAc)2 | Zn (OAc)2 | Ga (OAc)3 | Ge | Как (OAc)3 | Se | BrAc | Kr | ||
| RbOAc | Sr (OAc)2 | Y (OAc)3 | Zr (OAc)4 | Nb | Пн (OAc)2 | Tc | Ru (OAc)2 Ru (OAc)3 Ru (OAc)4 | Rh2(OAc)4 | Pd (OAc)2 | AgOAc | CD (OAc)2 | В | Sn (OAc)2 Sn (OAc)4 | Sb (OAc)3 | Te | IAc | Xe | ||
| CsOAc | Ba (OAc)2 | Hf | Та | W | Re | Операционные системы | Ir | Pt (OAc)2 | Au | Hg2(OAc)2, Hg (OAc)2 | TlOAc Tl (OAc)3 | Pb (OAc)2 Pb (OAc)4 | Би (OAc)3 | По | В | Rn | |||
| Пт | Ра | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ц | Og | |||
| ↓ | |||||||||||||||||||
| Ла (OAc)3 | Ce (OAc)Икс | Pr | Nd | Вечера | Sm (OAc)3 | Eu (OAc)3 | Gd (OAc)3 | Tb | Dy (OAc)3 | Хо (OAc)3 | Э | Тм | Yb (OAc)3 | Лу (OAc)3 | |||||
| Ac | Чт | Па | UO2(OAc)2 | Np | Пу | Являюсь | См | Bk | Cf | Es | FM | Мкр | Нет | Lr | |||||

