WikiDer > Хлорноватистая кислота
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Хлорноватистая кислота | |
| Идентификаторы | |
3D модель (JSmol) | |
| ЧЭБИ | |
| ChemSpider | |
| КЕГГ | |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
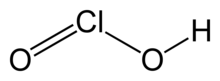
| ЧАСClО2 | |
| Молярная масса | 68,46 г / моль |
| Кислотность (пKа) | 1.96 |
| Основание конъюгата | Хлорит |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Хлорноватистая кислота является неорганическое соединение с формулой HClO2. Это слабая кислота. Хлор имеет степень окисления +3 в этой кислоте. Чистая субстанция нестабильна, непропорциональный к хлорноватистая кислота (Степень окисления Cl +1) и хлорная кислота (Степень окисления Cl +5):
- 2 HClO2 → HClO + HClO3
Хотя кислоту трудно получить в чистом виде, сопряженное основание, хлорит, полученная из этой кислоты, стабильна. Одним из примеров соли этого аниона является хорошо известный хлорит натрия. Эта и родственные соли иногда используются в производстве диоксид хлора.
Подготовка
HClO2 может быть получен реакцией хлорита бария или свинца и разбавлен серная кислота:
- Ba (ClO2)2 + H2ТАК4 → BaSO4 + 2 HClO2
- Pb (ClO2)2 + H2ТАК4 → PbSO4 + 2 HClO2
Стабильность
Хлористая кислота является мощным окислителем, хотя ее склонность к диспропорционированию противодействует ее окислительному потенциалу.
Хлор - единственный галоген с образованием выделяемой кислоты формулы HXO2.[1] Ни один бромистая кислота ни йодистая кислота когда-либо был изолирован. Несколько солей бромистая кислота, бромиты, известны, но нет йодиты.[1]
Рекомендации
![]() СМИ, связанные с Хлорноватистая кислота в Wikimedia Commons
СМИ, связанные с Хлорноватистая кислота в Wikimedia Commons
- ^ а б Эгон Виберг, Арнольд Фредерик Холлеман (2001) Неорганическая химия, Эльзевьер ISBN 0-12-352651-5
| Этот неорганический сложный–Связанная статья является заглушка. Вы можете помочь Википедии расширяя это. |