WikiDer > Нитрозилсерная кислота - Википедия
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Нитрозилсерная кислота | |
| Другие имена бисульфат нитрозония, камерные кристаллы | |
| Идентификаторы | |
3D модель (JSmol) | |
| ChemSpider | |
| ECHA InfoCard | 100.029.058 |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| HNO5S | |
| Молярная масса | 127,08 г / моль |
| Внешность | Бледно-желтые кристаллы[1] |
| Плотность | 1,612 г / мл в 40% раствор серной кислоты |
| Температура плавления | 70 ° С (158 ° F, 343 К)[1] |
| Точка кипения | Разлагается |
| Разлагается | |
| Растворимость | Растворим в ЧАС2ТАК4[1] |
| Опасности | |
| Главный опасности | Окислитель |
| Родственные соединения | |
Другой анионы | NOCl |
Другой катионы | NaHSO4 |
Родственные соединения | НОБФ4 |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Нитрозилсерная кислота это химическое соединение с формулой NOHSO4. Это бесцветное твердое вещество, которое используется в промышленности при производстве капролактам,[2] и ранее был частью свинцовый камерный процесс для производства серная кислота. Состав смешанный ангидрид из серная кислота и азотистая кислота.
В органической химии используется как реагент для нитрозирование, как диазотирующий агент, и как окислитель.[1]
Синтез и реакции
Типичная процедура предполагает растворение нитрат натрия в холодной серной кислоте:[3][4]
- HNO2 + H2ТАК4 → NOHSO4 + H2О
Его также можно приготовить по реакции азотная кислота и диоксид серы.[5]
NOHSO4 используется в органическая химия подготовить соли диазония из амины, например в Реакция Сандмейера. Соответствующие реагенты для доставки NO включают: тетрафторборат нитрозония ([NO] BF4) и нитрозилхлорид.
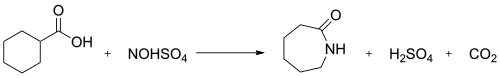
В промышленности реакция нитрозодекарбоксилирования между нитрозилсерной кислотой и циклогексанкарбоновая кислота используется для получения капролактама:[2]
Безопасность
Нитрозилсерная кислота является опасным материалом, поэтому здесь указаны меры предосторожности.[1]
Рекомендации
- ^ а б c d е Джордж А. Олах, Г. К. Сурья Пракаш, Ци Ван, Син-Я Ли (2001). Нитрозилсерная кислота. Энциклопедия реагентов для органического синтеза E-EROS. Дои:10.1002 / 047084289X.rn060. ISBN 978-0471936237.CS1 maint: несколько имен: список авторов (связь)
- ^ а б Ritz, J .; Fuchs, H .; Kieczka, H .; Моран, В. К. (2002). «Капролактам». Энциклопедия промышленной химии Ульмана. Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a05_031. ISBN 978-3527306732.
- ^ Hodgson, H.H .; Махадеван, А. П .; Уорд, Э. Р. (1955). «1,4-Динитронафталин». Органический синтез.; Коллективный объем, 3, п. 341 (диазодизация с последующей обработкой нитритом)
- ^ Sandin, R.B .; Кэрнс, Т. Л. (1943). «1,2,3-Трийод-5-нитробензол». Органический синтез.; Коллективный объем, 2, п. 604 (диазодизация с последующим лечением йодидом)
- ^ Coleman, G.H .; Lillis, G.A .; Гохин, Г. Э. (1939). Нитрозил хлорид. Неорганические синтезы. 1. С. 55–59. Дои:10.1002 / 9780470132326.ch20. ISBN 9780470132326. В ходе этой процедуры образуется нитрозилсерная кислота в качестве промежуточного соединения на пути к NOCl.