WikiDer > Метабисульфит натрия - Википедия
 | |
 | |
 | |
| Имена | |
|---|---|
| Другие имена Пиросульфит натрия Дисульфит натрия | |
| Идентификаторы | |
3D модель (JSmol) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ECHA InfoCard | 100.028.794 |
| Номер ЕС |
|
| Номер E | E223 (консерванты) |
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| |
| |
| Характеристики | |
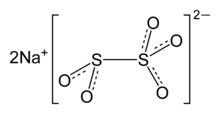
| Na2S2О5, Na-O- (S = O) -O- (S = O) -O-Na | |
| Молярная масса | 190.107 г / моль |
| Внешность | От белого до желтого порошка |
| Запах | Слабый ТАК2 |
| Плотность | 1.48 г / см3 |
| Температура плавления | 170 ° C (338 ° F, 443 K) разложение начинается при 150 ° C |
| |
| Растворимость | Очень растворим в глицерин Слабо растворим в этиловый спирт |
| Опасности | |
| Паспорт безопасности | Паспорт безопасности данных Mallinckrodt |
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Опасность |
| H302, H318 | |
| P264, P270, P280, P301 + 312, P305 + 351 + 338, P310, P330, P501 | |
| NFPA 704 (огненный алмаз) | |
| NIOSH (Пределы воздействия на здоровье в США): | |
PEL (Допустимо) | Никто[1] |
REL (Рекомендуемые) | TWA 5 мг / м3[1] |
IDLH (Непосредственная опасность) | N.D.[1] |
| Родственные соединения | |
Другой анионы | Сульфит натрия Бисульфит натрия |
Другой катионы | Метабисульфит калия |
Родственные соединения | Дитионит натрия Тиосульфат натрия Сульфат натрия |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Метабисульфит натрия или же пиросульфит натрия (Правописание IUPAC; Br. E. метабисульфит натрия или же пиросульфит натрия) является неорганическое соединение химической формулы Na2S2О5. Вещество иногда называют динатрий метабисульфит. Он используется как дезинфицирующее средство, антиоксидант, и консервант агент.[2]
Подготовка
Дисульфит натрия можно получить, обработав раствор едкий натр с диоксид серы.[3] При проведении в теплой воде Na2ТАК3 сначала осаждается в виде желтого твердого вещества. С большим количеством SO2, твердое вещество растворяется с образованием дисульфита, который кристаллизуется при охлаждении.[4]
- ТАК2 + 2 NaOH → Na2ТАК3 + H2О
- ТАК2 + Na2ТАК3 → Na2S2О5
что дает остаток бесцветного твердого Na2S2О5.
Химическая структура
Анион метабисульфит состоит из SO2 группа связана с SO3 группа с отрицательным зарядом, более локализованным на SO3 конец. Длина связи S – S составляет 2,22 Å, а расстояния S – O «тионата» и «тионита» составляют 1,46 и 1,50 Å соответственно.[5]
Реактивность
При растворении в воде образуется бисульфит:
- Na2S2О5 + H2O → 2 Na+ + 2 HSO3−
Использует
Натрий и метабисульфит калия имеют много основных и нишевых применений. Он широко используется для консервирование еды и напитков.
- Метабисульфит натрия добавляется в качестве наполнитель к лекарствам, содержащим адреналин (адреналин), чтобы предотвратить окисление адреналина.[6] Например, его добавляют в комбинированный препарат составы, содержащие местный анестетик и адреналин,[6] и формулировке в автоинъекторы адреналина, например EpiPen.[7] Это продлевает срок годности препарата,[6] хотя метабисульфит натрия реагирует с адреналином, вызывая его разложение и образование сульфоната адреналина.[8]
- Используется в фотографии.[9]
- Концентрированный метабисульфит натрия можно использовать для удаления пни. Некоторые бренды содержат 98% метабисульфита натрия и вызывают разрушение лигнин в культях, облегчая удаление.[10]
- Он также используется как наполнитель в некоторых таблетки, Такие как парацетамол.
- Очень важным аспектом этого вещества, связанным со здоровьем, является то, что его можно добавить в мазок крови в тесте на серповидно-клеточная анемия (и другие подобные формы гемоглобин мутация). Вещества вызывают серповидное поражение отмерших клеток (через комплекс полимеризация) Следовательно, подтверждая болезнь.
- Используется как отбеливающий агент при производстве кокосовых сливок.
- Он используется в качестве восстановителя для разрыва сульфидных связей в усохших предметах одежды из натуральных волокон, что позволяет вернуть одежду к своей первоначальной форме после стирки.
- Он используется как SO2 источник (смешанный с воздухом или кислородом) для разрушения цианида в коммерческих цианирование золота процессы.
- Он используется в водоочистной промышленности для гашения остаточного хлора.
- Применяется при тонированном травлении металлических образцов на основе железа для микроструктурного анализа.[11][12]
- Он используется в качестве фунгицида для защиты от микробов и плесени при транспортировке товаров народного потребления, таких как обувь и одежда. Пластиковые наклейки и упаковка (например, Micro-Pak™), содержащие безводный твердый активный ингредиент метабисульфита натрия, добавляют перед отправкой. Устройства поглощают влагу из атмосферы во время транспортировки и выделяют низкие уровни диоксида серы.[13]
- Используется для консервирования фруктов при транспортировке.[14]
Рекомендации
- ^ а б c Карманный справочник NIOSH по химической опасности. "#0566". Национальный институт охраны труда и здоровья (NIOSH).
- ^ Барбера, Хосе Хименес; Мецгер, Адольф; Вольф, Манфред (2000). «Сульфиты, тиосульфаты и химия дитионитов». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a25_477.
- ^ Кэтрин Э. Хаукрофт; Алан Г. Шарп (2008). «Глава 16: Группа 16 элементов». Неорганическая химия, 3-е издание. Пирсон. п. 520. ISBN 978-0-13-175553-6.
- ^ Джонстон, Х. Ф. (1946). «Сульфиты и пиросульфиты щелочных металлов». Неорганические синтезы. Неорганические синтезы. 2. С. 162–167. Дои:10.1002 / 9780470132333.ch49. ISBN 9780470132333.
- ^ К. Л. Картер, Т. А. Сиддик, К. Л. Мерфи, Д. В. Беннетт «Удивительно неуловимая кристаллическая структура метабисульфита натрия» Acta Crystallogr. (2004). B60, 155–162. Дои:10.1107 / S0108768104003325
- ^ а б c Макги, Дуглас Л. (2013). «Местная и местная анестезия». В Робертс, Джеймс Р .; Джеррис, Р. Хеджес (ред.). Клинические процедуры Робертса и Хеджеса в неотложной медицинской помощи (6-е изд.). Elsevier / Saunders. п. 519. ISBN 9781455748594.
- ^ Ниази, Сафараз К. (2009). Справочник по фармацевтическим производственным составам. Том 6, Стерильные продукты (2-е изд.). Нью-Йорк: Informa Healthcare. п. 410. ISBN 9781420081312.
- ^ Барнс, Эндрю Р. (2013). «Глава 48. Химическая стабильность в лекарственных формах». В Aulton, Michael E .; Тейлор, Кевин М.Г. (ред.). Фармацевтика Aulton: разработка и производство лекарств (4-е изд.). Черчилль Ливингстон / Эльзевьер. п. 833. ISBN 9780702053931.
- ^ Анчелл, Стив (2008). Поваренная книга темной комнаты (3-е изд.). Амстердам: Focal Press. стр.193. ISBN 978-0240810553.
- ^ http://www.bonideproducts.com/lbonide/msds/sds271.pdf
- ^ «Цветная металлография». 2011-05-04.
- ^ https://www.asminternational.org/documents/10192/1874035/htp00102p025.pdf/ace8f01d-bf9a-4048-b948-a3aeb2d8a536
- ^ «Улучшенные упаковочные наклейки Micro-Pak» (PDF). 2020-05-05.
- ^ «Послеуборочная биология и технология тропических и субтропических фруктов». 2020-05-05. Дои:10.1533/9780857092885.361. Цитировать журнал требует
| журнал =(помощь)
