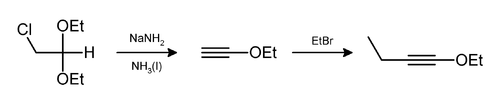WikiDer > Амид натрия
 | |
 | |
| Имена | |
|---|---|
| Название ИЮПАК Амид натрия, азанид натрия[1] | |
| Другие имена Содамид | |
| Идентификаторы | |
3D модель (JSmol) | |
| ChemSpider | |
| ECHA InfoCard | 100.029.064 |
| Номер ЕС |
|
PubChem CID | |
| UNII | |
| Номер ООН | 1390 |
| |
| |
| Характеристики | |
| NaNH2 | |
| Молярная масса | 39,01 г моль−1 |
| Внешность | Бесцветные кристаллы |
| Запах | аммиачный |
| Плотность | 1,39 г см−3 |
| Температура плавления | 210 ° С (410 ° F, 483 К) |
| Точка кипения | 400 ° С (752 ° F, 673 К) |
| реагирует | |
| Растворимость | 0,004 г / 100 мл (жидкий аммиак), реагирует в этиловый спирт |
| Кислотность (пKа) | 38 (конъюгированная кислота)[2] |
| Структура | |
| ромбический | |
| Термохимия | |
Теплоемкость (C) | 66,15 Дж / моль К |
Стандартный моляр энтропия (S | 76,9 Дж / моль К |
Станд. Энтальпия формирование (ΔжЧАС⦵298) | -118,8 кДж / моль |
Свободная энергия Гиббса (Δжграмм˚) | -59 кДж / моль |
| Опасности | |
| NFPA 704 (огненный алмаз) | |
| точка возгорания | 4,44 ° С (39,99 ° F, 277,59 К) |
| 450 ° С (842 ° F, 723 К) | |
| Родственные соединения | |
Другой анионы | Бис (триметилсилил) амид натрия |
Другой катионы | Литий амид Амид калия |
Родственные соединения | Аммиак |
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Амид натрия, обычно называемый содамид (систематическое название азанид натрия), это неорганическое соединение с формула NaNH2. Это соль состоит из катиона натрия и азанид анион. Это твердое вещество, опасно реактивное по отношению к воде, имеет белый цвет, но коммерческие образцы обычно серые из-за присутствия небольшого количества металлического железа в процессе производства. Такие примеси обычно не влияют на полезность реагент.[нужна цитата] NaNH2 проводит электричество в плавленом состоянии, его проводимость аналогична проводимости NaOH в аналогичном состоянии. NaNH2 широко использовался как прочная база в органический синтез.
Подготовка и состав
Амид натрия может быть получен реакцией натрий с газообразным аммиаком,[3] но обычно его получают реакцией в жидкий аммиак с помощью нитрат железа (III) как катализатор. Реакция протекает быстрее всего при температуре кипения аммиака c. -33 ° С. An электрид, [Na (NH3)6]+е−, формируется как промежуточный продукт реакции.[4]
- 2 Na + 2 NH3 → 2 NaNH2 + H2
NaNH2 представляет собой солеподобный материал и, как таковой, кристаллизуется в виде бесконечного полимера.[5] Геометрия относительно натрия тетраэдрическая.[6] В аммиаке NaNH2 образует проводящие растворы, соответствующие наличию Na (NH3)6+ и NH2− ионы.
Использует
Амид натрия в основном используется как сильный основание в органической химии часто в растворе нашатырного спирта. Это предпочтительный реагент для сушки аммиак (жидкий или газообразный)[нужна цитата]. Одним из основных преимуществ использования амида натрия является то, что он в основном действует как нуклеофил. В промышленном производстве индиго, амид натрия является компонентом высокоосновной смеси, которая вызывает циклизацию N-фенилглицин. В результате реакции образуется аммиак, который обычно рециркулируют.[7]

Дегидрогалогенирование
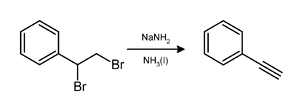
Амид натрия вызывает потерю двух эквивалентов бромистый водород из вицинальный дибромалкан для получения углерод-углеродная тройная связь, как при приготовлении фенилацетилен.[8]Обычно два эквивалента амида натрия дают желаемый алкин. Для получения концевых алкинов необходимо три эквивалента, поскольку концевой СН образовавшегося алкина протонирует эквивалентное количество основания.
Хлористый водород и этиловый спирт также могут быть устранены таким образом,[9] как при получении 1-этокси-1-бутина.[10]
Реакции циклизации
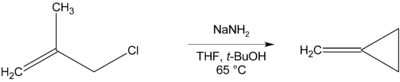
Там, где отсутствует β-водород, который необходимо удалить, могут образовываться циклические соединения, как при получении метиленциклопропан ниже.[11]
Циклопропены,[12] азиридины[13]и циклобутаны[14] могут быть сформированы аналогичным образом.
Депротонирование углеродной и азотной кислот
Углеродные кислоты, которые могут быть депротонированный амидом натрия в жидком аммиаке, включая концевые алкины,[15]метил кетоны,[16]циклогексанон,[17] фенилуксусная кислота и его производные[18]и дифенилметан.[19] Ацетилацетон теряет два протона, чтобы сформировать дианион.[20] Амид натрия также депротонирует индол[21] и пиперидин.[22]
Связанные ненуклеофильные основания
Однако он плохо растворяется в других растворителях, кроме аммиака. Его использование было заменено соответствующими реагентами. гидрид натрия, бис (триметилсилил) амид натрия (NaHMDS) и диизопропиламид лития (LDA).
Другие реакции
- Перегруппировка с ортодепротонированием[23]
- Синтез оксирана[24]
- Синтез индола[25]
- Реакция Чичибабина
Безопасность
Амид натрия бурно реагирует с водой с образованием аммиак и едкий натр и будет гореть в воздухе, чтобы дать оксиды натрия и диоксид азота.
- NaNH2 + H2O → NH3 + NaOH
- 4 NaNH2 + 7 O2 → 2 Na2O + 4 НЕТ2 + 4 часа2О
В присутствии ограниченного количества воздуха и влаги, например, в плохо закрытом контейнере, могут образовываться взрывоопасные смеси пероксидов.[26] Это сопровождается пожелтением или потемнением твердого вещества. Таким образом, амид натрия следует хранить в плотно закрытом контейнере в атмосфере инертного газа. Образцы амида натрия желтого или коричневого цвета представляют опасность взрыва.[27]
Рекомендации
- ^ http://goldbook.iupac.org/A00266.html
- ^ Buncel, E .; Менон, Б. (1977). «Карбанионные механизмы: VII. Металлирование углеводородных кислот амидом калия и метиламидом калия в тетрагидрофуране и относительные гидридные кислотности». Журнал металлоорганической химии. 141 (1): 1–7. Дои:10.1016 / S0022-328X (00) 90661-2.
- ^ Бергстром, Ф. В. (1955). «Амид натрия». Органический синтез.; Коллективный объем, 3, п. 778
- ^ Гринли, К. В .; Хенне, А. Л. (1946). «Амид натрия». Неорганические синтезы. 2: 128–135. Дои:10.1002 / 9780470132333.ch38.
- ^ Залкин, А .; Темплтон, Д. Х. (1956). «Кристаллическая структура амида натрия». Журнал физической химии. 60 (6): 821–823. Дои:10.1021 / j150540a042. HDL:2027 / mdp.39015086484659.
- ^ Уэллс, А. Ф. (1984). Структурная неорганическая химия. Оксфорд: Clarendon Press. ISBN 0-19-855370-6.
- ^ Л. Ланге, В. Трейбель «Амид натрия» в Энциклопедии промышленной химии Ульмана 2005, Wiley-VCH, Weinheim. Дои:10.1002 / 14356007.a24_267
- ^ Кэмпбелл, К. Н .; Кэмпбелл, Б. К. (1950). «Фенилацетилен». Органический синтез. 30: 72.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 4, п. 763
- ^ Jones, E.R.H .; Эглинтон, Г.; Whiting, M.C .; Шоу, Б. Л. (1954). «Этоксиацетилен». Органический синтез. 34: 46.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 4, п. 404
Боу, А .; Pericàs, M. A .; Riera, A .; Серратоса, Ф. (1987). "Диалкоксиацетилены: ди-терт-бутоксиэтин, ценный синтетический промежуточный продукт ». Органический синтез. 65: 58.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 8, п. 161
Magriotis, P.A .; Браун, Дж. Т. (1995). «Фенилтиоацетилен». Органический синтез. 72: 252.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 9, п. 656
Ashworth, P.J .; Mansfield, G.H .; Whiting, M.C. (1955). «2-Бутын-1-ол». Органический синтез. 35: 20.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 4, п. 128 - ^ Newman, M. S .; Сталик, В. М. (1977). «1-этокси-1-бутин». Органический синтез. 57: 65.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 6, п. 564
- ^ Salaun, J. R .; Чемпион, J .; Кониа, Дж. М. (1977). «Циклобутанон из метиленциклопропана через оксаспиропентан ". Органический синтез. 57: 36.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 6, п. 320
- ^ Накамура, М .; Wang, X. Q .; Исака, М .; Yamago, S .; Накамура, Э. (2003). «Синтез и (3 + 2) -циклоприсоединение 2,2-диалкокси-1-метиленциклопропана: 6,6-диметил-1-метилен-4,8-диоксаспиро (2,5) октана и СНГ-5- (5,5-диметил-1,3-диоксан-2-илиден) гексагидро-1 (2ЧАС) -пентален-2-он ». Органический синтез. 80: 144.CS1 maint: несколько имен: список авторов (связь)
- ^ Bottini, A.T .; Олсен, Р. Э. (1964). "N-Этилалленимин ». Органический синтез. 44: 53.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 5, п. 541
- ^ Skorcz, J. A .; Камински, Ф. Э. (1968). «1-Цианобензоциклобутен». Органический синтез. 48: 55.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 5, п. 263
- ^ Сондерс, Дж. Х. (1949). «1-Этинилциклогексанол». Органический синтез. 29: 47.; Коллективный объем, 3, п. 416
Peterson, P.E .; Данэм, М. (1977). "(Z) -4-Хлор-4-гексенилтрифторацетат ". Органический синтез. 57: 26.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 6, п. 273
Kauer, J.C .; Браун, М. (1962). «Тетроловая кислота». Органический синтез. 42: 97.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 5, п. 1043 - ^ Коффман, Д. Д. (1940). «Диметилэтинилкарбинол». Органический синтез. 20: 40.; Коллективный объем, 3, п. 320Hauser, C.R .; Adams, J. T .; Левин, Р. (1948). «Диизовалерилметан». Органический синтез. 28: 44.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 3, п. 291
- ^ Vanderwerf, C.A .; Леммерман, Л. В. (1948). «2-Аллилциклогексанон». Органический синтез. 28: 8.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 3, п. 44
- ^ Hauser, C.R .; Даннавант, В. Р. (1960). «α, β-дифенилпропионовая кислота». Органический синтез. 40: 38.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 5, п. 526
Kaiser, E.M .; Kenyon, W. G .; Хаузер, К. Р. (1967). «Этил 2,4-дифенилбутаноат». Органический синтез. 47: 72.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 5, п. 559
Wawzonek, S .; Смолин Э. М. (1951). «α, β-Дифенилциннамонитрил». Органический синтез. 31: 52.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 4, п. 387 - ^ Murphy, W. S .; Hamrick, P.J .; Хаузер, К. Р. (1968). «1,1-Дифенилпентан». Органический синтез. 48: 80.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 5, п. 523
- ^ Hampton, K. G .; Harris, T. M .; Хаузер, К. Р. (1971). «Фенилирование хлорида дифенилиодония: 1-фенил-2,4-пентандион». Органический синтез. 51: 128.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 6, п. 928
Хэмптон, К. Г .; Harris, T. M .; Хаузер, К. Р. (1967). «2,4-Нонандион». Органический синтез. 47: 92.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 5, п. 848 - ^ Potts, K. T .; Сакстон, Дж. Э. (1960). «1-Метилиндол». Органический синтез. 40: 68.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 5, п. 769
- ^ Bunnett, J. F .; Brotherton, T. K .; Уильямсон, С. М. (1960). "N-β-Нафтилпиперидин ". Органический синтез. 40: 74.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 5, п. 816
- ^ Brazen, W. R .; Хаузер, К. Р. (1954). «2-Метилбензилдиметиламин». Органический синтез. 34: 61.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 4, п. 585
- ^ Allen, C.F.H .; ВанАллан Дж. (1944). «Фенилметилглицидиловый эфир». Органический синтез. 24: 82.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 3, п. 727
- ^ Allen, C.F.H .; ВанАллан Дж. (1942). «2-Метилиндол». Органический синтез. 22: 94.CS1 maint: несколько имен: список авторов (связь); Коллективный объем, 3, п. 597
- ^ Кларк, Дональд Э (2001). «Пероксиды и пероксидообразующие соединения». Химическое здоровье и безопасность. 8 (5): 12–22. Дои:10.1016 / S1074-9098 (01) 00247-7. ISSN 1074-9098.
- ^ «Амид натрия СОП». Принстон.