WikiDer > Варианты ПЦР
Универсальность полимеразной цепной реакции (ПЦР) привела к большому количеству варианты ПЦР.
Основные модификации
Часто для достижения желаемой цели требуется внести лишь небольшие изменения в стандартный протокол ПЦР:
Мультиплексная ПЦР использует несколько пар праймеров, отжигаемых с разными целевыми последовательностями. Это позволяет одновременно анализировать несколько мишеней в одном образце. Например, при тестировании на генетические мутации можно комбинировать шесть или более амплификаций. В стандартном протоколе для Снятие отпечатков ДНК, исследуемые мишени часто амплифицируются группами по 3 или 4 человека. Мультиплексное усиление зонда, зависящее от лигирования (или же MLPA) позволяет амплифицировать несколько мишеней с использованием только одной пары праймеров, избегая ограничений разрешения мультиплексной ПЦР. Мультиплексная ПЦР также использовалась для анализа микроспутники и SNP.[1]
ПЦР с переменным количеством тандемных повторов (VNTR) нацелены на области генома, которые проявляют изменение длины. Анализ генотипов образца обычно включает определение размеров продуктов амплификации по гель-электрофорез. Анализ небольших сегментов VNTR, известных как короткие тандемные повторы (или СПО) является основой для Дактилоскопия ДНК базы данных Такие как CODIS.
Асимметричная ПЦР предпочтительно амплифицирует одну цепь целевой ДНК. Он используется в некоторых последовательность действий методы и гибридизация зондирование, чтобы получить одну цепь ДНК в качестве продукта. Термоциклирование проводят так же, как в ПЦР, но с ограниченным количеством или без одного из праймеров. Когда ограничивающий праймер истощается, репликация увеличивается. арифметически путем наращивания излишков грунтовки.[2] Модификация этого процесса, названная Lв ухе-Апосле-Тон-Exponential-PCR (или ПОЗДНИЙ ПЦР), используется ограничивающий праймер с более высокой Температура плавления (Тм), чем избыток праймера, чтобы поддерживать эффективность реакции, поскольку предельная концентрация праймера уменьшается в середине реакции.[3] (Также см ПЦР с перекрытием и удлинением).
Некоторые модификации необходимы для выполнения длинная ПЦР. Оригинал Кленова В процессе ПЦР не были получены продукты размером более 400 п.н. Полимераза Taq однако может усиливать цели длиной до нескольких тысяч п.н.[4] С тех пор модифицированные протоколы с ферментом Taq позволили амплифицировать мишени размером более 50 т.п.н.[5]
Вложенная ПЦР используется для повышения специфичности амплификации ДНК. Два набора праймеров используются в двух последовательных реакциях. В первой ПЦР одна пара праймеров используется для создания продуктов ДНК, которые могут содержать продукты, амплифицированные из нецелевых областей. Продукты из первой ПЦР затем используются в качестве матрицы во второй ПЦР с использованием одного («полугнездо») или двух различных праймеров, сайты связывания которых расположены (вложены) в пределах первого набора, что увеличивает специфичность. Вложенная ПЦР часто более успешна для специфической амплификации продуктов длинной ДНК, чем обычная ПЦР, но требует более детального знания последовательности мишени.
Количественная ПЦР используется для измерения определенного количества целевой ДНК (или РНК) в образце. Измеряя усиление только в фазе истинного экспоненциального увеличения, количество измеряемого продукта более точно отражает исходное количество цели. Используются специальные термоциклеры, контролирующие количество продукта во время амплификации. Количественная ПЦР в реальном времени В методах (QRT-PCR) используются флуоресцентные красители, такие как Sybr Green или флуорофор-содержащие ДНК-зонды, такие как TaqMan, чтобы измерить количество амплифицированного продукта в процессе амплификации.
ПЦР с горячим стартом представляет собой метод, выполняемый вручную путем нагревания компонентов реакции до температуры плавления ДНК (например, 95 ° C) перед добавлением полимеразы. Таким образом предотвращается неспецифическое усиление при более низких температурах.[6] В качестве альтернативы, специализированные реагенты ингибируют активность полимеразы при температуре окружающей среды, либо путем связывания антителоили присутствием ковалентно связанных ингибиторов, которые диссоциируют только после стадии высокотемпературной активации. «ПЦР с горячим стартом / холодным окончанием» достигается с помощью новых гибридных полимераз, которые неактивны при температуре окружающей среды и активируются только при повышенных температурах.
В приземление PCR, температура отжига постепенно снижается в более поздних циклах. Температура отжига на ранних циклах обычно на 3–5 ° C выше стандартной Tм использованных праймеров, в то время как в более поздних циклах это такое же количество ниже Tм. Первоначальная более высокая температура отжига приводит к большей специфичности связывания праймера, в то время как более низкие температуры позволяют более эффективную амплификацию в конце реакции.[7]
Сборка ПЦР (также известен как Полимеразный цикл сборки или же PCA) представляет собой синтез длинных структур ДНК путем выполнения ПЦР на пуле длинных олигонуклеотидов с короткими перекрывающимися сегментами для сборки двух или более частей ДНК в одну часть. Он включает в себя начальную ПЦР с перекрывающимися праймерами и вторую ПЦР с использованием продуктов в качестве матрицы, которая генерирует конечный полноразмерный продукт. Этот метод может заменить перевязкасборка на базе.[8]
В колония ПЦР, бактериальные колонии подвергаются скринингу непосредственно с помощью ПЦР, например скрининга на правильность ДНК вектор конструкции. Колонии берут с помощью наконечника стерильной пипетки и небольшое количество клеток переносят в смесь для ПЦР. Чтобы высвободить ДНК из клеток, ПЦР запускают либо с увеличенного времени при 95 ° C (когда используется стандартная полимераза), либо с укороченной стадии денатурации при 100 ° C и специальной химерной ДНК-полимеразы.[9]
В цифровая полимеразная цепная реакция одновременно усиливает тысячи семплов, каждый в отдельном капля внутри эмульсии.
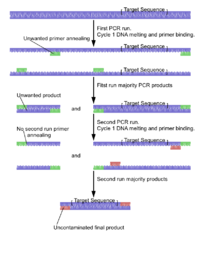
Самоубийственная ПЦР обычно используется в палеогенетика или другие исследования, в которых предотвращение ложноположительных результатов и обеспечение специфичности амплифицированного фрагмента является наивысшим приоритетом. Первоначально он был описан в исследовании для проверки наличия микроба. Yersinia pestis в дентальных образцах, взятых из могил 14 века людей, предположительно убитых чумой в средневековье. Черная смерть эпидемия.[10] Этот метод предписывает использование любой комбинации праймеров только один раз в ПЦР (отсюда и термин «самоубийство»), который никогда не должен использоваться в какой-либо положительной контрольной реакции ПЦР, и праймеры всегда должны быть нацелены на область генома, никогда ранее не амплифицированную в lab с использованием этого или любого другого набора праймеров. Это гарантирует, что в лаборатории не будет загрязняющей ДНК из предыдущих реакций ПЦР, которая в противном случае могла бы привести к ложноположительным результатам.
ХОЛОДНАЯ ПЦР (co-усиление на лцветущий denaturation temperature-PCR) представляет собой модифицированный протокол, который обогащает вариантные аллели из смеси ДНК дикого типа и ДНК, содержащей мутации.
Предварительные процедуры и расширения
Базовый процесс ПЦР иногда может предшествовать другому методу или следовать за ним.
ОТ-ПЦР (или же рразворот Ттранскрипция ПЦР) используется для обратной транскрипции и усиления РНК к кДНК. ПЦР предшествует реакция с использованием обратная транскриптаза, фермент, превращающий РНК в кДНК. Эти две реакции можно объединить в пробирке, при этом начальный этап нагревания ПЦР используется для инактивации транскриптазы.[4] Полимераза Tth (описанная ниже) обладает RT-активностью и может осуществлять всю реакцию. ОТ-ПЦР широко используется в профилирование выражений, который определяет экспрессию гена. Его также можно использовать для получения последовательности транскрипта РНК, которая может помочь в определении начало транскрипции и сайты прекращения (по РАС-ПЦР) и облегчить отображение местоположения экзоны и интроны в генной последовательности.
Двусторонняя ПЦР использует один праймер, который связывается с мишенью микроРНК как с 3 ', так и с 5' концами, известный как гемипрозоны.[11] Оба конца должны дополнять друг друга, чтобы произошло связывание. Затем 3'-конец удлиняется обратной транскриптазой, образуя длинную кДНК. Затем кДНК амплифицируют с использованием двух целевых специфичных праймеров для ПЦР. Комбинация двух гемизондов, нацеленных на короткую мишень микроРНК, делает двусторонний анализ чрезвычайно чувствительным и специфичным.
ПЦР, опосредованная лигированием использует небольшие ДНК-олигонуклеотидные «линкеры» (или адаптеры), которые сначала лигируют с фрагментами целевой ДНК. Праймеры ПЦР, которые отжигаются с линкерными последовательностями, затем используются для амплификации целевых фрагментов. Этот метод используется для секвенирования ДНК, обхода генома и ДНК-след.[12] Связанная техника полиморфизм длины амплифицированного фрагмента, который генерирует диагностические фрагменты генома.
ПЦР, специфичная для метилирования (MSP) используется для определения паттернов Метилирование ДНК в цитозин-гуаниновые (CpG) островки в геномной ДНК.[13] Целевая ДНК сначала обрабатывается бисульфит натрия, который превращает неметилированный цитозин базы для урацил, который дополняет аденозин в праймерах для ПЦР. Затем проводят две амплификации ДНК, обработанной бисульфитом: один набор праймеров отжигает ДНК с цитозином (соответствует метилированному цитозину), а другой набор отжигает ДНК с урацилом (соответствует неметилированному цитозину). MSP используется в количественная ПЦР предоставляет количественную информацию о состоянии метилирования данного CpG-островка.[14]
Прочие модификации
Регулировка компонентов в ПЦР обычно используется для достижения оптимальной производительности.
Двухвалентный магний ион (Mg++) требуется для активности полимеразы ПЦР. Более низкие концентрации Mg++ повысит точность репликации, а более высокие концентрации внесут больше мутаций.[15]
Денатурирующие средства(Такие как ДМСО) может повышать специфичность амплификации за счет дестабилизации неспецифического связывания праймера. Другие химические вещества, такие как глицерин, находятся стабилизаторы для активности полимеразы во время амплификации. Моющие средства (Такие как Тритон Х-100) может предотвратить прилипание полимеразы к самой себе или к стенкам реакционной пробирки.
ДНК-полимеразы иногда включают основания несовпадения в удлиняющуюся цепь. ПЦР с высокой точностью использует ферменты с 3'-5 ' экзонуклеаза активность, которая снижает этот показатель неправильного включения. Примеры ферментов с корректирующей активностью включают: Pfu; корректировки Mg++ и концентрации dNTP могут помочь максимизировать количество продуктов, которые точно соответствуют исходной целевой ДНК.[нужна цитата]
Модификации грунтовки
Корректировки синтетических олигонуклеотидов, используемых в качестве праймеров в ПЦР, являются богатым источником модификаций:
Обычно праймеры для ПЦР выбираются из инвариантной части генома и могут использоваться для амплификации полиморфной области между ними. В аллель-специфическая ПЦР делается наоборот. По крайней мере, один из праймеров выбран из полиморфной области с мутациями, расположенными на (или около) его 3'-конце. В жестких условиях несовпадающий праймер не инициирует репликацию, тогда как подобранный праймер будет. Таким образом, появление продукта амплификации указывает на генотип. (Для получения дополнительной информации см. Генотипирование SNP.)
ПЦР, специфичная для каждой последовательности (или же ISSR-ПЦР) - метод для Дактилоскопия ДНК который использует праймеры, выбранные из сегментов, повторяющихся по всему геному, для получения уникального отпечатка длины амплифицированного продукта.[16] Использование праймеров из часто повторяющийся сегмент называется Алу-ПЦР, и может помочь амплифицировать последовательности, смежные (или между) этими повторами.
Праймеры также могут быть «вырожденными» - способными инициировать репликацию из большого количества целевых участков. Амплификация всего генома (или же WGA) - это группа процедур, которые позволяют амплификации происходить во многих местах неизвестного генома и которые могут быть доступны только в небольших количествах. Использование других техник вырожденные праймеры которые синтезируются с использованием нескольких нуклеотидов в определенных положениях (полимераза «выбирает» правильно подобранные праймеры). Также праймеры могут быть синтезированы с аналог нуклеозида инозин, который гибридизуется с тремя из четырех нормальных оснований. Подобный метод может заставить выполнить ПЦР. Сайт-направленный мутагенез. (также см Полимеразная цепная реакция с удлинением перекрытия)
Обычно используемые в ПЦР праймеры полностью комплементарны мишени. Однако полимераза устойчива к ошибочным совпадениям вдали от 3 'конца. Хвостатые праймеры включают некомплементарные последовательности на их 5'-концах. Распространенной процедурой является использование линкеры-праймеры, которые в конечном итоге размещают сайты рестрикции на концах продуктов ПЦР, облегчая их последующую вставку в векторы клонирования.
Расширением метода «ПЦР колоний» (см. Выше) является использование векторные праймеры. Фрагменты целевой ДНК (или кДНК) сначала вставляются в клонируемый вектор, и единый набор праймеров разработан для областей вектора, фланкирующих сайт вставки. Амплификация происходит для любой вставленной ДНК.[4]
ПЦР можно легко модифицировать для получения маркированный продукт для последующего использования в качестве гибридизация зонд. Один или оба праймера могут использоваться в ПЦР с уже прикрепленной радиоактивной или флуоресцентной меткой, или метки могут быть добавлены после амплификации. Эти методы мечения можно комбинировать с «асимметричной ПЦР» (см. Выше) для получения эффективных гибридизационных зондов.
РНКаза H-зависимая ПЦР (rhPCR) может уменьшить образование димера праймера и увеличить количество анализов в мультиплексной ПЦР. В этом методе используются праймеры с расщепляемым блоком на 3 ’конце, который удаляется под действием термостабильного фермента РНКазы HII.[17]
ДНК-полимеразы
Есть несколько ДНК-полимераз, которые используются в ПЦР.
В Кленовский фрагмент, полученный из оригинала ДНК-полимераза I из Кишечная палочка, был первым ферментом, использованным в ПЦР. Из-за отсутствия стабильности при высоких температурах его необходимо пополнять во время каждого цикла, поэтому он обычно не используется в ПЦР.
Бактериофаг ДНК-полимераза Т4 (семейство A) также первоначально использовалось в ПЦР. Он имеет более высокую точность репликации, чем фрагмент Кленова, но также разрушается при нагревании. ДНК-полимераза Т7 (семейство B) имеет аналогичные свойства и цели. Он был применен к сайт-направленный мутагенез[18] и Секвенирование по Сэнгеру.[19]
Taq полимераза, ДНК-полимераза I из Thermus aquaticus, была первой термостабильной полимеразой, использованной в ПЦР, и до сих пор остается наиболее часто используемой. Фермент может быть выделен из его природного источника или из его клонированного гена, экспрессированного в Кишечная палочка.[4] 61 кДа, усеченная из-за отсутствия 5'-3 'экзонуклеазной активности, известна как Фрагмент Стоффеля, и выражается в Кишечная палочка.[20] Отсутствие экзонуклеазной активности может позволить ему амплифицировать более длинные мишени, чем нативный фермент. Он был коммерциализирован как AmpliTaq и Клентак.[21] Также был разработан вариант, разработанный для ПЦР с горячим стартом, который называется «полимераза Faststart». Он требует сильной тепловой активации, что позволяет избежать неспецифической амплификации из-за активности полимеразы при низкой температуре. Множество других вариантов были созданы.[22]
Другой Thermus полимеразы, такие как Tth полимераза I (P52028) из Термус термофильный, нашел применение. Tth обладает активностью обратной транскриптазы в присутствии Mn2+ ионы, позволяющие амплификацию ПЦР от мишеней РНК.[23]
В архейский род Пирококк оказался богатым источником термостабильных полимераз с корректирующей активностью. ДНК-полимераза Pfu, изолированные от P. furiosus показывает 5-кратное снижение частоты ошибок репликации по сравнению с Taq.[24] Поскольку ошибки увеличиваются по мере продвижения ПЦР, Pfu является предпочтительной полимеразой, когда продукты должны быть индивидуально клонированы для секвенирования или экспрессии. Другие менее используемые полимеразы этого рода включают: Pwo (P61876) из Pyrococcus woesei, Pfx от безымянного вида, полимеразы "Deep Vent" (Q51334) из штамма ГБ-Д.[25]
Вентиляция или Tli полимераза чрезвычайно термостабильный ДНК-полимераза, выделенная из Термококк литоралис. Полимераза из Термококк фумиколанс (Тфу) также был коммерциализирован.[25]
Модификации механизма
Иногда можно изменить даже основной механизм ПЦР.
В отличие от обычной ПЦР, Обратная ПЦР позволяет амплификацию и секвенирование ДНК, окружающей известную последовательность. Он включает первоначальное воздействие на ДНК-мишень серии рестрикционный фермент пищеварение, а затем рассредоточить полученные фрагменты с помощью самостоятельное лигирование. Праймеры предназначены для удлинения наружу от известного сегмента, что приводит к усилению остальной части круга. Это особенно полезно при идентификации последовательностей по обе стороны от различных геномных вставок.[26]
По аналогии, термическая асимметричная ПЦР с чересстрочной разверткой (или же ХВОСТ-ПЦР) используется для выделения неизвестных последовательностей, фланкирующих известную область генома. В пределах известной последовательности TAIL-PCR использует вложенную пару праймеров с разными температурами отжига. «Вырожденный» праймер используется для амплификации в направлении, противоположном неизвестной последовательности.[27]
Методы изотермического усиления
Были разработаны некоторые протоколы амплификации ДНК, которые можно использовать как альтернативу ПЦР. Они изотермические, что означает, что они работают при постоянной температуре.[28]
Зависимая от геликазы амплификация (HDA) аналогичен традиционной ПЦР, но использует постоянную температуру, а не циклическое переключение между стадиями денатурации и отжига / удлинения. ДНК-геликаза, фермент, раскручивающий ДНК, используется вместо термической денатурации.[29] Петлевая изотермическая амплификация аналогичная идея, но реализованная с помощью полимеразы с замещением цепей.[30]
Реакция амплификации фермента никения (NEAR) и его двоюродный брат усиление смещения цепи (SDA) являются изотермическими, реплицирующими ДНК при постоянной температуре с использованием полимеразы и никелирующего фермента.[28]
Амплификация рекомбиназной полимеразы (RPA)[31] использует рекомбиназа для специфического спаривания праймеров с двухцепочечной ДНК на основе гомологии, тем самым направляя синтез ДНК из определенных последовательностей ДНК, присутствующих в образце. Присутствие целевой последовательности инициирует амплификацию ДНК, при этом не требуется термического или химического плавления ДНК. Реакция быстро прогрессирует и приводит к специфической амплификации ДНК от нескольких копий-мишеней до обнаруживаемых уровней, как правило, в течение 5–10 минут. Вся реакционная система стабильна в виде высушенного состава и не требует охлаждения. RPA может использоваться для замены ПЦР в различных лабораторных приложениях, и пользователи могут создавать свои собственные анализы.[32]
Другие типы изотермического усиления включают: амплификация всего генома (WGA), Амплификация на основе последовательности нуклеиновых кислот (NASBA) и транскрипционная амплификация (ТМА).[28]
Смотрите также
Рекомендации
- ^ Хайден MJ, Nguyen TM, Waterman A, Chalmers KJ (2008). «ПЦР с мультиплексированием: новый метод мультиплексного генотипирования SSR и SNP». BMC Genomics. 9: 80. Дои:10.1186/1471-2164-9-80. ЧВК 2275739. PMID 18282271.
- ^ Innis MA, Myambo KB, Gelfand DH, Brow MA (декабрь 1988 г.). «Секвенирование ДНК с помощью ДНК-полимеразы Thermus aquaticus и прямое секвенирование ДНК, амплифицированной с помощью полимеразной цепной реакции». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 85 (24): 9436–40. Bibcode:1988PNAS ... 85.9436I. Дои:10.1073 / пнас.85.24.9436. ЧВК 282767. PMID 3200828.
- ^ Пирс KE, Ванх LJ (2007). Линейно-экспоненциальная полимеразная цепная реакция и родственные технологии Стратегии обнаружения в реальном времени для быстрой и надежной диагностики отдельных клеток. Методы Мол Мед. Методы молекулярной медицины ™. 132. С. 65–85. Дои:10.1007/978-1-59745-298-4_7. ISBN 978-1-58829-578-1. PMID 17876077.
- ^ а б c d Сайки Р.К., Гельфанд Д.Х., Стоффель С. и др. (Январь 1988 г.). «Праймер-направленная ферментативная амплификация ДНК с помощью термостабильной ДНК-полимеразы». Наука. 239 (4839): 487–91. Bibcode:1988Научный ... 239..487С. Дои:10.1126 / science.239.4839.487. PMID 2448875.
- ^ Ченг С., Фоклер С., Барнс В.М., Хигучи Р. (июнь 1994 г.). «Эффективная амплификация длинных мишеней из клонированных вставок и геномной ДНК человека». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 91 (12): 5695–9. Bibcode:1994PNAS ... 91.5695C. Дои:10.1073 / пнас.91.12.5695. ЧВК 44063. PMID 8202550.
- ^ Чоу К., Рассел М., Берч Д.Е., Раймонд Дж., Блох В. (апрель 1992 г.). «Предотвращение неправильного прайминга перед ПЦР и димеризации праймеров улучшает амплификации с низким числом копий». Нуклеиновые кислоты Res. 20 (7): 1717–23. Дои:10.1093 / nar / 20.7.1717. ЧВК 312262. PMID 1579465.
- ^ Дон Р. Х., Кокс П. Т., Уэйнрайт Б. Дж., Бейкер К., Мэттик Дж. С. (июль 1991 г.). "'ПЦР Touchdown для предотвращения ложного праймирования во время амплификации гена ". Нуклеиновые кислоты Res. 19 (14): 4008. Дои:10.1093 / nar / 19.14.4008. ЧВК 328507. PMID 1861999.
- ^ Стеммер В.П., Крамери А., Ха К.Д., Бреннан Т.М., Хейнекер Х.Л. (1995). «Одностадийная сборка гена и всей плазмиды из большого количества олигодезоксирибонуклеотидов». Ген. 164 (1): 49–53. Дои:10.1016/0378-1119(95)00511-4. PMID 7590320.
- ^ Павлов А.Р., Павлова Н.В., Козявкин С.А., Слесарев А.И. (2006). «Термостабильные ДНК-полимеразы для широкого спектра применений: Сравнение надежного гибридного TopoTaq с другими ферментами». В Kieleczawa J (ред.). Секвенирование ДНК II: оптимизация подготовки и очистки. Джонс и Бартлетт. С. 241–257. ISBN 978-0-7637-3383-4.
- ^ Рауль, Д; Г Абудхарам; Э Крубези; G Larrouy; B Ludes; М. Дранкур (2000-11-07). «Молекулярная идентификация с помощью« самоубийственной ПЦР »Yersinia pestis как возбудителя средневековой черной смерти». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 97 (23): 12800–12803. Bibcode:2000PNAS ... 9712800R. Дои:10.1073 / pnas.220225197. ISSN 0027-8424. ЧВК 18844. PMID 11058154.
- ^ Андрович, Питер; Валихрах, Лукас; Эллинг, Джули; Шобак, Роберт; Кубиста, Микаэль (2017). «Двусторонняя RT-qPCR: новый метод высокоточного количественного определения miRNA». Исследования нуклеиновых кислот. 45 (15): e144. Дои:10.1093 / нар / gkx588. ISSN 0305-1048. ЧВК 5587787. PMID 28911110.
- ^ Mueller PR, Wold B (ноябрь 1989 г.). «Поступление in vivo мышечного специфического усилителя с помощью лигирования опосредованной ПЦР». Наука. 246 (4931): 780–6. Bibcode:1989Научный ... 246..780М. Дои:10.1126 / science.2814500. PMID 2814500.
- ^ Герман Дж. Г., Графф JR, Myöhänen S, Nelkin BD, Байлин С.Б. (Сентябрь 1996 г.). «Метилирование-специфическая ПЦР: новый ПЦР-анализ статуса метилирования CpG-островков». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 93 (18): 9821–6. Bibcode:1996PNAS ... 93.9821H. Дои:10.1073 / пнас.93.18.9821. ЧВК 38513. PMID 8790415.
- ^ Hernández, H; Це, МОЙ; Пан, Южная Каролина; Arboleda, H; Forero, DA (октябрь 2013 г.). «Оптимизация методик анализа метилирования ДНК на основе ПЦР». Биотехнологии. 55 (4): 181–197. Дои:10.2144/000114087. PMID 24107250.
- ^ Markoulatos, P; Сиафакас, Н; Монкань, М. (2002). «Мультиплексная полимеразная цепная реакция: практический подход». Журнал клинических лабораторных анализов. 16 (1): 47–51. Дои:10.1002 / jcla.2058. ЧВК 6808141. PMID 11835531.
- ^ Э. Зиткевич; А. Рафальски и Д. Лабуда (1994). «Фингерпринт генома путем амплификации полимеразной цепной реакции, закрепленной простым повторением последовательности (SSR)». Геномика. 20 (2): 176–83. Дои:10.1006 / geno.1994.1151. PMID 8020964.
- ^ Добосы Дж. Р., Роуз С. Д., Бельц К. Р., Рупп С. М., Пауэрс К. М., Бельке М. А., Вальдер Дж. А. (август 2011 г.). «РНКаза H-зависимая ПЦР (rhPCR): улучшенная специфичность и обнаружение однонуклеотидного полиморфизма с использованием блокированных расщепляемых праймеров». BMC Biotechnology. 11: 80. Дои:10.1186/1472-6750-11-80. ЧВК 3224242. PMID 21831278.
- ^ Венкитараман А.Р. (апрель 1989 г.). «Использование модифицированной ДНК-полимеразы Т7 (версия 2.0 секвеназы) для сайт-направленного мутагенеза олигонуклеотидов». Исследования нуклеиновых кислот. 17 (8): 3314. Дои:10.1093 / nar / 17.8.3314. ЧВК 317753. PMID 2726477.
- ^ «ДНК-полимераза термосеквеназы».
- ^ Юрист, F.C .; Stoffel, S .; Сайки, Р. К .; Chang, S. Y .; Ландре, П. А .; Abramson, R.D .; Гельфанд, Д. Х. (1993-05-01). «Высокий уровень экспрессии, очистки и ферментативной характеристики полноразмерной ДНК-полимеразы Thermus aquaticus и укороченной формы с недостаточностью экзонуклеазной активности от 5 'до 3'». Методы и применение ПЦР. 2 (4): 275–287. Дои:10.1101 / gr.2.4.275. ISSN 1054-9803. PMID 8324500.
- ^ «Прикладные биосистемы - Поддержка». www6.appliedbiosystems.com.
- ^ Виллбрандт, В; Собек, H; Фрей, B; Шомбург, Д. (сентябрь 2000 г.). «Обмен доменами: химеры ДНК-полимеразы Thermus aquaticus, ДНК-полимеразы I Escherichia coli и ДНК-полимеразы Thermotoga neapolitana». Белковая инженерия. 13 (9): 645–54. Дои:10.1093 / белок / 13.9.645. PMID 11054459.
- ^ https://www.promega.in/products/pcr/rt-pcr/tth-dna-polymerase/
- ^ Клайн Дж., Браман Дж. К., Hogrefe HH (сентябрь 1996 г.). «ПЦР-точность ДНК-полимеразы pfu и других термостабильных ДНК-полимераз». Нуклеиновые кислоты Res. 24 (18): 3546–51. Дои:10.1093 / nar / 24.18.3546. ЧВК 146123. PMID 8836181.
- ^ а б ван Пелт-Веркуил Э, ван Белкум А, Хейс JP (2008). «Taq и другие термостабильные ДНК-полимеразы». Принципы и технические аспекты амплификации ПЦР. С. 103–18. Дои:10.1007/978-1-4020-6241-4_7. ISBN 978-1-4020-6240-7.
- ^ Охман Х., Гербер А.С., Хартл Д.Л. (1 ноября 1988 г.). «Генетические применения обратной полимеразной цепной реакции». Генетика. 120 (3): 621–3. ЧВК 1203539. PMID 2852134.
- ^ Лю Ю.Г., Уиттиер РФ (февраль 1995 г.). «Термическая асимметричная чересстрочная ПЦР: автоматическая амплификация и секвенирование концевых фрагментов вставки из клонов P1 и YAC для ходьбы по хромосомам». Геномика. 25 (3): 674–81. Дои:10.1016 / 0888-7543 (95) 80010-J. PMID 7759102.
- ^ а б c «Изотермическое усиление - Обзор применения». New England BioLabs, Inc., 2020 г.. Получено 13 августа 2020.
- ^ Винсент М., Сюй И, Конг Х (август 2004 г.). «Геликазозависимая изотермическая амплификация ДНК». EMBO Rep. 5 (8): 795–800. Дои:10.1038 / sj.embor.7400200. ЧВК 1249482. PMID 15247927.
- ^ Нотоми Т., Окаяма Х., Масубучи Х., Ёнекава Т., Ватанабэ К., Амино Н., Хасэ Т. (2000). «Петлевая изотермическая амплификация ДНК». Нуклеиновые кислоты Res. 28 (12): 63e – 63. Дои:10.1093 / nar / 28.12.e63. ЧВК 102748. PMID 10871386.
- ^ Пипенбург О., Вильямс СН, Стемпл Д.Л., Армес Н.А. (2006). «Обнаружение ДНК с использованием рекомбинационных белков». ПЛОС Биол. 4 (7): e204. Дои:10.1371 / journal.pbio.0040204. ЧВК 1475771. PMID 16756388.
- ^ Лутц С., Вебер П., Фокке М., Фалтин Б., Хоффманн Дж., Мюллер С., Марк Д., Рот Г., Мандей П., Армес Н., Пипенбург О., Зенгерле Р., фон Стеттен Ф. (апрель 2010 г.). «Микрожидкостная лаборатория на фольге для анализа нуклеиновых кислот на основе изотермической рекомбиназной полимеразы амплификации (RPA)». Лабораторный чип. 10 (7): 887–93. Дои:10.1039 / b921140c. PMID 20300675.