WikiDer > Бафиломицин
 | |
| Имена | |
|---|---|
| Название ИЮПАК (3Z,5E,7р,8S,9S,11E,13E,15S,16р)-16- [(1S,2р,3S)-3-[(2р,4р,5S,6р) -2,4-дигидрокси-6-изопропил-5-метил-2-тетрагидропиранил] -2-гидрокси-1-метилбутил] -8-гидрокси-3,15-диметокси-5,7,9,11-тетраметил- 1-оксациклогексадека-3,5,11,13-тетраен-2-он | |
| Идентификаторы | |
| ЧЭМБЛ | |
| ChemSpider | |
| DrugBank | |
| ECHA InfoCard | 100.150.187 |
PubChem CID | |
| Характеристики | |
| C35ЧАС58О9 | |
| Молярная масса | 622,83 г / моль |
| Внешность | Желтый порошок |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
В бафиломицинs - семья макролидные антибиотики производится из различных Стрептомицеты. Их химическая структура определяется каркасом из 16-членного лактонового кольца.[2] Бафиломицины проявляют широкий спектр биологическая активность, в том числе противоопухолевые,[3] антипаразитарный,[4][5] иммунодепрессант[6] и противогрибковое[7] Мероприятия. Наиболее часто используемым бафиломицином является бафиломицин A1, мощный ингибитор клеточного аутофагия. Также было обнаружено, что бафиломицины действуют как ионофоры, транспортирующий калий K + через биологические мембраны и приводящий к митохондриальный повреждение и гибель клеток.[8]
Бафиломицин A1 специально нацелен на вакуолярный тип H+ -ATPase (V-АТФаза) фермент, протонный насос, охватывающий мембраны, который подкисляет либо внеклеточную среду, либо внутриклеточные органеллы, такие как лизосома. При более высоких микромолярных концентрациях бафиломицин A1 также действует на АТФазы P-типа, которые имеют фосфорилированное переходное состояние.[2]
Бафиломицин A1 служит важным средством во многих in vitro исследовательские приложения; однако его клиническое применение ограничено значительным профилем токсичности.[9]
Открытие и история
Бафиломицин A1, B1 и C1 были впервые выделены из Streptomyces griseus в 1983 г.[9] Во время скрининга, направленного на выявление вторичных метаболитов микробов, активность которых имитирует активность двух сердечные гликозиды, бафиломицин С1 был идентифицирован как ингибитор Р-АТФазы с kя 11 мкМ. Было обнаружено, что бафиломицин С1 обладает активностью против Caenorhabditis elegans, клещей и ленточных червей, помимо стимуляции высвобождения γ-аминобутируковой кислоты (ГАМК) от крысы синаптосомы. Самостоятельно бафиломицин А1 и другие производные были выделены из S. griseus и показано, что он обладает антибиотической активностью против некоторых дрожжей, грамположительных бактерий и грибов.[10] Также было показано, что бафиломицин A1 оказывает антипролиферативное действие на конканавалин-А-стимулированные Т-клетки. Однако его высокая токсичность не позволила использовать его в клинических испытаниях.[2]
Два года спустя бафиломицины D и E были также выделены из S. griseus. В 2010 году из эндофитного микроорганизма были идентифицированы 9-гидроксибафиломицин D, 29-гидроксибафиломицин D и ряд других бафиломицинов. Streptomyces sp. YIM56209.[11] В 2004-2011 гг. Бафиломицины F-K были изолированы от других Streptomyces sp.[9]
Как один из первых идентифицированных и наиболее часто используемых, бафиломицин A1 имеет особое значение, особенно потому, что его структура служит ядром всех других бафиломицинов. Благодаря своей большой структуре бафиломицин имеет несколько хиральные центры и функциональные группы, что затрудняет изменение его структуры - задача, которая была предпринята для снижения токсичности, связанной с соединением.[9]

Мишень бафиломицина
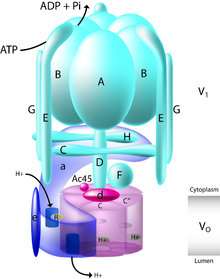
Внутри клетки бафиломицин A1 специфически взаимодействует с V-АТФазой протонной помпы. Этот большой белок зависит от Аденозинтрифосфат (АТФ) гидролиз для перекачки протонов через биологическую мембрану.[3] Когда в 1980-х годах были впервые обнаружены бафиломицин и другие ингибиторы V-АТФазы, такие как конканамицин, они были использованы для установления присутствия V-АТФазы в специализированных типах клеток и тканях, характеризующих распределение протонной помпы.[12] Структурно V-АТФаза состоит из 13 отдельных субъединиц, которые вместе составляют мембрану, охватывающую Vо и цитозольный V1 домены фермента.[3] V1 домен в цитозоле состоит из субъединиц от A до H, тогда как Vо домен состоит из субъединиц a, d, e, c и c ".[13]
Механизм действия V-ATPase
Чтобы переместить протоны через мембрану, протон сначала входит в субъединицу а внутри Vо домен через цитоплазматический гемиканал. Это позволяет сохранить глютаминовая кислота остатки в протеолипидном кольце Vо субъединицы c и c "протонируются. Аденозинтрифосфат (АТФ) затем гидролизуется V1 домен фермента, обеспечивающий как вращение центральной ножки насоса, состоящего из субъединиц D, F и d, так и вращение протеолипидного кольца. Это вращение приводит протонированные остатки глутаминовой кислоты в контакт с просветным гемиканалом, расположенным в субъединице а. В субъединице а аргинин остатки служат для стабилизации депротонированной формы глутаминовой кислоты и позволяют высвобождать их протоны. Это вращение и перенос протонов переносят протоны через насос и через мембрану.[3][13]
Взаимодействие бафиломицин-V-АТФазы
Более чем через десять лет после того, как бафиломицин был открыт как ингибитор V-АТФазы, место его взаимодействия с V-ATPase было неясным. В начальных исследованиях использовалась V-АТФаза хромаффинных гранул, чтобы предположить, что бафиломицин взаимодействует с Vо домен. Еще два исследования подтвердили эту гипотезу с использованием В-АТФазы крупного рогатого скота. везикулы, покрытые клатрином. Они показали, что применение бафиломицина ингибирует поток протонов через Vо и что это торможение можно преодолеть, добавив обратно букву Vо домен к покрытым везикулам. Дальнейшее сужение сайта взаимодействия с бафиломицином, они обнаружили, что специфическое добавление только Vо субъединица а могла восстановить функцию. Это предполагает, что бафиломицин специфически взаимодействует с субъединицей a V-АТФазы; однако другое исследование опровергло этот вывод. Группа обнаружила, что с помощью колонки для аффинной хроматографии с бафиломицином может быть очищена V-АТФаза, и что добавление DCCD, ингибитора Vо с, резко снижает сродство бафиломицина к V-АТФазе. Это говорит о том, что бафиломицин сильнее взаимодействует с субъединицей c Vо домен. Затем еще два исследования подтвердили это взаимодействие с использованием радиоактивной метки и кристаллизации белка. Однако далее было обнаружено, что аминокислотные изменения внутри субъединицы а могут также снижать взаимодействие V-АТФаза-бафиломицин, что указывает на второстепенную роль субъединицы а в связывании бафиломицина в дополнение к субъединице с.[12]
В целом бафиломицин с наномолярной эффективностью связывается с Vо c субъединица комплекса V-ATPase.[3] В частности, бафиломицин взаимодействует с протеолипидным кольцом Vо, ингибируя перемещение протонов.[13] Хотя взаимодействие между бафиломицином и V-АТФазой не является ковалентным, его низкая константа диссоциации около 10 нМ описывает силу его взаимодействия и может затруднить обратное действие бафиломицина.[14]
Локализация и функция V-АТФазы
V-АТФаза повсеместно присутствует в клетках млекопитающих и играет важную роль во многих клеточных процессах. Он локализован на сеть трансгольджи и клеточные органеллы, полученные из него, включая лизосомы, секреторные пузырьки и эндосомы.[15] V-АТФаза также может быть найдена в плазматическая мембрана. У млекопитающих расположение V-АТФазы может быть связано с конкретной изоформой субъединицы а, имеющейся в комплексе. Изоформы а1 и а2 нацелены на V-АТФазу внутриклеточно, к синаптическим пузырькам и эндосомам соответственно. Однако субъединицы a3 и a4 опосредуют локализацию V-АТФазы на плазматической мембране в остеокласты (а3) и почечные интеркалированные клетки (а4). Если он расположен на лизосомной мембране, это приводит к подкислению лизосомы, поскольку pH просвета снижается, что способствует активности лизосомальных гидролаз. Когда V-АТФаза расположена на плазматической мембране, экструзия протонов через насос вызывает закисление внеклеточного пространства, которое используется специализированными клетками, такими как остеокласты, эпидидимальные светлые клетки и интеркалированные клетки почечного эпителия.[3]
Внутриклеточная функция
Поскольку V-АТФаза способствует подкислению лизосом, эндосом и секреторных пузырьков, она участвует в таких процессах, как:
- везикулярный / белковый перенос
- переработка рецепторов
- эндоцитоз
- деградация белка
- аутофагия
- клеточная сигнализация
Благодаря своей роли в подкислении лизосом, V-АТФаза также играет решающую роль в управлении транспортом ионов и небольших молекул в цитоплазму, особенно кальция и аминокислот. Кроме того, его подкисление эндосом имеет решающее значение для эндоцитоза рецептора, поскольку низкий pH имеет тенденцию вызывать высвобождение лиганда, а также расщепление рецептора, которое способствует сигнальным событиям, например, посредством высвобождения внутриклеточного домена Notch.[3]
Функция плазменной мембраны
Находясь на плазматической мембране, функция V-АТФазы имеет решающее значение для подкисления внеклеточной среды, что наблюдается в остеокластах и прозрачных клетках придатка яичка. Находясь на плазматической мембране интеркалированных клеток почечного эпителия, V-АТФаза важна для секреции кислоты, которая способствует подкислению мочи. В ответ на снижение pH плазмы повышенные уровни V-АТФазы обычно переносятся к плазматической мембране в этих клетках путем фосфорилирования помпы посредством Протеинкиназа А (ПКА).[3]
V-АТФаза при болезни
Клинически дисфункция V-АТФазы коррелирует с несколькими заболеваниями человека. Некоторые из этих заболеваний включают: мужское бесплодие, остеопетрози почечный ацидоз.[12] Кроме того, V-АТФаза может быть обнаружена на плазматической мембране некоторых инвазивных раковых клеток, в том числе рака груди, простаты и печени. В образцах рака легких человека экспрессия V-АТФазы коррелировала с устойчивость к лекарству.[13] Большое количество мутаций субъединицы V-АТФазы также было идентифицировано при ряде видов рака, включая фолликулярные лимфомы.[3]
Клеточное действие бафиломицина
Поскольку мишень V-АТФазы бафиломицина участвует во многих аспектах клеточной функции, лечение бафиломицином значительно изменяет клеточные процессы.
Подавление аутофагии
Бафиломицин А1 наиболее известен как ингибитор аутофагии.[10][16] Аутофагия это процесс, при котором клетка разлагает свои собственные органеллы и некоторые белки путем образования аутофагосомы. Затем аутофагосомы сливаются с лизосомами, облегчая деградацию поглощенного груза лизосомными протеазами. Этот процесс имеет решающее значение для поддержания запасов аминокислот и других питательных веществ в клетке во время недостатка питательных веществ или других метаболических стрессов.[17] Бафиломицин вмешивается в этот процесс, подавляя закисление лизосом за счет взаимодействия с V-АТФазой. Отсутствие закисления лизосом препятствует активности лизосомальных протеаз, таких как катепсины так что захваченный груз больше не может деградировать.[16]

Поскольку V-АТФаза широко распространена в клетке, бафиломицин специфичен как ингибитор аутофагии только в течение короткого периода времени. За пределами этого короткого окна видны и другие эффекты, в том числе вмешательство в перемещение эндосом и протеасомное ингибирование.[16]
Сообщается, что помимо блокирования закисления лизосом, бафиломицин блокирует слияние аутофагосом с лизосомами.[10] Первоначально это было обнаружено в статье Ямамото и др. в котором авторы использовали бафиломицин A1 для лечения клеток гепатомы крысы H-4-II-E. К электронная микроскопия, они увидели блокировку слияния аутофагосома-лизосома после использования бафиломицина в концентрации 100 нМ в течение 1 часа. Это было подтверждено другими исследованиями, в частности двумя, в которых обнаружено уменьшение совместной локализации митохондрий и лизосом за счет флуоресцентная микроскопия после 12-24-часовой обработки 100 или 400 нМ бафиломицина. Однако дальнейшие исследования не показали этого ингибирования слияния с аналогичными препаратами бафиломицина. Эти противоречивые результаты объясняются разницей во времени между обработками, а также использованием разных клеточных линий. Действие бафиломицина на слияние аутофагосом и лизосом является сложным и зависит от времени в каждой клеточной линии.[8][18]
В нейроны, при лечении бафиломицином наблюдалось увеличение маркера аутофагосомы LC3-II. Это происходит, когда аутофагосомы не сливаются с лизосомами, что обычно стимулирует деградацию LC3-II.[19]
Индукция апоптоза
В Клетки PC12, было обнаружено, что бафиломицин индуцирует апоптоз, или запрограммированная гибель клеток.[14] Кроме того, в некоторых клеточных линиях было обнаружено нарушение электрохимический градиент митохондрий и вызывают высвобождение цитохром с, который является инициатором апоптоза.[8] Также было показано, что бафиломицин вызывает как ингибирование аутофагии, так и последующую индукцию апоптоза у остеосаркома клетки[20] а также другие линии раковых клеток.[3]
K+ транспорт
Бафиломицин действует как ионофор, то есть он может передавать K+ ионы через биологические мембраны.[12] Обычно внутренняя мембрана митохондрий не проницаема для K+ и поддерживает заданный электрохимический градиент. В возбудимых клетках митохондрии могут содержать K+ канал, который при открытии может вызвать митохондриальный стресс, вызывая набухание митохондрий, изменяя электрохимический градиент и стимулируя дыхание. Лечение бафиломицином A1 может вызвать набухание митохондрий в присутствии K+ ионы, стимулируют окисление пиримидиновых нуклеотидов и расщепляют окислительного фосфорилирования. Было обнаружено, что возрастающие концентрации бафиломицина линейно увеличивают количество K+ который прошел через митохондриальную мембрану, подтверждая, что он действует как ионофор. Однако по сравнению с другими ионофорами бафиломицин имеет низкое сродство к K+.[8]
Приложения для исследований
Противоопухолевый
Было обнаружено, что при многих формах рака активируются различные субъединицы V-АТФазы.[13] Повышенная регуляция этих субъединиц, по-видимому, коррелирует с увеличением опухолевых клеток. метастаз и снижение клинического исхода. Было показано, что применение бафиломицина снижает рост клеток в различных линиях раковых клеток при различных типах рака за счет индукции апоптоза. Кроме того, in vitro Антипролиферативный эффект бафиломицина, по-видимому, специфичен для раковых клеток по сравнению с нормальными клетками, что проявляется в избирательном ингибировании роста клеток гепатобластомы по сравнению со здоровыми гепатоцитами.[3]
Механизм, с помощью которого бафиломицин вызывает это специфическое для рака антипролиферативное действие, является многофакторным. Помимо индукции каспазозависимого апоптоза через митохондриальный путь, бафиломицин также вызывает повышение уровня активные формы кислорода и повышенная экспрессия HIF1alpha. Эти эффекты предполагают, что ингибирование V-АТФазы бафиломицином может вызывать клеточную стрессовую реакцию, включая аутофагию и возможный апоптоз. Эти несколько противоречивые эффекты ингибирования V-АТФазы с точки зрения ингибирования или индукции апоптоза демонстрируют, что функция бафиломицина критически зависит от клеточного контекста и может опосредовать либо фенотип, способствующий выживанию, либо смерть.[3][18]
В естественных условиях бафиломицин уменьшал средний объем опухоли в MCF-7 и MDA-MB-231 ксенотрансплантат мышиные модели на 50% и не показали токсических эффектов при дозировке 1 мг / кг. Кроме того, в сочетании с сорафениб, бафиломицин также вызывал регрессию опухоли у мышей с ксенотрансплантатом MDA-MB-231. В модели ортотропного ксенотрансплантата ГЦК HepG2 у мышей nude бафиломицин предотвращал рост опухоли.[3]
Считается, что нарушение регуляции V-АТФазы играет роль в устойчивости к терапии рака, поскольку аберрантное закисление внеклеточной среды может протонировать химиотерапевтические препараты, предотвращая их проникновение в клетку.[3][13] Неясно, является ли нарушение регуляции V-АТФазы прямой причиной связанного с этим неблагоприятного клинического исхода или же его нарушение в первую очередь влияет на реакцию на лечение. Хотя лечение бафиломицином и цисплатин имел синергетический влияние на цитотоксичность раковых клеток.[3]
Противогрибковое
Было показано, что бафиломицины ингибируют АТФазу плазматической мембраны (Р-АТФазу), а также АТФ-связывающая кассета (ABC) транспортеры. Эти переносчики считаются хорошими противогрибковыми мишенями, поскольку они делают организмы неспособными справиться с катионным стрессом.[7] Когда Криптококк neoformans лечили бафиломицином, наблюдали подавление роста.[21] Бафиломицин также использовался в С. neoformans в сочетании с кальциневрин ингибитор FK506, проявляющий синергетическую противогрибковую активность.[7]
Антипаразитарный
Было показано, что бафиломицин активен против Плазмодий falciparum, возбудитель малярии. При заражении красные кровяные тельца, P. falciparum экспортирует мембранную сеть в цитоплазму эритроцитов, а также вставляет несколько собственных белков в мембрану хозяина, включая свою собственную V-АТФазу. Этот протонный насос играет роль в поддержании внутриклеточного pH инфицированных красных кровяных телец и облегчении поглощения малых метаболитов в равновесии. Обработка паразитированных эритроцитов бафиломицином предотвращает внеклеточное закисление, вызывая падение внутриклеточного pH вокруг малярийного паразита.[4][5]
Иммунодепрессант
Воспалительная миопатия Миозит с включенными тельцами (IBM) относительно часто встречается у пациентов старше 50 лет и включает чрезмерную активацию аутофагического потока. В этом состоянии усиление аутофагии приводит к усилению деградации белка и, следовательно, к увеличению презентации антигенных пептидов в мышцах. Это может вызвать чрезмерную активацию иммунных клеток. Лечение бафиломицином может предотвратить закисление лизосом и, следовательно, аутофагию, уменьшая количество антигенных пептидов, перевариваемых и отображаемых иммунной системой.[6]
В Волчанка У пациентов было обнаружено, что путь аутофагии изменен как в B-, так и в T-клетках. В частности, в Т-клетках было обнаружено больше аутофагических вакуолей, а также усиление окрашивания LC3-11 на аутофагосомы, что указывает на усиление аутофагии. Повышенная аутофагия также наблюдается у наивных субпопуляций В-клеток пациентов. Лечение бафиломицином A1 снизило дифференцировку плазмобласты и уменьшили их выживаемость.[22]
Клиренс белковых агрегатов при нейродегенеративных заболеваниях
Нейродегенеративные заболевания обычно обнаруживают повышенные уровни агрегатов белка в клетке, которые способствуют дисфункции нейронов и, в конечном итоге, гибели нейронов. В качестве метода расщепления белка внутри клетки аутофагия может передавать эти белковые агрегаты для разложения в лизосоме. Хотя неясно, какая именно роль непрерывной аутофагии или аутофагического потока играет в нейрональном гомеостазе и болезненных состояниях, было показано, что аутофагическая дисфункция может наблюдаться при нейродегенеративных заболеваниях.[19]
Бафиломицин обычно используется для изучения этого аутофагического потока в нейронах, среди других типов клеток. Для этого нейроны сначала помещаются в условия, богатые питательными веществами, а затем в условия нехватки питательных веществ, чтобы стимулировать аутофагию. Бафиломицин вводят совместно в условиях стресса, связанного с питанием, так что при стимуляции аутофагии бафиломицин блокирует свою последнюю стадию слияния аутофагосом и лизосом, что приводит к накоплению аутофагосом. Затем можно контролировать уровни белков, связанных с аутофагией, связанных с аутофагосомами, таких как LC3, для определения уровня образования аутофагосом, вызванного недостатком питательных веществ.[19]
В пробирке Лекарственные взаимодействия
Лизосомотропные препараты
Некоторые катионные препараты, такие как хлорохин и сертралин, известны как лизосомотропные препараты. Эти препараты представляют собой слабые основания, которые протонируются в кислой среде лизосомы. Это улавливает непротонированное соединение внутри лизосомы, поскольку протонирование предотвращает его прохождение обратно через липидную мембрану органеллы. Это явление известно как ионный захват. Улавливание катионного соединения также втягивает воду в лизосомы за счет осмотического эффекта, что иногда может приводить к вакуолизация видел в in vitro культивируемые клетки.[15][23]
Когда один из этих препаратов применяется к клеткам совместно с бафиломицином A1, действие бафиломицина A1 предотвращает закисление лизосомы, тем самым предотвращая явление захвата ионов в этом компартменте.[23] Поскольку лизосома не может подкисляться, лизосомотропные лекарственные средства не протонируются и не захватываются лизосомами в присутствии бафиломицина. Кроме того, когда клетки предварительно загружены лизосомотропными препаратами in vitro, затем обработанный бафиломицином, бафиломицин высвобождает катионное соединение из его накопления в лизосоме.[15]
Предварительная обработка клеток бафиломицином перед введением катионного лекарственного средства может изменить кинетику катионного соединения. В тесте сократимости кролика бафиломицин использовали для предварительной обработки изолированного кролика. аорта. Липофильный агент ксилометазолин, агонист альфа-адренорецепторов, проявлял повышенный эффект при введении после лечения бафиломицином. При использовании бафиломицина наблюдалось более быстрое сокращение и расслабление аорты, поскольку бафиломицин предотвращал захват ионов ксилометазолина в лизосомах. Без предварительной обработки бафиломицином функциональная V-АТФаза заставляет лизосомы становиться резервуаром для ксилометазолина, замедляя его влияние на сократимость.[15]
Хлорохин
В качестве лизосомотропного препарата хлорохин обычно накапливается в лизосомах, нарушая их функцию деградации, ингибируя аутофагию и вызывая апоптоз через Bax-зависимые механизмы. Однако в культивируемых зернистых нейронах мозжечка (CGN) низкая обработка бафилломицином в концентрации 1 нМ снижала индуцированный хлорохином апоптоз, не влияя на ингибирование хлорохином аутофагии. Точный механизм этой защиты неизвестен, хотя предполагается, что он находится ниже по течению от слияния аутофагосома-лизосома, но выше индукции апоптоза Bax.[10]
Химиотерапия
Было показано, что бафиломицин усиливает действие таксол в уменьшении Матрикс металлопротеиназа (MMP) за счет снижения митохондриальной защитной роли Bcl-xL. Кроме того, в цисплатин Было обнаружено, что в устойчивых клетках экспрессия V-АТФазы повышается, а совместная обработка бафиломицином и цисплатином повышала чувствительность этих клеток к цитотоксичности, индуцированной цисплатином.[3] Также было показано, что бафиломицин увеличивает эффективность Ингибиторы EGFR в противораковых приложениях.[24]
Рекомендации
- ^ Страница продукта Бафиломицин А1 из Ферментек
- ^ а б c Dröse S, Altendorf K (январь 1997 г.). «Бафиломицины и конканамицины как ингибиторы V-ATPases и P-ATPases». Журнал экспериментальной биологии. 200 (Чт 1): 1–8. PMID 9023991.
- ^ а б c d е ж грамм час я j k л м п о п Уиттон Б., Окамото Х., Пакхэм Дж., Крабб С.Дж. (август 2018 г.). «Вакуолярная АТФаза как потенциальная терапевтическая мишень и медиатор резистентности к лечению рака». Онкология. 7 (8): 3800–3811. Дои:10.1002 / cam4.1594. ЧВК 6089187. PMID 29926527.
- ^ а б Хаяси М., Ямада Х., Митамура Т., Хории Т., Ямамото А., Морияма Ю. (ноябрь 2000 г.). «Вакуолярная H (+) - АТФаза, локализованная в плазматических мембранах клеток паразита малярии, Plasmodium falciparum, участвует в региональном подкислении паразитированных эритроцитов». Журнал биологической химии. 275 (44): 34353–8. Дои:10.1074 / jbc.M003323200. PMID 10915784.
- ^ а б Марчезини Н., Виейра М., Луо С., Морено С.Н., Докампо Р. (ноябрь 2005 г.). «Закодированная малярийными паразитами вакуолярная H (+) - АТФаза нацелена на эритроцит хозяина». Журнал биологической химии. 280 (44): 36841–7. Дои:10.1074 / jbc.M507727200. PMID 16135514.
- ^ а б Келлер К. В., Шмидт Дж., Люнеманн Дж. Д. (июнь 2017 г.). «Иммунные и миодегенеративные патомеханизмы при миозите с тельцами включения». Анналы клинической и трансляционной неврологии. 4 (6): 422–445. Дои:10.1002 / acn3.419. ЧВК 5454400. PMID 28589170.
- ^ а б c Майерс Д (2008). Справочник по устойчивости к противомикробным препаратам. Том 2, Клинико-эпидемиологические аспекты. Тотова, Нью-Джерси: Humana. ISBN 9781603275958. OCLC 437345683.
- ^ а б c d Сарис Н.Е., Андерссон М.А., Миккола Р., Андерссон Л.С., Теплова В.В., Григорьев П.А., Салкиноя-Салонен М.С. (август 2009 г.). «Влияние микробного токсина на выживаемость митохондрий за счет увеличения поглощения K +». Токсикология и промышленное здоровье. 25 (7): 441–6. Дои:10.1177/0748233709103405. PMID 19736254. S2CID 30966042.
- ^ а б c d Ли З, Ду Л, Чжан В., Чжан Х, Цзян И, Лю К., Мэн П, Сю Х, Фортман Дж. Л., Шерман Д.Х., Ю Б, Гао С., Ли С. (апрель 2017 г.). "Streptomyces lohii". Журнал биологической химии. 292 (17): 7095–7104. Дои:10.1074 / jbc.M116.751255. ЧВК 5409476. PMID 28292933.
- ^ а б c d Шака Дж. Дж., Клок Б. Дж., Рот К. А. (2006). «Аутофагия, бафиломицин и гибель клеток:« a-B-cs »нейропротекции, вызванной плекомакролидом». Аутофагия. 2 (3): 228–30. Дои:10.4161 / авто.2703. PMID 16874105.
- ^ а б Ю З, Чжао LX, Цзян К.Л., Дуань И, Вонг Л., Карвер К.С., Шулер Л.А., Шен Б. (январь 2011 г.). «Бафиломицины, продуцируемые эндофитным актиномицетом Streptomyces sp. YIM56209». Журнал антибиотиков. 64 (1): 159–62. Дои:10.1038 / ja.2010.147. ЧВК 5592157. PMID 21102599.
- ^ а б c d Huss M, Wieczorek H (февраль 2009 г.). «Ингибиторы В-АТФаз: старые и новые игроки». Журнал экспериментальной биологии. 212 (Pt 3): 341–6. Дои:10.1242 / jeb.024067. PMID 19151208.
- ^ а б c d е ж Коттер К., Странски Л., Макгуайр С., Форгак М. (октябрь 2015 г.). «Недавние исследования структуры, регуляции и функции V-ATPases». Тенденции в биохимических науках. 40 (10): 611–622. Дои:10.1016 / j.tibs.2015.08.005. ЧВК 4589219. PMID 26410601.
- ^ а б Вайс О.А. (01.01.2003). «Подкисление и белковый трафик». Международный обзор цитологии. 226: 259–319. Дои:10.1016 / S0074-7696 (03) 01005-2. ISBN 9780123646309. PMID 12921239.
- ^ а б c d Марсо Ф., Баволак М. Т., Лодж Р., Бутилье Дж., Ганье-Хенли А., Годро Р. К., Мориссетт Г. (февраль 2012 г.). «Улавливание катионов кислотными компартментами клетки: за пределами концепции лизосомотропных препаратов». Токсикология и прикладная фармакология. 259 (1): 1–12. Дои:10.1016 / j.taap.2011.12.004. HDL:20.500.11794/15930. PMID 22198553.
- ^ а б c Винод В., Падмакришнан С.Дж., Виджаян Б., Гопала С. (апрель 2014 г.). "'Как я могу остановить тебя? Загадки, связанные с аутофагическим торможением ». Фармакологические исследования. 82: 1–8. Дои:10.1016 / j.phrs.2014.03.005. PMID 24657238.
- ^ Даффи А., Ле Дж., Сосвилл Е., Эмади А. (март 2015 г.). «Модуляция аутофагии: цель для разработки лечения рака». Химиотерапия и фармакология рака. 75 (3): 439–47. Дои:10.1007 / s00280-014-2637-z. PMID 25422156. S2CID 24642257.
- ^ а б Клионский DJ, Элазар З., Сеглен П.О., Рубинштейн, округ Колумбия (октябрь 2008 г.). «Блокирует ли бафиломицин A1 слияние аутофагосом с лизосомами?». Аутофагия. 4 (7): 849–50. Дои:10.4161 / авто.6845. PMID 18758232.
- ^ а б c Lumkwana D, du Toit A, Kinnear C, Loos B (июнь 2017 г.). «Контроль аутофагического потока при нейродегенерации: прогресс и точность нацеливания - Где мы находимся?». Прогресс в нейробиологии. 153: 64–85. Дои:10.1016 / j.pneurobio.2017.03.006. PMID 28385648. S2CID 3811723.
- ^ Се З, Се Y, Сюй Y, Чжоу Х, Сюй В., Дун Цюй (август 2014 г.). «Бафиломицин A1 подавляет аутофагию и индуцирует апоптоз в клетках остеосаркомы MG63». Отчеты по молекулярной медицине. 10 (2): 1103–7. Дои:10.3892 / mmr.2014.2281. PMID 24890793.
- ^ Вебер С.М., Левитц С.М., Харрисон Т.С. (август 2000 г.). «Хлорохин и грибковая фагосома». Текущее мнение в микробиологии. 3 (4): 349–53. Дои:10.1016 / S1369-5274 (00) 00102-8. PMID 10972492.
- ^ Muller S, Brun S, René F, de Sèze J, Loeffler JP, Jeltsch-David H (август 2017 г.). «Аутофагия при нейровоспалительных заболеваниях». Отзывы об аутоиммунности. 16 (8): 856–874. Дои:10.1016 / j.autrev.2017.05.015. PMID 28572049.
- ^ а б Кузу О.Ф., Топрак М., Нори М.А., Робертсон Г.П. (март 2017 г.).«Влияние лизосомотропных молекул на гомеостаз клетки». Фармакологические исследования. 117: 177–184. Дои:10.1016 / j.phrs.2016.12.021. PMID 28025106. S2CID 207368923.
- ^ Раванан П., Срикумар И.Ф., Талвар П. (ноябрь 2017 г.). «Аутофагия: в центре внимания реакции клеток на стресс». Науки о жизни. 188: 53–67. Дои:10.1016 / j.lfs.2017.08.029. PMID 28866100.