WikiDer > Аминооксиуксусная кислота
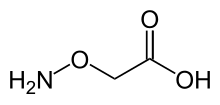 | |
| Имена | |
|---|---|
| Название ИЮПАК 2- (аминоокси) уксусная кислота | |
| Другие имена Карбоксиметоксиламин Гидроксиламинуксусная кислота U-7524 | |
| Идентификаторы | |
3D модель (JSmol) | |
| ЧЭМБЛ | |
| ChemSpider | |
| DrugBank | |
| MeSH | Аминооксиуксусная кислота + кислота |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C2ЧАС5НЕТ3 | |
| Молярная масса | 91.066 |
| Плотность | 1,375 г / см3 |
| Температура плавления | 138 ° С (280 ° F, 411 К) |
| Точка кипения | 326,7 ° С (620,1 ° F, 599,8 К) |
| Опасности | |
| точка возгорания | 151 ° С (304 ° F, 424 К) |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Аминооксиуксусная кислота, часто сокращенно АОА или же AOAA, представляет собой соединение, которое ингибирует 4-аминобутират аминотрансфераза (ГАМК-Т) активность in vitro и in vivo, что приводит к меньшему гамма-аминомасляная кислота (ГАМК) ломается.[1] Впоследствии уровень ГАМК увеличивается в ткани. В концентрациях, достаточно высоких, чтобы полностью ингибировать активность 4-аминобутиратаминотрансферазы, аминооксиуксусная кислота показана как полезный инструмент для изучения регионального обмена ГАМК в крысы.[2]
Аминооксиуксусная кислота является общим ингибитором пиридоксальфосфат (PLP) -зависимый ферменты (включая ГАМК-Т).[3] Он действует как ингибитор, атакуя База Шиффа связь между PLP и ферментом, образуя оксим типовые комплексы.[3]
Аминооксиуксусная кислота подавляет аспартатаминотрансфераза, еще один PLP-зависимый фермент, который является важной частью малат-аспартатный челнок.[4] Ингибирование челнока малат-аспартат предотвращает повторное окисление цитозольного НАДН посредством митохондрии в нервных окончаниях.[4] Также в нервных окончаниях аминооксиуксусная кислота препятствует утилизации митохондриями пируват генерируется из гликолиз, что привело к биоэнергетический состояние, подобное тому из гипогликемия.[4] Было показано, что аминооксиуксусная кислота вызывает: эксайтотоксический поражения из полосатое тело, похожий на болезнь Хантингтона, возможно, из-за нарушения митохондриального энергетического метаболизма.[5] Аминооксиуксусная кислота ранее использовалась в клинических испытаниях для уменьшения симптомов болезни Хантингтона за счет повышения уровня ГАМК в головном мозге.[6] Однако у пациентов, получавших лечение аминооксиуксусной кислотой, не наблюдалось клинического улучшения, и они страдали от побочные эффекты Такие как сонливость, атаксия, припадки, и психотическое поведение когда дозировка была увеличена более чем на 2 мг на килограмм в день.[6] Кроме того, ингибирование аспартатаминотрансферазы аминооксиуксусной кислотой имеет клинические последствия для лечения рак молочной железы, так как снижение гликолиза нарушает работу груди аденокарцинома клеток больше, чем нормальных клеток.[7]
Более того, селективное ингибирование аспартатаминотрансферазы аминооксиуксусной кислотой улучшило экспериментальные аутоиммунный энцефаломиелит в терапевтической модели мыши путем перепрограммирования дифференциации провоспалительных Т-хелпер 17 клеток, которые укрепляют иммунную систему и вызывают противовоспалительные регуляторные Т-клетки.[8]
Аминооксиуксусная кислота изучалась для лечения тиннитус.[9][10][11] Одно исследование показало, что около 20% пациентов с тиннитусом уменьшили его тяжесть при лечении аминооксиуксусной кислотой.[11] Однако около 70% этих пациентов сообщили о побочных эффектах, в основном тошнота и нарушение равновесия.[11] Таким образом, исследователи пришли к выводу, что частота возникновения побочных эффектов делает аминооксиуксусную кислоту непригодной для лечения шума в ушах.[11]
Аминооксиуксусная кислота также имеет противосудорожное средство характеристики.[12] В высоких дозах он может действовать как судорожный агент у мышей и крыс.[13]
Аминооксиуксусная кислота также может ингибировать 1-аминоциклопропан-1-карбоксилатсинтаза предотвращение этилен синтез, который может увеличить ваза жизнь из срезанные цветы.[14]
История
Аминооксиуксусная кислота была впервые описана Вернер в 1893 г. и был получен гидролизом этилбензгидроксиминоуксусной кислоты.[15][16][17][18] В 1936 году Анчел и Shoenheimer использовали аминооксиуксусную кислоту для выделения кетоны из природных источников.[17] Также в 1936 году Китагава и Такани описали получение аминооксиуксусной кислоты конденсацией бензгидроксамовой кислоты и этилбромацетатс последующим гидролизом соляная кислота.[19]
Рекомендации
- ^ Валлах, Д. (1961). «Исследования пути ГАМК. I. Ингибирование трансаминазы гамма-аминомасляной кислоты-альфа-кетоглутаровой кислоты in vitro и in vivo с помощью U-7524 (амино-оксиуксусной кислоты)». Биохимическая фармакология. 5 (4): 323–331. Дои:10.1016/0006-2952(61)90023-5. PMID 13782815.
- ^ Вольфганг Лёшер; Дагмар Хёнак; Мартина Грамер (1989). «Использование ингибиторов трансаминазы γ-аминомасляной кислоты (ГАМК) для оценки обмена ГАМК в различных областях мозга крыс: переоценка аминооксиуксусной кислоты». Журнал нейрохимии. 53 (6): 1737–1750. Дои:10.1111 / j.1471-4159.1989.tb09239.x. PMID 2809589.
- ^ а б Билер, Т .; Черчич, Дж. (1976). «Реакционная способность фосфопиридоксальных групп цистатионазы». Журнал биологической химии. 251 (17): 5267–5271. PMID 8458.
- ^ а б c Ристо А. Кауппинен; Талвиндер С. Сихра; Дэвид Г. Николлс (1987). «Аминооксиуксусная кислота ингибирует челнок малат-аспартат в изолированных нервных окончаниях и не позволяет митохондриям использовать гликолитические субстраты». Biochimica et Biophysica Acta (BBA) - Исследование молекулярных клеток. 930 (2): 173–178. Дои:10.1016/0167-4889(87)90029-2. PMID 3620514.
- ^ Бил, М .; Swartz, K .; Hyman, B .; Стори, Э .; Finn, S .; Корошец, В. (1991). «Аминооксиуксусная кислота вызывает эксайтотоксиновые поражения по новому косвенному механизму». Журнал нейрохимии. 57 (3): 1068–1073. Дои:10.1111 / j.1471-4159.1991.tb08258.x. PMID 1830613.
- ^ а б Perry, T .; Wright, J .; Hansen, S .; Allan, B .; Baird, P .; МакЛауд, П. (1980). «Неудача терапии аминооксиуксусной кислотой при болезни Гентингтона». Неврология. 30 (7, ч. 1): 772–775. Дои:10.1212 / wnl.30.7.772. PMID 6446691. S2CID 10190223.
- ^ Thornburg, J.M .; Нельсон, К. К .; Clem, B. F .; Lane, A.N .; Arumugam, S .; Simmons, A .; Eaton, J. W .; Telang, S .; Чесни, Дж. (2008). «Нацеливание на аспартатаминотрансферазу при раке груди». Исследование рака груди. 10 (5): R84. Дои:10.1186 / bcr2154. ЧВК 2614520. PMID 18922152.
- ^ Xu, T .; Келли, М .; эт, все. (2017). «Метаболический контроль TH17 и индуцированный баланс клеток Treg с помощью эпигенетического механизма». Природа. 548 (7666): 228–233. Bibcode:2017Натура.548..228X. Дои:10.1038 / природа23475. ЧВК 6701955. PMID 28783731.
- ^ Рид, H .; Meltzer, J .; Экипажи, П .; Norris, C .; Куайн, Д .; Гут, П. (1985). «Амино-оксиуксусная кислота как паллиативное средство при звоне в ушах». Архив отоларингологии. 111 (12): 803–805. Дои:10.1001 / archotol.1985.00800140047008. PMID 2415097.
- ^ Blair, P .; Рид, Х. (1986). «Амино-оксиуксусная кислота: новый препарат для лечения шума в ушах». Журнал Медицинского общества штата Луизиана. 138 (6): 17–19. PMID 3734755.
- ^ а б c d Guth, P .; Risey, J .; Briner, W .; Blair, P .; Рид, H .; Bryant, G .; Norris, C .; Housley, G .; Миллер, Р. (1990). «Оценка амино-оксиуксусной кислоты как паллиативного средства при тиннитусе». Анналы отологии, ринологии и ларингологии. 99 (1): 74–79. Дои:10.1177/000348949009900113. PMID 1688487. S2CID 7789128.
- ^ Davanzo, J .; Greig, M .; Кронин, М. (1961). «Противосудорожные свойства аминооксиуксусной кислоты». Американский журнал физиологии. 201 (5): 833–837. Дои:10.1152 / ajplegacy.1961.201.5.833. PMID 13883717.
- ^ Wood, J .; Пескер, С. (1973). «Роль метаболизма ГАМК в судорожном и противосудорожном действии аминооксиуксусной кислоты». Журнал нейрохимии. 20 (2): 379–387. Дои:10.1111 / j.1471-4159.1973.tb12137.x. PMID 4698285.
- ^ Broun, R .; Маяк, С. (1981). «Аминооксиуксусная кислота как ингибитор этиленсинтеза и старения в цветках гвоздики». Scientia Horticulturae. 15 (3): 277–282. Дои:10.1016/0304-4238(81)90038-8.
- ^ Вернер, А. (1893). "Ueber Hydroxylaminessigsäure und Derivate derselben". Berichte der deutschen chemischen Gesellschaft. 26 (2): 1567–1571. Дои:10.1002 / cber.18930260274.
- ^ Werner, A .; Зонненфельд, Э. (1894). "Ueber Hydroxylaminessigsäure und α-Hydroxylaminpropionsäure". Berichte der Deutschen Chemischen Gesellschaft. 27 (3): 3350–3354. Дои:10.1002 / cber.189402703141.
- ^ а б Анчел, Марджори; Шёнхаймер, Рудольф (1936). «Реагенты для выделения карбонильных соединений из неомыляемого материала» (PDF). Журнал биологической химии. 114 (2): 539–546. Получено 2011-05-20.
- ^ Borek, E .; Кларк, Х. Т. (1936). «Карбоксиметоксиламин». Журнал Американского химического общества. 58 (10): 2020–2021. Дои:10.1021 / ja01301a058.
- ^ Китагава, Мацуносукэ; Такани, А. (1936). «Исследования диаминокислоты, канаванина, IV. Конституция канаванина и каналина». Журнал биохимии. 23: 181–185. Дои:10.1093 / oxfordjournals.jbchem.a125537.