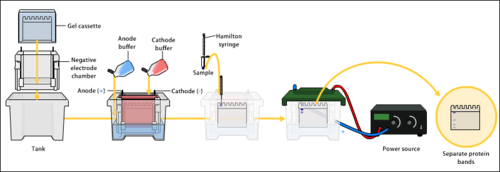
WikiDer > Гель-электрофорез
 Аппарат для гель-электрофореза - в этот заполненный буфером ящик помещается агарозный гель и через блок питания к задней части подается электрический ток. Отрицательный вывод находится на дальнем конце (черный провод), поэтому ДНК перемещается к положительно заряженному аноду (красный провод). | |
| Классификация | Электрофорез |
|---|---|
| Другие техники | |
| Связанный | Капиллярный электрофорез SDS-СТРАНИЦА Двумерный гель-электрофорез Гель-электрофорез в градиенте температуры |
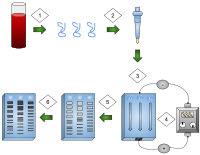
1) ДНК извлекается.
2) Выделение и амплификация ДНК.
3) ДНК добавляли в лунки геля.
4) Электрический ток, приложенный к гелю.
5) Полосы ДНК разделены по размеру.
6) полосы ДНК окрашиваются.
Гель-электрофорез это метод разделения и анализа макромолекул (ДНК, РНК и белки) и их фрагменты в зависимости от их размера и заряда. Он используется в клинической химии для разделения белков по заряду или размеру (агароза IEF, практически не зависит от размера) и в биохимия и молекулярная биология для разделения смешанной популяции фрагментов ДНК и РНК по длине, оценки размера фрагментов ДНК и РНК или разделения белков по заряду.[1]
Молекулы нуклеиновой кислоты разделяют с помощью электрическое поле перемещать отрицательно заряженные молекулы через матрицу агароза или другие вещества. Более короткие молекулы движутся быстрее и мигрируют дальше, чем более длинные, потому что более короткие молекулы легче мигрируют через поры геля. Это явление называется просеиванием.[2] Белки разделяются зарядом в агарозе, потому что поры геля слишком малы для просеивания белков. Гель-электрофорез также можно использовать для разделения наночастицы.
Гель-электрофорез использует гель в качестве противоконвективной среды или просеивающей среды во время электрофореза, движения заряженной частицы в электрическом токе. Гели подавляют тепловую конвекцию, вызванную приложением электрического поля, а также могут действовать как просеивающая среда, задерживая прохождение молекул; Гели также могут просто служить для поддержания окончательного разделения, чтобы можно было нанести окраску после электрофореза.[3] Электрофорез ДНК в геле обычно выполняется в аналитических целях, часто после амплификации ДНК через полимеразной цепной реакции (ПЦР), но может использоваться в качестве препаративного метода перед использованием других методов, таких как масс-спектрометрии, RFLP, ПЦР, клонирование, Секвенирование ДНК, или же Саузерн-блоттинг для дальнейшей характеристики.
Физическая основа
Электрофорез это процесс, который позволяет сортировать молекулы по размеру. С помощью электрического поля молекулы (например, ДНК) можно заставить двигаться через гель, состоящий из агароза или же полиакриламид. Электрическое поле состоит из отрицательного заряда на одном конце, который проталкивает молекулы через гель, и положительного заряда на другом конце, который протягивает молекулы через гель. Сортируемые молекулы распределяются в лунку гелевого материала. Гель помещают в камеру для электрофореза, которая затем подключается к источнику питания. При приложении электрического поля молекулы большего размера движутся через гель медленнее, а молекулы меньшего размера - быстрее. Молекулы разного размера образуют четкие полосы на геле.[4]
Период, термин "гель"в данном случае относится к матрице, используемой для содержания, а затем разделения целевых молекул. В большинстве случаев гель представляет собой сшитый полимер состав и пористость которого выбираются в зависимости от удельного веса и состава анализируемой мишени. При разделении белки или маленький нуклеиновые кислоты (ДНК, РНК, или же олигонуклеотиды) гель обычно состоит из разных концентраций акриламид и сшивающий агент, производящие сетку из полиакриламида разного размера. При разделении более крупных нуклеиновых кислот (более нескольких сотен базы), предпочтительной матрицей является очищенная агароза. В обоих случаях гель образует твердую, но пористую матрицу. Акриламид, в отличие от полиакриламида, представляет собой нейротоксин и при обращении с ним необходимо соблюдать соответствующие меры безопасности, чтобы избежать отравления. Агароза состоит из длинных неразветвленных цепей незаряженного углевода без поперечных связей, в результате чего образуется гель с большими порами, позволяющими разделять макромолекулы и макромолекулярные комплексы.[5]
Электрофорез относится к электродвижущая сила (ЭДС), который используется для перемещения молекул через матрицу геля. Помещая молекулы в лунки геля и прикладывая электрическое поле, молекулы будут перемещаться через матрицу с разными скоростями, в значительной степени определяемыми их массой, когда отношение заряда к массе (Z) всех частиц однородно. Однако, когда заряды не все однородны, электрическое поле, генерируемое процедурой электрофореза, заставит молекулы перемещаться по-разному в зависимости от заряда. Виды, которые имеют чистый положительный заряд, будут мигрировать к катод который заряжен отрицательно (потому что это электролитический скорее, чем гальванический элемент), тогда как частицы с отрицательным зарядом будут мигрировать к положительно заряженному аноду. Масса остается фактором скорости, с которой эти неоднородно заряженные молекулы мигрируют через матрицу к соответствующим электродам.[6]
Если несколько образцов были загружены в соседние лунки геля, они будут проходить параллельно по отдельным дорожкам. В зависимости от количества различных молекул каждая дорожка показывает разделение компонентов из исходной смеси в виде одной или нескольких отдельных полос, по одной полосе на компонент. Неполное разделение компонентов может привести к наложению полос или неразличимым размытиям, представляющим несколько неразрешенных компонентов.[нужна цитата] Полосы на разных дорожках, которые оказываются на одинаковом расстоянии от вершины, содержат молекулы, которые проходят через гель с одинаковой скоростью, что обычно означает, что они примерно одинакового размера. Есть маркеры размера молекулярной массы доступны, которые содержат смесь молекул известных размеров. Если такой маркер был нанесен на одну дорожку в геле параллельно с неизвестными образцами, наблюдаемые полосы можно сравнить с полосами неизвестного образца, чтобы определить их размер. Расстояние, которое проходит полоса, приблизительно обратно пропорционально логарифму размера молекулы.[нужна цитата]
Электрофоретические методы имеют ограничения. Поскольку прохождение тока через гель вызывает нагревание, гели могут плавиться во время электрофореза. Электрофорез проводится в буферных растворах, чтобы уменьшить изменения pH из-за электрического поля, что важно, потому что заряд ДНК и РНК зависит от pH, но слишком долгая работа может истощить буферную способность раствора. Также существуют ограничения при определении молекулярной массы с помощью SDS-PAGE, особенно при попытке найти молекулярную массу неизвестного белка. Некоторые биологические переменные трудно или невозможно минимизировать, и они могут повлиять на электрофоретическую миграцию. Такие факторы включают структуру белка, посттрансляционные модификации и аминокислотный состав. Например, тропомиозин представляет собой кислый белок, который аномально мигрирует в гелях SDS-PAGE. Это связано с тем, что кислотные остатки отталкиваются отрицательно заряженным SDS, что приводит к неточному соотношению массы к заряду и миграции.[7] Кроме того, разные препараты генетического материала могут не мигрировать согласованно друг с другом по морфологическим или другим причинам.
Виды геля
Чаще всего используются гели агарозы и полиакриламида. Каждый тип геля хорошо подходит для разных типов и размеров аналита. Полиакриламидные гели обычно используются для белков и обладают очень высокой разрешающей способностью для небольших фрагментов ДНК (5-500 п.н.). С другой стороны, агарозные гели имеют более низкую разрешающую способность для ДНК, но имеют больший диапазон разделения, и поэтому используются для фрагментов ДНК размером обычно 50–20 000 п.н., но разрешение более 6 МБ возможно с гель-электрофорез в импульсном поле (PFGE).[8] Гели полиакриламида работают в вертикальной конфигурации, в то время как гели агарозы обычно работают горизонтально в подводном режиме. Они также различаются по методике литья, так как агароза схватывается термически, а полиакриламид образуется в результате химической реакции полимеризации.
Агароза
Гели агарозы изготовлены из натуральных полисахарид полимеры извлечен из водоросли. Гели агарозы легко отливать и обрабатывать по сравнению с другими матрицами, потому что схватывание геля является физическим, а не химическим изменением. Образцы также легко восстанавливаются. После окончания эксперимента полученный гель можно хранить в полиэтиленовом пакете в холодильнике.
Гели агарозы не имеют однородного размера пор, но оптимальны для электрофореза белков, размер которых превышает 200 кДа.[9] Электрофорез в агарозном геле также можно использовать для разделения фрагментов ДНК от 50 базовая пара до нескольких мегабаз (миллионов баз), самые большие из которых требуют специализированного оборудования. Расстояние между полосами ДНК разной длины зависит от процента агарозы в геле, при этом более высокие проценты требуют более длительного времени анализа, иногда дней. Вместо этого гели с высоким процентным содержанием агарозы следует запускать с электрофорез в импульсном поле (PFE), или электрофорез с инверсией поля.
«Большинство агарозных гелей состоит из от 0,7% (хорошее разделение или разрешение больших фрагментов ДНК размером 5–10 килобайт) до 2% (хорошее разрешение для небольших фрагментов 0,2–1 килобайт) агарозы, растворенной в буфере для электрофореза. До 3% можно использовать для разделение очень крошечных фрагментов, но в этом случае больше подходит вертикальный полиакриламидный гель. Гели с низким процентным содержанием очень непрочны и могут сломаться, когда вы попытаетесь их поднять. Гели с высоким процентным содержанием часто бывают хрупкими и не схватываются равномерно. 1% гели обычно много приложений. "[10]
Полиакриламид
Электрофорез в полиакриламидном геле (PAGE) используется для разделения белков размером от 5 до 2000 кДа благодаря однородному размеру пор, обеспечиваемому полиакриламидным гелем. Размер пор регулируется путем регулирования концентраций порошка акриламида и бис-акриламида, используемых для создания геля. При создании этого типа геля необходимо соблюдать осторожность, поскольку акриламид является сильнодействующим нейротоксином в жидкой и порошкообразной формах.
Традиционный Секвенирование ДНК такие методы, как Максам-Гилберт или же Sanger В методах использовались полиакриламидные гели для разделения фрагментов ДНК, различающихся по длине одной парой оснований, чтобы последовательность могла быть прочитана. В большинстве современных методов разделения ДНК сейчас используются агарозные гели, за исключением особо мелких фрагментов ДНК. В настоящее время наиболее часто используется в области иммунология и анализ белков, часто используемый для разделения различных белков или изоформы одного и того же белка на отдельные полосы. Их можно перенести на нитроцеллюлоза или же ПВДФ мембрану, которую необходимо зондировать антителами и соответствующими маркерами, например, в вестерн-блот.
Обычно рассасывающиеся гели производятся на 6%, 8%, 10%, 12% или 15%. Укладывающий гель (5%) наливают поверх разрешающего геля и вставляют гелевую гребенку (которая формирует лунки и определяет дорожки, куда будут помещены белки, буфер для образцов и лестницы). Выбранный процент зависит от размера белка, который нужно идентифицировать или исследовать в образце. Чем меньше известный вес, тем выше процент, который следует использовать. Изменения в буферной системе геля могут способствовать дальнейшему расслоению белков очень малых размеров.[11]
Крахмал
Частично гидролизованный картофельный крахмал - еще одна нетоксичная среда для электрофореза белков. Гели немного более непрозрачны, чем акриламид или агароза. Неденатурированные белки можно разделить по заряду и размеру. Их визуализируют с помощью окрашивания Napthal Black или Amido Black. Типичные концентрации геля крахмала составляют от 5% до 10%.[12][13][14]
Условия геля
Денатурирование
Денатурирование гели работают в условиях, которые нарушают естественную структуру аналита, заставляя его разворачиваться в линейную цепочку. Таким образом, подвижность каждого макромолекула зависит только от его линейной длины и отношения массы к заряду. Таким образом, вторичный, третичный и четвертичный уровни биомолекулярная структура разрушаются, оставляя для анализа только первичную структуру.
Нуклеиновые кислоты часто денатурируют путем включения мочевина в буфере, а белки денатурируют с использованием додецилсульфат натрия, обычно как часть SDS-СТРАНИЦА процесс. Для полной денатурации белков также необходимо снизить ковалентную дисульфидные связи которые стабилизируют их высшее и четвертичная структура, метод, называемый сокращением PAGE. Условия восстановления обычно поддерживаются добавлением бета-меркаптоэтанол или же дитиотреитол. Для общего анализа образцов белка сокращение PAGE является наиболее распространенной формой электрофорез белков.
Денатурирующие условия необходимы для правильной оценки молекулярной массы РНК. РНК способна образовывать больше внутримолекулярных взаимодействий, чем ДНК, что может привести к изменению ее электрофоретическая подвижность. Мочевина, ДМСО и глиоксаль являются наиболее часто используемыми денатурирующими агентами для нарушения структуры РНК. Первоначально высокотоксичный метилртуть гидроксид часто использовали при денатурирующем электрофорезе РНК,[15] но для некоторых образцов это может быть метод выбора.[16]
Денатурирующий гель-электрофорез используется в методах построения полос ДНК и РНК. гель-электрофорез в градиенте температуры (TGGE)[17] и денатурирующий градиентный гель-электрофорез (DGGE).[18]
Родные
Нативные гели запускают в неденатурирующих условиях, чтобы сохранить естественную структуру аналита. Это позволяет физическому размеру сложенного или собранного комплекса влиять на подвижность, позволяя анализировать все четыре уровня биомолекулярной структуры. Для биологических образцов моющие средства используются только в той мере, в какой они необходимы для лизировать липидные мембраны в клетка. Комплексы остаются - по большей части - связанными и свернутыми, как если бы они были в ячейке. Однако один недостаток состоит в том, что комплексы не могут разделяться чисто или предсказуемо, поскольку трудно предсказать, как форма и размер молекулы повлияют на ее подвижность. Обращение и решение этой проблемы - основная цель количественная родная страница.
В отличие от методов денатурирования, электрофорез в нативном геле не использует заряженный денатурирующий агент. Разделяемые молекулы (обычно белки или же нуклеиновые кислоты) поэтому отличаются не только молекулярная масса и собственный заряд, но также и площадь поперечного сечения, и, таким образом, испытывают различные электрофоретические силы в зависимости от формы всей структуры. Что касается белков, поскольку они остаются в нативном состоянии, их можно визуализировать не только с помощью общих реагентов для окрашивания белков, но также с помощью специфического окрашивания, связанного с ферментами.
Конкретный экспериментальный пример применения электрофореза в нативном геле заключается в проверке ферментативной активности для подтверждения присутствия фермента в образце во время очистки белка. Например, для протеиновой щелочной фосфатазы окрашивающий раствор представляет собой смесь 4-хлор-2-2метилбензолдиазониевой соли с 2'-4'-диметиланилином 3-фосфо-2-нафтойной кислоты в Трис-буфере. Это краситель продается как набор для окрашивания гелей. Если белок присутствует, механизм реакции протекает в следующем порядке: она начинается с дефосфорилирования 2'-4'-диметиланилина 3-фосфо-2-нафтойной кислоты щелочной фосфатазой (требуется вода). для реакции). Фосфатная группа высвобождается и заменяется спиртовой группой из воды. Электрофильный 4-хлор-2-2 метилбензолдиазоний (диазониевая соль Fast Red TR) замещает спиртовую группу, образуя конечный продукт - красный азокраситель. Как следует из названия, это последний видимый красный продукт реакции. В студенческих академических экспериментах по очистке белка гель обычно запускают рядом с коммерчески очищенными образцами, чтобы визуализировать результаты и сделать вывод, была ли очистка успешной.[20]
Родные гель-электрофорез обычно используется в протеомика и металломика. Однако нативный PAGE также используется для сканирования генов (ДНК) на предмет неизвестных мутаций, как в Однонитевой конформационный полиморфизм.
Буферы
Буферы в гель-электрофорезе используются для получения ионов, которые переносят ток, и для поддержания pH на относительно постоянном уровне. Эти буферы содержат большое количество ионов, которые необходимы для прохождения через них электричества. Что-то вроде дистиллированной воды или бензола содержит мало ионов, что не идеально для использования в электрофорезе.[21] Для электрофореза используется ряд буферов. Наиболее распространено для нуклеиновых кислот. Трис / Ацетат / ЭДТА (TAE), Трис / борат / ЭДТА (TBE). Было предложено много других буферов, например борат лития, который редко используется, на основе ссылок Pubmed (LB), изоэлектрического гистидина, буферов согласованных товаров pK и т.д .; в большинстве случаев предполагаемое объяснение заключается в более низком токе (меньшем нагреве) согласованной подвижности ионов, что приводит к увеличению срока службы буфера. Борат проблематичен; Борат может полимеризоваться или взаимодействовать с цис-диолами, такими как те, которые содержатся в РНК. TAE имеет самую низкую буферную емкость, но обеспечивает лучшее разрешение для большей ДНК. Это означает более низкое напряжение и больше времени, но более качественный продукт. LB является относительно новым и неэффективен при разрешении фрагментов размером более 5 кб; Однако из-за его низкой проводимости можно было использовать гораздо более высокое напряжение (до 35 В / см), что означает более короткое время анализа для обычного электрофореза. Разница в размере всего одной пары оснований может быть устранена в 3% -ном агарозном геле со средой с чрезвычайно низкой проводимостью (1 мМ борат лития).[22]
Большинство белковых разделений в SDS-PAGE выполняется с использованием "прерывистая" (или DISC) буферная система это значительно увеличивает резкость полос внутри геля. Во время электрофореза в прерывистой гелевой системе на ранней стадии электрофореза образуется ионный градиент, который заставляет все белки фокусироваться на одной острой полосе в процессе, называемом изотахофорез. Разделение белков по размеру достигается в нижней, «разрешающейся» области геля. Разделительный гель обычно имеет гораздо меньший размер пор, что приводит к эффекту просеивания, который теперь определяет электрофоретическую подвижность белков.
Визуализация
После завершения электрофореза молекулы в геле могут быть окрашенный чтобы сделать их видимыми. ДНК можно визуализировать с помощью этидиум бромид которые при внедрении в ДНК, флуоресценция под ультрафиолетовый свет, в то время как белок можно визуализировать с помощью серебряное пятно или же Кумасси бриллиантовый синий краситель. Для визуализации разделения компонентов смеси на геле можно также использовать другие методы. Если разделяемые молекулы содержат радиоактивность, например в Секвенирование ДНК гель, авторадиограмма можно записать гель. Фотографии можно принимать гели, часто используя Гель Док система.
Последующая обработка
После разделения можно использовать дополнительный метод разделения, такой как изоэлектрическая фокусировка или же SDS-СТРАНИЦА. Затем гель будет физически разрезан, и белковые комплексы извлечены из каждой порции отдельно. Затем каждый экстракт может быть проанализирован, например, дактилоскопия пептидной массы или же de novo пептидное секвенирование после переваривание в геле. Это может предоставить много информации об идентичности белков в комплексе.
Приложения
- Оценка размера молекул ДНК после переваривания рестриктазой, например в отображение ограничений клонированной ДНК.
- Анализ ПЦР продукты, например в молекулярном генетическая диагностика или же генетическая дактилоскопия
- Разделение рестриктированной геномной ДНК до Южный трансфер, или РНК до Северный трансфер.
Гель-электрофорез используется в криминалистика, молекулярная биология, генетика, микробиология и биохимия. Результаты могут быть проанализированы количественно путем визуализации геля с помощью УФ-света и устройства визуализации геля. Изображение записывается с помощью камеры, управляемой компьютером, и интенсивность интересующей полосы или пятна измеряется и сравнивается со стандартом или маркерами, нанесенными на тот же гель. Измерение и анализ в основном выполняются с помощью специализированного программного обеспечения.
В зависимости от типа выполняемого анализа, другие методы часто применяются вместе с результатами гель-электрофореза, обеспечивая широкий спектр приложений для конкретных областей.
Нуклеиновые кислоты
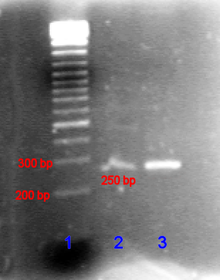
В случае нуклеиновых кислот направление миграции от отрицательного к положительному электроду обусловлено естественным отрицательным зарядом, переносимым их электродами. сахар-фосфат позвоночник.[23]
Фрагменты двухцепочечной ДНК естественно ведут себя как длинные стержни, поэтому их миграция через гель зависит от их размера или, для циклических фрагментов, от их размера. радиус вращения. Круговая ДНК, такая как плазмидыоднако может показывать несколько полос, скорость миграции может зависеть от того, является ли она расслабленной или сверхспиральной. Одноцепочечная ДНК или РНК имеет тенденцию складываться в молекулы сложной формы и мигрировать через гель сложным образом в зависимости от их третичной структуры. Следовательно, агенты, нарушающие водородные связи, Такие как едкий натр или же формамид, используются, чтобы денатурировать нуклеиновые кислоты и заставить их снова вести себя как длинные палочки.[24]
Гель-электрофорез больших ДНК или же РНК обычно проводится электрофорезом в агарозном геле. Смотрите "Метод завершения цепи"страница примера геля для секвенирования полиакриламидной ДНК. Характеристика посредством лигандного взаимодействия нуклеиновых кислот или фрагментов может быть выполнена путем изменения подвижности. аффинный электрофорез.
Электрофорез образцов РНК можно использовать для проверки загрязнения геномной ДНК, а также деградации РНК. РНК эукариотических организмов показывает отдельные полосы 28s и 18s рРНК, при этом 28s полоса примерно в два раза интенсивнее, чем полоса 18s. Деградированная РНК имеет менее четко очерченные полосы, имеет размытый вид, а соотношение интенсивностей меньше 2: 1.
Белки
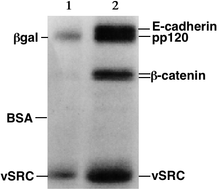
Белкив отличие от нуклеиновых кислот, они могут иметь различные заряды и сложные формы, поэтому они могут не мигрировать в полиакриламидный гель с одинаковой скоростью или полностью при помещении отрицательной или положительной ЭДС на образец. Поэтому белки обычно денатурированный в присутствии моющее средство Такие как додецилсульфат натрия (SDS), покрывающий белки отрицательным зарядом.[3] Как правило, количество связанного SDS зависит от размера белка (обычно 1,4 г SDS на грамм белка), так что полученные денатурированные белки имеют общий отрицательный заряд, и все белки имеют одинаковое отношение заряда к массе. соотношение. Поскольку денатурированные белки действуют как длинные стержни, а не имеют сложную третичную форму, скорость, с которой полученные белки, покрытые SDS, мигрируют в геле, зависит только от его размера, а не от его заряда или формы.[3]
Белки обычно анализируются электрофорезом в полиакриламидном геле с додецилсульфатом натрия (SDS-СТРАНИЦА), к нативный гель-электрофорез, препаративным гель-электрофорезом (QPNC-PAGE) или 2-D электрофорез.
Характеристика посредством взаимодействия лигандов может быть выполнена с помощью электроблоттинг или по аффинный электрофорез в агарозе или капиллярный электрофорез что касается оценки константы привязки и определение структурных особенностей, таких как гликан содержание через лектин привязка.
Наночастицы
Новым применением гель-электрофореза является разделение или определение характеристик наночастиц металлов или оксидов металлов (например, Au, Ag, ZnO, SiO2) в отношении размера, формы или химического состава поверхности наночастиц. Задача состоит в том, чтобы получить более однородный образец (например, более узкий гранулометрический состав), который можно использовать в других продуктах / процессах (например, процессах самосборки). Для разделения наночастиц в геле размер частиц примерно равный размеру ячеек является ключевым параметром, посредством чего были определены два механизма миграции: неограниченный механизм, когда размер частиц << размер ячейки, и ограниченный механизм, когда размер частиц равен аналогичен размеру ячеек.[25]
История
- 1930-е годы - первые сообщения об использовании сахароза для гель-электрофореза
- 1955 г. - введение крахмал гели, посредственное разделение (Smithies)[13]
- 1959 г. - внедрение акриламидных гелей; дисковый электрофорез (Орнштейн и Дэвис); точный контроль таких параметров, как размер пор и стабильность; и (Раймонд и Вайнтрауб)
- 1966 г. - первое использование агар гели[26]
- 1969 г. - введение денатурирующий агенты особенно SDS разделение белок субъединица (Вебер и Осборн)[27]
- 1970 - Лэммли выделил 28 компонентов Фаг Т4 с помощью геля для укладки и SDS
- 1972 - агарозные гели с окраской бромистым этидием[28]
- 1975 г. - двухмерные гели (O’Farrell); изоэлектрическая фокусировка затем электрофорез в геле SDS
- 1977 – последовательность действий гели
- 1983 – гель-электрофорез в импульсном поле позволяет разделить большие молекулы ДНК
- 1983 г. - введение капиллярный электрофорез
- 2004 г. - введение стандартизированный время полимеризация акриламидных гелей обеспечивает чистое и предсказуемое разделение нативных белков (Kastenholz)[29]
В книге Милана Биера об электрофорезе 1959 года цитируются ссылки из 1800-х годов.[30] Тем не мение, Оливер Смитис внесли значительный вклад. Бир заявляет: «Метод Кузни ... находит широкое применение благодаря своей уникальной разделяющей способности». Взятый в контексте, Бир ясно подразумевает, что метод Смитиса является улучшением.
Смотрите также
Рекомендации
- ^ Крындушкин Д.С. Тер-Аванесян МД, Кушниров В.В. (2003). «Агрегаты прионов [PSI +] дрожжей образованы небольшими полимерами Sup35, фрагментированными Hsp104». Журнал биологической химии. 278 (49): 49636–43. Дои:10.1074 / jbc.M307996200. PMID 14507919.
- ^ Сэмбрук Дж., Рассел Д.В. (2001). Молекулярное клонирование: лабораторное руководство, 3-е изд. Лабораторный пресс Колд-Спринг-Харбор. Колд-Спринг-Харбор, Нью-Йорк.
- ^ а б c Берг Дж. М., Тимочко Дж. Л., Страйер Л. (2002). Биохимия (5-е изд.). WH Freeman. ISBN 978-0-7167-4955-4.
- ^ Хофманн, Андреас; Clokie, Samuel, ред. (19 апреля 2018 г.). Принципы и методы биохимии и молекулярной биологии Уилсона и Уокера. Великобритания: Издательство Кембриджского университета. ISBN 9781316614761.
- ^ Бойер, Родни Ф. (20 августа 2000 г.). Современная экспериментальная биохимия. США: Пирсон, 3-е издание. ISBN 978-0805331110.
- ^ Робит, Джон Ф .; Белый, Бернард Дж. (1990). Теория и практика биохимических методов. Waveland Press. ISBN 978-0-88133-556-9.
- ^ «Определение молекулярной массы с помощью SDS-PAGE» (PDF).
- ^ Том Маниатис; Э. Ф. Фрич; Джозеф Сэмбрук (1982). «Глава 5, протокол 1». Молекулярное клонирование - лабораторное руководство. 1 (3-е изд.). п. 5.2–5.3. ISBN 978-0879691363.
- ^ Smisek, D. L .; Хоугланд, Д. А. (1989). «Электрофорез в агарозном геле высокомолекулярных синтетических полиэлектролитов». Макромолекулы. 22 (5): 2270–2277. Bibcode:1989MaMol..22.2270S. Дои:10.1021 / ma00195a048.
- ^ «Электрофорез в агарозном геле (основной метод)». Биологические протоколы. Получено 23 августа 2011.
- ^ Шеггер, Герман (2006). "Трицин – SDS-PAGE". Протоколы природы. 1 (1): 16–22. Дои:10.1038 / nprot.2006.4. PMID 17406207. S2CID 209529082.
- ^ Гордон, A.H. (1975). Электрофорез белков в полиакриламидных и крахмальных гелях. Нью-Йорк: American Elsevier Publishing Company, Inc.
- ^ а б Smithies, О. (1955). «Зональный электрофорез в крахмальных гелях: групповые вариации белков сыворотки здоровых взрослых людей». Biochem. J. 61 (4): 629–641. Дои:10.1042 / bj0610629. ЧВК 1215845. PMID 13276348.
- ^ Wraxall, B.G.D .; Каллифорд, Б.Дж. (1968). «Метод тонкослойного крахмального геля для ферментативного типирования пятен крови». J. Forensic Sci. Soc. 8 (2): 81–82. Дои:10.1016 / S0015-7368 (68) 70449-7. PMID 5738223.
- ^ Buell, GN; Виккенс, депутат; Пайвар, Ф; Шимке, RT (10 апреля 1978 г.). «Синтез полноразмерных кДНК из четырех частично очищенных мРНК яйцевода». Журнал биологической химии. 253 (7): 2471–82. PMID 632280.
- ^ Schelp, C; Kaaden, OR (май 1989 г.). «Усиленная транскрипция полноразмерной РНК вируса Синдбис за счет эффективной денатурации гидроксидом метилртути». Acta Virologica. 33 (3): 297–302. PMID 2570517.
- ^ Fromin N, Hamelin J, Tarnawski S, Roesti D, Jourdain-Miserez K, Forestier N, Teyssier-Cuvelle S, Gillet F, Aragno M, Rossi P (ноябрь 2002 г.). «Статистический анализ рисунков отпечатков пальцев денатурирующим гель-электрофорезом (DGE)» (PDF). Environ. Микробиол. 4 (11): 634–43. Дои:10.1046 / j.1462-2920.2002.00358.x. PMID 12460271.
- ^ Фишер С.Г., Лерман Л.С. (январь 1979 г.). «Независимое от длины разделение рестрикционных фрагментов ДНК в двумерном гель-электрофорезе». Клетка. 16 (1): 191–200. Дои:10.1016/0092-8674(79)90200-9. PMID 369706. S2CID 9369012.
- ^ Хемпельманн Э., Уилсон Р.Дж. (1981). «Обнаружение глюкозо-6-фосфатдегидрогеназы у малярийных паразитов». Молекулярная и биохимическая паразитология. 2 (3–4): 197–204. Дои:10.1016/0166-6851(81)90100-6. PMID 7012616.
- ^ Нинфа А.Дж., Баллоу Д.П. (1998). Фундаментальные подходы к биохимии и биотехнологии. Бетесда, Мэриленд: Фитцджеральд Сайенс Пресс. ISBN 9781891786006.
- ^ Нинфа, Александр Дж .; Ballou, David P .; Бенор, Марили (2009). фундаментальные лабораторные подходы к биохимии и биотехнологии. Хобокен, Нью-Джерси: Уайли. п. 161. ISBN 978-0470087664.
- ^ Броуди-младший, Керн С.Е. (октябрь 2004 г.). «История и принципы проводящих сред для стандартного электрофореза ДНК» (PDF). Анальный. Биохим. 333 (1): 1–13. Дои:10.1016 / j.ab.2004.05.054. PMID 15351274.
- ^ Лодиш H; Берк А; Мацудаира П. (2004). Молекулярная клеточная биология (5-е изд.). WH Freeman: Нью-Йорк, штат Нью-Йорк. ISBN 978-0-7167-4366-8.
- ^ Устранение неполадок при электрофорезе в ДНК-агарозном геле. Фокус 19: 3 с.66 (1997).
- ^ Барасинский, М .; Гарнвайтнер, Г. Ограниченные и неограниченные механизмы миграции наночастиц кремнезема в агарозных гелях и их использование для разделения бинарных смесей. J. Phys. Chem. С. 2020, 124, 5157-5166. https://pubs.acs.org/doi/abs/10.1021/acs.jpcc.9b10644
- ^ Торн HV (1966). «Электрофоретическое отделение ДНК вируса полиомы от ДНК клетки-хозяина». Вирусология. 29 (2): 234–9. Дои:10.1016/0042-6822(66)90029-8. PMID 4287545.
- ^ Вебер, К; Осборн, М. (1969). «Надежность определения молекулярной массы электрофорезом в додецилсульфат-полиакриламидном геле». Журнал биологической химии. 244 (16): 4406–12. PMID 5806584.
- ^ Aaij C, Borst P (1972). «Гель-электрофорез ДНК». Biochim Biophys Acta. 269 (2): 192–200. Дои:10.1016/0005-2787(72)90426-1. PMID 5063906.
- ^ Кастенхольц Б (2004). «Препаративный нативный непрерывный электрофорез в полиакриламидном геле (PNC ‐ PAGE): эффективный метод выделения кофакторов кадмия в биологических системах». Аналитические письма. 37 (4): 657–665. Дои:10.1081 / AL-120029742. S2CID 97636537.
- ^ Милан Бир (1959). Электрофорез. Теория, методы и приложения (3-е изд.). Академическая пресса. п. 225. OCLC 1175404. LCC 59-7676.
- ^ Minde DP (2012). «Определение биофизической стабильности белков в лизатах с помощью анализа быстрого протеолиза, FASTpp». PLOS One. 7 (10): e46147. Bibcode:2012PLoSO ... 746147M. Дои:10.1371 / journal.pone.0046147. ЧВК 3463568. PMID 23056252.
внешняя ссылка
| Викискладе есть медиафайлы по теме Гель-электрофорез. |
- Демонстрация лабораторного электрофореза биотехникииз Учебного центра генетических наук Университета штата Юта.
- Прерывистый электрофорез в геле с нативным белком
- Электрофорез на соломинке
- Как запустить гель ДНК или РНК
- Анимация гель-анализа рестрикции ДНК
- Пошаговые фотографии запуска геля и извлечения ДНК
- Типичный метод из викиверситета
- Руководство по принципам и методам двумерного электрофореза