WikiDer > HLA-A
| MHC класс I, А | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
| (гетеродимер) | ||||||||||
 Иллюстрация HLA-A | ||||||||||
| Тип белка | Рецептор клеточной поверхности | |||||||||
| Функция | Презентация пептидов для иммунного распознавания | |||||||||
| ||||||||||
HLA-A это группа человеческие лейкоцитарные антигены (HLA), которые кодируются HLA-A локус, который расположен на хромосоме человека 6p21.3.[1] HLA - это главный комплекс гистосовместимости (MHC) антиген, специфичный для человека. HLA-A - один из трех основных типов человеческого MHC класс I рецепторы клеточной поверхности. Остальные HLA-B и HLA-C.[2] Рецептор - это гетеродимер, и состоит из тяжелой α-цепи и меньшей β-цепи. Цепь α кодируется вариантом Ген HLA-A, а β-цепь (β2-микроглобулин) - инвариант β2 микроглобулин молекула.[3] Β2 Белок микроглобулина кодируется отдельной областью генома человека.[4]
Молекулы MHC класса I, такие как HLA-A, являются частью процесса, который представляет короткие полипептиды иммунной системе. Эти полипептиды обычно имеют длину 7-11 аминокислот и происходят из белков, экспрессируемых клеткой. Существует два класса полипептидов, которые могут быть представлены белком HLA: те, которые, как предполагается, экспрессируются клеткой (собственные), и полипептиды чужеродного происхождения (чужие).[5] В нормальных условиях цитотоксические Т-клетки, которые в норме патрулируют организм в крови, «читают» пептид, представленный комплексом. Т-клетки, если они функционируют должным образом, связываются только с чужеродными пептидами. Если происходит связывание, инициируется серия событий, кульминация которых приводит к гибели клетки через апоптоз.[6] Таким образом, человеческий организм удаляет любые клетки, инфицированные вирусом или экспрессирующие белки, которыми они не должны быть (например, раковые клетки).
У людей, как и у большинства популяций млекопитающих, молекулы MHC Class I чрезвычайно изменчивы по своему составу. первичная структура, а HLA-A входит в число генов человека с наиболее быстро развивающейся кодирующей последовательностью. По состоянию на декабрь 2013 г. известно 2432 HLA-A. аллели кодировка для 1740 активных белки и 117 нулевые белки.[2] Такой уровень вариации MHC Class I является основной причиной отторжения трансплантата, поскольку случайная трансплантация между донором и хозяином вряд ли приведет к совпадению антигенов HLA-A, B или C. Эволюционные биологи также считают, что широкое разнообразие HLA является результатом баланса между конфликтующими патогенными факторами. Большее разнообразие HLA снижает вероятность того, что все население будет уничтожено одним патогеном, поскольку определенные люди будут иметь высокую устойчивость к каждому патогену.[5] Влияние вариации HLA-A на прогрессирование ВИЧ / СПИДа обсуждается ниже.
Ген HLA-A
Ген HLA-A расположен на коротком плече хромосомы 6 и кодирует более крупную α-цепь, составляющую HLA-A. Вариация α-цепи HLA-A является ключом к функции HLA. Это изменение способствует генетическому разнообразию в популяции. Поскольку каждый HLA имеет разное сродство к пептидам определенных структур, большее разнообразие HLA означает большее разнообразие антигенов, которые будут «представлены» на поверхности клетки, повышая вероятность того, что подмножество популяции будет устойчиво к данному инородному захватчику. Это снижает вероятность того, что отдельный патоген может уничтожить всю человеческую популяцию.
Каждый человек может экспрессировать до двух типов HLA-A, по одному от каждого из своих родителей. Некоторые люди унаследуют один и тот же HLA-A от обоих родителей, уменьшая индивидуальное разнообразие HLA; однако большинство людей получат две разные копии HLA-A. Этот же шаблон следует для всех групп HLA.[10] Другими словами, каждый человек может экспрессировать только один или два из 2432 известных аллелей HLA-A.
Аллели
Всем HLA присвоено имя Комитетом Всемирной организации здравоохранения по присвоению имен для факторов системы HLA. Это имя организовано таким образом, чтобы предоставить как можно больше информации о конкретном аллеле, при этом имя должно быть как можно короче. Имя HLA выглядит примерно так:
HLA-A * 02: 01: 01: 02L
Все аллели получают как минимум четырехзначную классификацию (HLA-A * 02: 12). А означает, к какому гену HLA принадлежит аллель. Существует много аллелей HLA-A, поэтому классификация по серотипу упрощает категоризацию. Следующая пара цифр указывает на это назначение. Например, HLA-A * 02: 02, HLA-A * 02: 04, и HLA-A * 02: 324 все являются членами серотипа A2 (обозначенного префиксом * 02).[2] Эта группа является основным фактором, отвечающим за совместимость с HLA. Все числа после этого не могут быть определены серотипированием и обозначаются путем секвенирования генов. Второй набор цифр указывает, какой белок HLA продуцируется. Они назначены в порядке открытия, и по состоянию на декабрь 2013 г. известно 456 различных белков HLA-A * 02 (присвоены названия HLA-A * 02: 01 - HLA-A * 02: 456). Кратчайшее возможное имя HLA включает обе эти детали.[1] Каждое дополнительное расширение означает синонимичные мутации внутри кодирующей области и мутации вне кодирующей области. Интерпретация расширений более подробно описана в текущая система именования HLA.
Протеин
Белок, кодируемый геном HLA-A, состоит из 365 аминокислот и весит примерно 41 000 дальтон (Да).[11] Он содержит 8 экзонов.[12]
| Экзон | Белковый сегмент |
|---|---|
| 1 | Сигнальный пептид |
| 2 | α1 домен |
| 3 | α2 домен |
| 4 | α3 домен |
| 5 | трансмембранная область |
| 6 | цитоплазматический хвост |
| 7 | цитоплазматический хвост |
| 8 | Неопределенные |
HLA-A сигнальный пептид представляет собой серию гидрофобных аминокислот, присутствующих в N-конец белка, который направляет его в эндоплазматический ретикулум где переведены остальные семь доменов.[11][12][13] Три α домена образуют связывающую бороздку, которая удерживает пептид для презентации в CD8 + Т-клетки. Трансмембранная область - это область, которая встроена в фосфолипидный бислой, окружающий просвет ER.[12] Белок HLA-A - это однопроходный трансмембранный белок.[11] Другими словами, первые четыре домена белка находятся внутри просвета ЭР, в то время как последние три домена присутствуют за пределами просвета, что придает белку ориентацию, необходимую для правильного функционирования. Последние три домена белка образуют хвост в основном β-листы который остается в цитозоле клетки.[12]
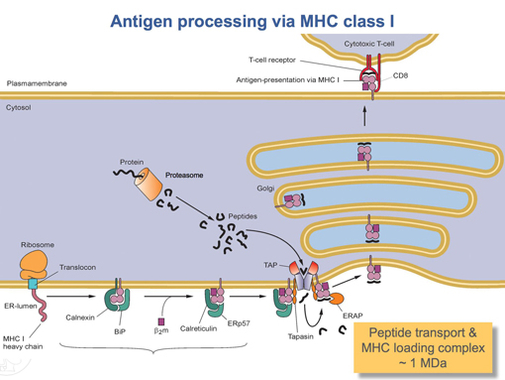
После того, как белок HLA-A полностью переведен, его необходимо свернуть в нужную форму. Молекулярный шаперонный белок называется калнексин и фермент под названием ERp57 помочь в процессе складывания. Калнексин удерживает тяжелую цепь HLA-A, в то время как Erp57 катализирует дисульфидные связи между тяжелой цепью и легкой цепью, β2-микроглобулиновая цепь. Эта связь вызывает конформационное изменение тяжелой цепи, образуя связывающую бороздку. Затем калнексин диссоциирует с комплексом, который теперь называется комплексом загрузки пептидов, и заменяется на кальретикулин, другой белок-шаперон. Короткие пептиды непрерывно транспортируются вокруг клетки в просвет ЭПР с помощью специального транспортного белка, называемого НАЖМИТЕ. Затем TAP связывается с комплексом загрузки пептида вместе с другим белком, называемым тапасин. На данный момент комплекс пептидной нагрузки состоит из HLA-A (тяжелая цепь), β2-микроглобулин (легкая цепь), фермент ERp57, белок-шаперон кальретикулин, ТАР (со связанным пептидным фрагментом) и тапазин. Тапасин увеличивает стабильность TAP, в дополнение к стабилизации всего комплекса загрузки пептидов. В этот момент TAP высвобождает пептид, который он перенес в просвет ER. Близость связывающей бороздки HLA-A к ТАР обеспечивается комплексом загрузки пептида. Это увеличивает вероятность того, что пептид найдет бороздку. Если сродство пептида к белку HLA-A достаточно велико, он связывается в бороздке.[15] Исследования показывают, что тапазин может активно загружать пептиды из TAP в комплекс HLA-A, одновременно удерживая молекулы класса I в просвете ER до тех пор, пока не будет связан пептид с высокой аффинностью.[16]
После связывания пептида с достаточно высокой аффинностью с MHC класса I кальретикулин, ERp57, TAP и тапазин высвобождают молекулу.[15] На данный момент комплекс класса I состоит из белка HLA-A, связанного с β2-микроглобулин и короткий пептид. Он все еще закреплен в мембране ER трансмембранным доменом. В какой-то момент ER получит сигнал, и часть мембраны, удерживающая комплекс, отпадет и будет транспортирована к телам Гольджи для дальнейшей обработки. Из тел Гольджи комплекс транспортируется снова через транспорт везикул к клеточной мембране. Это тот момент, когда ориентация, упомянутая ранее, становится важной. Часть комплекса HLA-A, содержащая пептид, должна находиться на внешней поверхности клеточной мембраны. Это достигается путем слияния пузырьков с клеточной мембраной.[13]
Функция
Естественная функция
Молекулы MHC класса I представляют иммунной системе небольшие пептиды, обычно длиной 7-10 аминокислот. Гликопротеин под названием CD8 связывается с остатками 223-229 в α3 домене HLA-A, и этот гликопротеин стабилизирует взаимодействия между Т-клеточным рецептором на цитотоксическом (CD8+) Т-лимфоциты и MHC I класса.[17] Рецептор Т-клеток также может связываться с пептидом, представленным MHC. В правильно функционирующей иммунной системе только Т-клетки, которые не связывают собственные пептиды, допускаются из тимуса, таким образом, если Т-клетка связывается с пептидом, это должен быть чужеродный или аномальный пептид. Затем Т-клетка инициирует апоптоз, или запрограммированная гибель клеток. Этот процесс может произойти через 5 минут после первоначальной презентации чужеродного антигена, хотя обычно смерть становится очевидной через несколько часов.[18] Этот процесс является основой приобретенного иммунитета и служит основной защитой от вирусов и других внутриклеточных патогенов.
Другие занятия
К 1960-м годам стало очевидно, что факторы, воздействующие на донорские органы и ткани, часто приводят к разрушению донорской ткани иммунной системой хозяина. MHC были первоначально обнаружены в результате этого наблюдения (см. история HLA Больше подробностей).[5] Существует два типа пептид-презентирующих комплексов, MHC класса I и класса II. Каждый из них имеет несколько генов HLA, из которых HLA-A - только один. Есть три основных HLA, которые должны согласовываться между донорами и получателями. Это HLA-A, HLA-B (оба MHC класса I) и HLA-DR (MHC класса II).[10] Если две ткани имеют одинаковые гены, кодирующие эти три HLA, вероятность и тяжесть отторжения сводятся к минимуму.[19]
Роль в болезни
| Сопутствующее заболевание | Серотипы | ||
| Анкилозирующий спондилоартрит | A24 | ||
| Диабет I типа[20] | A1 | A24 | |
| Гемохроматоз (нижние CD8 + клетки) | A3 | ||
| Миастения | A3 | A24 | A30 |
| Лейкоз, Т-клеточный, Взрослый | A26 | A68 | |
| Рассеянный склероз | A3 | ||
| Вирус папилломы susept. | A11 | ||
| Самопроизвольный аборт | A2 | ||
HLA служат единственным связующим звеном между иммунной системой и тем, что происходит внутри клеток. Таким образом, любое изменение со стороны HLA, будь то снижение связывания с определенным пептидом или повышенное связывание с определенным пептидом, выражается, соответственно, как повышенная восприимчивость к заболеванию или пониженная восприимчивость к заболеванию. Другими словами, некоторые HLA могут быть неспособны связывать какие-либо короткие пептиды, продуцируемые протеолиз патогенных белков. В этом случае иммунная система не может определить, что клетка инфицирована. Таким образом, инфекция может бесконтрольно распространяться. Это работает и в обратном направлении. Некоторые HLA связывают фрагменты патогенных пептидов с очень высокой аффинностью. Это, по сути, «перезаряжает» их иммунную систему в отношении этого конкретного патогена, позволяя им справляться с инфекцией, которая в противном случае могла бы быть разрушительной.[5]
ВИЧ / СПИД
Одним из наиболее изученных примеров дифференциальной иммунной регуляции патогена является Вирус иммунодефицита человека. Поскольку ВИЧ - это РНК-вирус, он невероятно быстро мутирует. Это изменяет пептиды, продуцируемые посредством протеолиза, который изменяет пептиды, которые могут быть представлены иммунной системе с помощью MHC инфицированной клетки. Любой вирус с мутацией, которая создает пептид с высоким сродством к конкретному HLA, быстро убивается иммунной системой и, таким образом, не выживает, и этот пептид с высокой аффинностью больше не продуцируется. Однако оказывается, что даже у ВИЧ есть некоторые консервативные области в своем геноме, и если HLA способен связываться с пептидом, продуцируемым из консервативной области, ВИЧ мало что может сделать, чтобы избежать обнаружения и разрушения иммунной системы.[5] Это принцип, лежащий в основе HLA-опосредованной дифференциальной нагрузки ВИЧ.
Имея более 2000 вариантов HLA-A-кодированного MHC, трудно определить влияние всех вариантов на нагрузку ВИЧ. Однако замешаны лишь немногие избранные. Было показано, что HLA-A * 30 снижает вирусную нагрузку до менее чем 10 000 копий на кубический миллиметр, что считается довольно низким. С другой стороны, HLA-A * 02 вовлечен в высокую вирусную нагрузку (более 100 000 копий / кубический миллиметр), когда он связан с HLA-B * 45. Кроме того, гаплотипы HLA-A * 23-C * 07 и HLA-A * 02-C * 16 обычно выражали повышенную вирусную нагрузку в выборочной популяции замбийцев. Одним из наиболее эффективных гаплотипов, ингибирующих ВИЧ, был HLA-A * 30-C * 03, а одним из наименее эффективных - HLA-A * 23 * B * 14. В итоге, HLA-A * 23 сильно коррелировал с увеличением ВИЧ-инфекции среди выборочной совокупности, хотя важно отметить, что в выборках разной этнической принадлежности эта корреляция значительно снижается.[21]
Хотя классификация влияния отдельных генов и аллелей HLA на наличие ВИЧ затруднена, все же можно сделать некоторые убедительные выводы. Лица, гомозиготные по одному или нескольким генам HLA класса I, обычно прогрессируют до СПИДа намного быстрее, чем гетерозиготы. У некоторых гомозиготных особей скорость прогрессирования вдвое выше, чем у гетерозигот. Эта дифференциальная прогрессия довольно тесно коррелирует со степенью гетерозиготности.[22] Таким образом, определенные аллели HLA-A связаны с различной вирусной нагрузкой у ВИЧ-инфицированных пациентов; однако из-за разнообразия этих аллелей трудно классифицировать влияние каждого аллеля на иммунную регуляцию ВИЧ. Тем не менее, гетерозиготность по аллелям HLA-A можно коррелировать со снижением скорости прогрессирования СПИДа.
Мало того, что определенные аллели HLA предписывают повышенную или пониженную устойчивость к ВИЧ, но ВИЧ способен изменять экспрессию HLA и делает это выборочно, приводя к снижению элиминации путем естественные клетки-киллеры (NK-клетки). Исследования показали, что ВИЧ подавляет экспрессию MHC класса I в инфицированных клетках. Однако это без разбора открывает возможность для атаки NK-клеток, потому что NK-клетки отвечают на подавление HLA-C и HLA-E. Очевидно, что этот механизм оказывает избирательное давление на вирус ВИЧ. Таким образом, ВИЧ развил способность подавлять HLA-A и HLA-B без значительного нарушения экспрессии HLA-C и HLA-E.[23] Белок, кодируемый геномом ВИЧ, негативный регуляторный фактор (Nef), вызывает это изменение путем связывания с цитоплазматическим хвостом MHC класса I, пока он все еще находится в эндоплазматическом ретикулуме или иногда на ранних стадиях транспортировки через тела Гольджи. Этот комплекс MHC и Nef затем заставляет белок-адаптер 1 (AP-1) направлять MHC к лизосомам для деградации, а не к клеточной мембране, где он обычно функционирует.[24] Помимо селективного подавления HLA, негативный регуляторный фактор (Nef) позволяет ВИЧ подавлять CD4 и CD8. Эти гликопротеины необходимы, соответственно, для связывания хелперных Т-клеток и цитотоксических Т-клеток с МНС. Без этих кофакторов оба типа Т-клеток с меньшей вероятностью будут связываться с HLA и инициировать апоптоз, даже если HLA экспрессирует пептид, производный от ВИЧ (не собственный). Оба эти белка также нацелены на свой цитоплазматический хвостовой домен.[24] Сочетание этих способностей значительно увеличивает способность ВИЧ избегать обнаружения иммунной системой.
Резюме
HLA-A представляет собой одну конкретную группу MHC класса I человека. Он состоит из нескольких сотен различных генов и нескольких тысяч вариантных аллелей. HLA-A имеет решающее значение для иммунного ответа, контролируемого цитотоксическими Т-клетками, на вирусы и другие внутриклеточные патогены. Поскольку каждый ген HLA-A имеет высокое сродство к немного разным пептидам, определенные HLA-As связаны с повышенным риском, более быстрым прогрессированием и / или повышенной серьезностью многих заболеваний. По аналогичным причинам соответствие HLA-A важно для успешной трансплантации тканей.
Рекомендации
- ^ а б "Номенклатура HLA @ hla.alleles.org". Исследовательский институт Энтони Нолана. 10 ноя 2013. Получено 8 декабря 2013.
- ^ а б c "Статистика". Европейский институт биоинформатики (EBI) / Европейская лаборатория молекулярной биологии (EMBL). Получено 13 декабря 2013.
- ^ Delves PJ (август 2013 г.). «Система лейкоцитарного антигена человека (HLA): биология иммунной системы». Руководство Merck Professional. Merck Sharp & Dohme Corp.. Получено 14 декабря 2013.
- ^ «B2M Gene». Генные Карты. Институт науки Вейцмана. 7 ноя 2013. Получено 14 декабря 2013.
- ^ а б c d е Дэниел М. Дэвис (2014). Ген совместимости. Как наши тела борются с болезнями, привлекают других и определяют самих себя. Оксфорд: Oxford University Press. ISBN 978-0-19-931641-0.
- ^ Accorsi D (14 сентября 2012 г.). «Монтаж и презентация MHC I класса». YouTube. Получено 8 декабря 2013.
- ^ а б c ENSG00000224320, ENSG00000206503, ENSG00000223980, ENSG00000229215, ENSG00000227715, ENSG00000235657, ENSG00000231834 GRCh38: Ensembl выпуск 89: ENSG00000206505, ENSG00000224320, ENSG00000206503, ENSG00000223980, ENSG00000229215, ENSG00000227715, ENSG00000235657, ENSG00000231834 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ «Ссылка на Mouse PubMed:». Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ а б Исправить M (1998). «Соответствие HLA, антитела и вы». Трансплантация почки: прошлое, настоящее и будущее. Медицинский центр Мичиганского университета / Стэнфордский университет. Получено 14 декабря 2013.
- ^ а б c «Главный комплекс гистосовместимости, класс I, A». Генные карты. Институт науки Вейцмана. 7 ноября 2013 г.. Получено 16 декабря 2013.
- ^ а б c d «HLA-A главный комплекс гистосовместимости, класс I, A [Homo sapiens (человек)]". Национальный центр биотехнологической информации. Национальная медицинская библиотека США. 12 декабря 2013 г.. Получено 16 декабря 2013.
- ^ а б Альбертс, Брюс (2010). Эссенциальная клеточная биология (Третье изд.). Наука о гирляндах. ISBN 9780815341291.
- ^ Тампе, Роберт. «Механизм транслокации P16 и вирусное ингибирование комплекса загрузки пептида MHC I». Молекулярное понимание трансмембранных процессов. Институт Биохимии Биоцентр. Получено 16 декабря 2013.
- ^ а б Аккорси, Диего (14 сентября 2012 г.). «Монтаж и презентация MHC I класса». Иммунология Торонто. Департамент иммунологии, биохимии и биомедицинских коммуникаций Университета Торонто. Получено 16 декабря 2013.
- ^ Grandea AG, Van Kaer L (апрель 2001 г.). «Тапазин: шаперон ER, который контролирует сборку MHC класса I с пептидом». Тенденции в иммунологии. 22 (4): 194–9. Дои:10.1016 / S1471-4906 (01) 01861-0. PMID 11274924.
- ^ "CD8". Группа модуляции Т-клеток. tcells.org. 2009. Архивировано с оригинал 18 февраля 2013 г.. Получено 17 декабря 2013.
- ^ Джейнвей, Чарльз А. (2001). "8". Иммунобиология здоровье и болезни иммунной системы (5. изд.). Нью-Йорк: Гарленд. ISBN 978-0815336426. Получено 17 декабря 2013.
- ^ Соломон С., Питосси Ф, Рао М.С. (февраль 2015 г.). «Банкинг на iPSC - выполнимо и стоит ли». Стволовые клетки. 11 (1): 1–10. Дои:10.1007 / s12015-014-9574-4. ЧВК 4333229. PMID 25516409.
- ^ Noble JA, Valdes AM, Bugawan TL, Apple RJ, Thomson G, Erlich HA (август 2002 г.). «Локус HLA класса I A влияет на восприимчивость к диабету 1 типа». Иммунология человека. 63 (8): 657–64. Дои:10.1016 / S0198-8859 (02) 00421-4. ЧВК 4049513. PMID 12121673.
- ^ Тан Дж., Тан С., Лобашевский Э., Миракл А.Д., Фидели У., Альдрованди Дж., Аллен С., Мусонда Р., Каслоу Р.А. (август 2002 г.). «Благоприятные и неблагоприятные аллели и гаплотипы HLA класса I у замбийцев, преимущественно инфицированных вирусом иммунодефицита человека клады C типа 1». Журнал вирусологии. 76 (16): 8276–84. Дои:10.1128 / JVI.76.16.8276-8284.2002. ЧВК 155130. PMID 12134033.
- ^ Кэррингтон М., Нельсон Г. В., Мартин М. П., Кисснер Т., Влахов Д., Годерт Дж. Дж., Каслоу Р., Бухбиндер С., Хутс К., О'Брайен С. Дж. (Март 1999 г.). «HLA и ВИЧ-1: преимущество гетерозигот и недостаток B * 35-Cw * 04». Наука. 283 (5408): 1748–52. Bibcode:1999Sci ... 283.1748C. Дои:10.1126 / science.283.5408.1748. PMID 10073943.
- ^ Коэн Г.Б., Ганди Р.Т., Дэвис Д.М., Мандельбойм О., Чен Б.К., Строминджер Д.Л., Балтимор Д. (июнь 1999 г.). «Избирательное подавление белков главного комплекса гистосовместимости класса I с помощью ВИЧ-1 защищает ВИЧ-инфицированные клетки от NK-клеток». Иммунитет. 10 (6): 661–71. Дои:10.1016 / S1074-7613 (00) 80065-5. PMID 10403641.
- ^ а б Леонард Дж. А., Филцен Т., Картер С. К., Шефер М., Коллинз К. Л. (июль 2011 г.). «ВИЧ-1 Nef нарушает внутриклеточный транспорт основного комплекса гистосовместимости класса I, CD4, CD8 и CD28 разными путями, которые имеют общие элементы». Журнал вирусологии. 85 (14): 6867–81. Дои:10.1128 / JVI.00229-11. ЧВК 3126561. PMID 21543478.
внешняя ссылка
- Молекулярная антропология Yahoo Group
- База данных частот аллелей и гаплотипов HLA
- Номенклатура HLA Полный список белков класса I
- Обзор всей структурной информации, доступной в PDB за UniProt: P04439 (Антиген гистосовместимости HLA класса I, альфа-цепь) на PDBe-KB.