WikiDer > Ланостеринсинтаза
| ланостеринсинтаза | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Номер ЕС | 5.4.99.7 | ||||||||
| Количество CAS | 9032-71-7 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| Генная онтология | AmiGO / QuickGO | ||||||||
| |||||||||
Ланостеринсинтаза оксидосквален циклаза (OSC) фермент что обращает (S) -2,3-оксидосквален катиону протостерола и, наконец, ланостерин.[5] Ланостерол является ключевым четырехкольцевым промежуточным звеном в холестерин биосинтез.[6][7] У человека ланостеринсинтаза кодируется LSS. ген.[8][9]
В эукариоты, ланостеринсинтаза является интегральный монотопный белок связанный с цитозольный сторона эндоплазматический ретикулум.[10] Некоторые данные свидетельствуют о том, что фермент растворимый, не-мембранный белок в немногих прокариоты которые производят это.[11]
Из-за роли фермента в холестерин биосинтез, есть интерес к ланостеринсинтазе ингибиторы в качестве потенциальных препаратов, снижающих уровень холестерина, в дополнение к существующим статины.[12]
Механизм
Хотя некоторые данные о механизме были получены с использованием ингибиторы суицида, мутагенез исследования, и моделирование гомологии, до сих пор не совсем понятно, как фермент катализирует образование ланостерин.[12]
Начальное протонирование эпоксида и раскрытие цикла
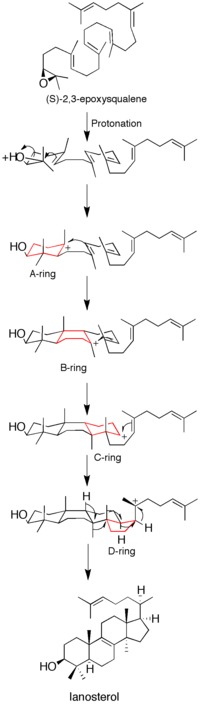
Перед приобретением протеина Рентгеновская кристаллическая структура, сайт-направленный мутагенез был использован для определения остатков, определяющих каталитическую активность фермента. Было установлено, что аспарагиновая кислота остаток (D455) и два гистидин остатки (H146 и H234) были важны для функции фермента. Кори и др. предположили, что аспарагиновая кислота действует, протонируя субстрат эпоксид кольцо, что увеличивает его восприимчивость к внутримолекулярный нападение ближайшего двойная связь, с H146, возможно, усиливая протонодонорную способность аспарагиновой кислоты за счет водородная связь.[13] После приобретения Рентгеновская кристаллическая структура фермента, роль D455 в качестве донора протонов эпоксида субстрата была подтверждена, хотя было обнаружено, что D455, скорее всего, стабилизируется водородными связями из двух цистеин остатков (C456 и C533), чем из ранее предложенного гистидина.[12]
Каскад образования колец
Протонирование эпоксида активирует субстрат, вызывая каскад реакций образования кольца. Всего формируется четыре кольца (от A до D), что дает холестерин позвоночник.[12] Хотя идея согласованного образования всех четырех колец высказывалась в прошлом, кинетические исследования с (S) -2,3-оксидосквален аналоги показали, что образование продукта достигается за счет дискретных карбокатион промежуточные продукты (см. Рисунок 1). Выделение моноциклических и бициклических продуктов из мутантов ланостеринсинтазы еще больше ослабило гипотезу о согласованном механизме.[14][15] Однако данные свидетельствуют о том, что раскрытие эпоксидного кольца и образование A-кольца согласованы.[16]
Структура
Ланостеринсинтаза - это двухдоменный мономерный белок.[10] состоит из двух связанных (α / α) бочкообразных доменов и трех меньших β-структуры. Фермент активный сайт находится в центре белка, закрытого суженным каналом. Прохождение подложки (S) -2,3-эпоксисквалена через канал требует изменения конформация белка. В эукариоты, а гидрофобный поверхность (6% от общей площади поверхности фермента) - это ER мембраносвязывающая область (см. фигура 2).[12]
Фермент содержит пять областей отпечатков пальцев, содержащих Gln-Trp мотивы, которые также присутствуют в очень похожем бактериальном ферменте сквален-гопенциклаза.[12] Остатки этих областей отпечатков пальцев содержат сложенные боковые цепи, которые, как считается, вносят вклад в стабильность ферментов во время сильного экзергонический реакции циклизации, катализируемые ферментом.[17]
Функция
Катализ образования ланостерина
Ланостеринсинтаза катализирует превращение (S) -2,3-эпоксисквален к ланостерин, ключевой четырехкольцевый промежуточный холестерин биосинтез.[6][7] Таким образом, он, в свою очередь, является предшественником эстрогены, андрогены, прогестагены, глюкокортикоиды, минералокортикоиды, и нейростероиды. В эукариоты фермент связан с цитозольный сторона эндоплазматический ретикулум мембрана.[10] Пока холестерин синтез в основном связан с эукариоты, несколько прокариоты было обнаружено, что они экспрессируют ланостерин-синтазу; он был обнаружен как растворимый белок в Метилококк капсульный.[11]
Катализ образования эпоксиланостерола
Ланостеринсинтаза также катализирует циклизацию 2,3; 22,23-диэпоксисквалена до 24 (S), 25-эпоксиланостерола,[18] который позже превращается в 24 (S), 25-эпоксихолестерин.[19] Поскольку сродство фермента к этой секунде субстрат больше, чем для моноэпокси (S) -2,3-эпоксисквалена, при частичном ингибировании превращения 2,3; 22,23-диэпоксисквалена в 24 (S) 25-эпоксиланостерол предпочтительнее ланостерин синтез.[20] Это имеет отношение к профилактике и лечению заболеваний.
Клиническое значение
Ингибиторы ферментов как препараты, снижающие уровень холестерина
Возрос интерес к ингибиторам ланостеринсинтазы как к препаратам для снижения уровня холестерина в крови и лечения атеросклероз. Широко популярные статины лекарства, которые в настоящее время используются для снижения ЛПНП (липопротеины низкой плотности) холестерин функция, подавляя ГМГ-КоА редуктаза Мероприятия.[6] Поскольку этот фермент катализирует образование предшественников намного выше по течению (S) -2,3-эпоксисквален и холестерин, статины может отрицательно влиять на количество промежуточных продуктов, необходимых для других путей биосинтеза (например, синтез изопреноиды, коэнзим Q). Таким образом, ланостеринсинтаза, которая более тесно связана с биосинтезом холестерина, чем ГМГ-КоА редуктаза, является привлекательной мишенью для наркотиков.[21]
Считается, что ингибиторы ланостеринсинтазы снижают ЛПНП и ЛПОНП холестерин двойным механизмом контроля. Исследования, в которых частично ингибируется ланостеринсинтаза, показали как прямое снижение ланостерин формирование и уменьшение ГМГ-КоА редуктаза Мероприятия. В оксистерин 24 (S), 25-эпоксиланостерин, который предпочтительно образуется, чем ланостерин во время частичного ингибирования ланостеринсинтазы, как полагают, отвечает за это ингибирование ГМГ-КоА редуктаза Мероприятия.[22]
Эволюция
Считается, что оксидоскваленциклазы (OSC, класс, к которому принадлежит ланостеринциклаза) произошли от бактериальной сквален-гопенциклазы (SHC), которая участвует в образовании гопаноиды. Филогенетические деревья сконструированные из аминокислотных последовательностей OSCs в различных организмах, предполагают единого общего предка и что путь синтеза развился только один раз.[23] Открытие стераны включая холестан в сланцах возрастом 2,7 млрд лет из Пилбара Кратон, Австралия, предполагает, что эукариоты с OSC и сложным стероидным оборудованием присутствовали в начале истории Земли.[24]
Рекомендации
- ^ а б c ENSG00000281289 GRCh38: Ensembl release 89: ENSG00000160285, ENSG00000281289 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000033105 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Декан PD, Ортис де Монтельяно PR, Блох К., Кори EJ (июнь 1967 г.). «Растворимая 2,3-оксидосквален стеролциклаза». Журнал биологической химии. 242 (12): 3014–5. PMID 6027261.
- ^ а б c Хафф MW, Телфорд DE (июль 2005 г.). «Властелин колец - механизм оксидосквалена: ланостеринциклаза становится кристально ясной». Тенденции в фармакологических науках. 26 (7): 335–340. Дои:10.1016 / j.tips.2005.05.004. PMID 15951028.
- ^ а б Ямамото С., Линь К., Блох К. (май 1969 г.). «Некоторые свойства микросомальной 2,3-оксидосквален стеролциклазы». Труды Национальной академии наук Соединенных Штатов Америки. 63 (1): 110–7. Bibcode:1969ПНАС ... 63..110Y. Дои:10.1073 / pnas.63.1.110. ЧВК 534008. PMID 5257956.
- ^ Бейкер СН, Мацуда С.П., Лю Д.Р., Кори Э.Д. (август 1995 г.). «Молекулярное клонирование человеческого гена, кодирующего ланостеринсинтазу, из библиотеки кДНК печени». Сообщения о биохимических и биофизических исследованиях. 213 (1): 154–160. Дои:10.1006 / bbrc.1995.2110. PMID 7639730.
- ^ Янг, Мишель; Чен, Хайминг; Лалиоти, Мария Д .; Антонаракис, Стилианос Э. (май 1996 г.). «Ген ланостеринсинтазы человека отображается на хромосоме 21q22.3». Генетика человека. 97 (5): 620–624. Дои:10.1007 / BF02281872. PMID 8655142. S2CID 21051816.
- ^ а б c Руф А., Мюллер Ф., Д'Арси Б., Штиле М., Кушнир Э., Хандшин С., Моранд Огайо, Тома Р. (март 2004 г.). «Монотопный мембранный белок оксидоскваленциклаза человека активен как мономер». Сообщения о биохимических и биофизических исследованиях. 315 (2): 247–254. Дои:10.1016 / j.bbrc.2004.01.052. PMID 14766201.
- ^ а б Lamb DC, Джексон CJ, Warrilow AG, Manning NJ, Kelly DE, Kelly SL (август 2007 г.). «Биосинтез ланостерина в прокариотах Methylococcus capsulatus: взгляд на эволюцию биосинтеза стеролов». Молекулярная биология и эволюция. 24 (8): 1714–1721. Дои:10.1093 / молбев / msm090. PMID 17567593.
- ^ а б c d е ж Тома Р., Шульц-Гаш Т., Д'Арси Б., Бенц Дж., Эби Дж., Демлоу Х., Хенниг М., Штиль М., Руф А. (ноябрь 2004 г.). «Понимание образования стероидного каркаса из структуры оксидоскваленциклазы человека». Природа. 432 (7013): 118–122. Bibcode:2004Натура 432..118Т. Дои:10.1038 / природа02993. PMID 15525992. S2CID 364281.
- ^ Кори EJ, Cheng CH, Baker CH, Matsuda SP, Li D, Song X (февраль 1997 г.). «Исследования сегментов связывания субстрата и каталитического действия ланостерин-синтазы. Маркировка сродства с карбокатионами, полученными из механизированных аналогов 2, 3-оксидосквалена и зондов сайт-направленного мутагенеза». Варенье. Chem. Soc. 119 (6): 1289–96. Дои:10.1021 / ja963228o.
- ^ Wu TK, Wang TT, Chang CH, Liu YT, Shie WS (ноябрь 2008 г.). "Важность остатка тирозина 707 оксидосквален-ланостеринциклазы Saccharomyces cerevisiae для образования бициклических колец и реакций депротонирования". Органические буквы. 10 (21): 4959–62. Дои:10.1021 / ol802036c. PMID 18842050.
- ^ Жубер Б.М., Хуа Л., Мацуда С.П. (февраль 2000 г.). «Стерическая масса в положении 454 в ланостеринсинтазе Saccharomyces cerevisiae влияет на образование В-кольца, но не на депротонирование». Органические буквы. 2 (3): 339–41. Дои:10.1021 / ol9912940. PMID 10814317.
- ^ Кори EJ, Cheng CH, Baker CH, Matsuda SP, Li D, Song X (февраль 1997 г.). «Методология получения чистой рекомбинантной ланостерол-синтазы S. cerevisiae с использованием системы экспрессии бакуловируса. Доказательства того, что расщепление оксирана и образование А-кольца связаны в биосинтезе ланостерола из 2,3-оксидосквалена». Варенье. Chem. Soc. 119 (6): 1277–88. Дои:10.1021 / ja963227w.
- ^ Wendt KU, Poralla K, Schulz GE (сентябрь 1997 г.). «Структура и функция скваленциклазы». Наука. 277 (5333): 1811–15. Дои:10.1126 / science.277.5333.1811. PMID 9295270.
- ^ Кори EJ, Гросс СК (август 1967). «Образование стеринов под действием 2,3-оксидосквален-стеролциклазы на искусственные субстраты 2,3: 22,23-диоксидосквален и 2,3-оксидо-22,23-дигидросквален». Журнал Американского химического общества. 89 (17): 4561–2. Дои:10.1021 / ja00993a079. PMID 6046552.
- ^ Нельсон Дж. А., Штекбек С. Р., Спенсер Т. А. (февраль 1981 г.). «Биосинтез 24,25-эпоксихолестерина из 2,3; 22,23-диоксида сквалена». Журнал биологической химии. 256 (3): 1067–8. PMID 7451488.
- ^ Буто О., Долис Д., Шубер Ф. (октябрь 1992 г.). «Предпочтительная циклизация 2,3 (S): 22 (S), 23-диоксидосквалена 2,3-оксидосквален-ланостеринциклазой млекопитающих». Сообщения о биохимических и биофизических исследованиях. 188 (2): 898–904. Дои:10.1016 / 0006-291X (92) 91140-L. PMID 1445330.
- ^ Telford DE, Lipson SM, Barrett PH, Sutherland BG, Edwards JY, Aebi JD, Dehmlow H, Morand OH, Huff MW (декабрь 2005 г.). «Новый ингибитор оксидосквалена: ланостеринциклаза подавляет выработку липопротеина очень низкой плотности аполипопротеина B100 (апоВ100) и усиливает катаболизм липопротеина низкой плотности апоВ100 за счет заметного снижения содержания холестерина в печени». Артериосклероз, тромбоз и биология сосудов. 25 (12): 2608–14. Дои:10.1161 / 01.ATV.0000189158.28455.94. PMID 16210564.
- ^ Панини С.Р., Гупта А., Секстон Р.С., Округ Е.Дж., Рудни Х. (октябрь 1987 г.). «Регулирование биосинтеза стеролов и активности редуктазы 3-гидрокси-3-метилглутарил-кофермента А в культивируемых клетках прогестероном». Журнал биологической химии. 262 (30): 14435–40. PMID 3667583.
- ^ Пирсон А., Будин М., Брокс Дж. Дж. (Декабрь 2003 г.). «Филогенетические и биохимические доказательства синтеза стеролов у бактерии Gemmata obscuriglobus». Труды Национальной академии наук Соединенных Штатов Америки. 100 (26): 15352–7. Bibcode:2003ПНАС..10015352П. Дои:10.1073 / pnas.2536559100. ЧВК 307571. PMID 14660793.
- ^ Brocks JJ, Logan GA, Buick R, Summons RE (август 1999 г.). «Архейские молекулярные окаменелости и ранний рост эукариот». Наука. 285 (5430): 1033–6. CiteSeerX 10.1.1.516.9123. Дои:10.1126 / science.285.5430.1033. PMID 10446042.
дальнейшее чтение
- Ресслер Э., Миттаз Л., Ду И, Скотт Х.С., Чанг Дж., Россье С., Гиппони М., Мацуда С.П., Мюнке М., Антонаракис С.Е. (ноябрь 1999 г.). «Структура гена ланостеринсинтазы человека и его анализ в качестве кандидата на холопрозэнцефалию (HPE1)». Генетика человека. 105 (5): 489–95. Дои:10.1007 / s004390051135. PMID 10598817.
- Ма Дж., Демпси А.А., Стаматиу Д., Маршалл К.В., Лью С.К. (март 2007 г.). «Идентификация паттернов экспрессии лейкоцитарных генов, связанных с уровнями липидов в плазме у людей». Атеросклероз. 191 (1): 63–72. Дои:10.1016 / j.atherosclerosis.2006.05.032. PMID 16806233.
- Beyea MM, Heslop CL, Sawyez CG, Edwards JY, Markle JG, Hegele RA, Huff MW (февраль 2007 г.). «Избирательная регуляция LXR-регулируемых генов ABCA1, ABCG1 и APOE в макрофагах посредством увеличения эндогенного синтеза 24 (S), 25-эпоксихолестерина». Журнал биологической химии. 282 (8): 5207–16. Дои:10.1074 / jbc.M611063200. PMID 17186944.
- Данг Х, Лю И, Панг В., Ли Ц, Ван Н., Шуй Дж.Й., Чжу Ю. (март 2009 г.). «Подавление 2,3-оксидоскваленциклазы диетой с высоким содержанием жиров способствует опосредованному Х-рецептором-альфа улучшению липидного профиля печени». Журнал биологической химии. 284 (10): 6218–26. Дои:10.1074 / jbc.M803702200. ЧВК 2649084. PMID 19119143.
- Кимура К., Вакамацу А., Судзуки Ю., Ота Т., Нисикава Т., Ямасита Р., Ямамото Дж., Секин М., Цуритани К., Вакагури Х., Исии С., Сугияма Т., Сайто К., Исоно Ю., Ирие Р., Кушида Н., Йонеяма Т. , Otsuka R, Kanda K, Yokoi T, Kondo H, Wagatsuma M, Murakawa K, Ishida S, Ishibashi T, Takahashi-Fujii A, Tanase T, Nagai K, Kikuchi H, Nakai K, Isogai T, Sugano S (январь 2006 г. ). «Диверсификация транскрипционной модуляции: широкомасштабная идентификация и характеристика предполагаемых альтернативных промоторов генов человека». Геномные исследования. 16 (1): 55–65. Дои:10.1101 / гр. 4039406. ЧВК 1356129. PMID 16344560.
- Сун СК, Сибуя М., Санкава Ю., Эбизука Ю. (октябрь 1995 г.). «Молекулярное клонирование кДНК, кодирующей ланостеринсинтазу человека». Биологический и фармацевтический бюллетень. 18 (10): 1459–61. Дои:10.1248 / bpb.18.1459. PMID 8593458.
- Янг М., Чен Х, Лалиоти, доктор медицины, Антонаракис С.Е. (май 1996 г.). «Ген ланостеринсинтазы человека отображается на хромосоме 21q22.3». Генетика человека. 97 (5): 620–4. Дои:10.1007 / BF02281872. PMID 8655142. S2CID 21051816.
- Peffley DM, Gayen AK, Morand, Огайо (август 1998 г.). "Подавление уровней мРНК 3-гидрокси-3-метилглутарил-кофермента А-редуктазы и синтеза в клетках С100 сирийского хомяка ингибитором оксидоскваленциклазы [4 '- (6-аллилэтил-аминогексилокси) -2'-фтор- фенил] - (4-бромфенил) метанон (Ro 48-8071): сравнение с симвастатином ». Биохимическая фармакология. 56 (4): 439–49. Дои:10.1016 / S0006-2952 (98) 00083-5. PMID 9763219.
- Лу И, Долле М.Э., Имхольц С., Ван 'т Слот Р., Вершурен В.М., Вейменга С., Фескенс Э.Дж., Бур Д.М. (декабрь 2008 г.). «Множественные генетические варианты по пути-кандидату влияют на концентрацию холестерина липопротеинов высокой плотности в плазме». Журнал липидных исследований. 49 (12): 2582–9. Дои:10.1194 / мл. M800232-JLR200. PMID 18660489.
- Cheng J, Kapranov P, Drenkow J, Dike S, Brubaker S, Patel S, Long J, Stern D, Tammana H, Helt G, Sementchenko V, Piccolboni A, Bekiranov S, Bailey DK, Ganesh M, Ghosh S, Bell I , Герхард Д.С., Гингерас Т.Р. (май 2005 г.). «Транскрипционные карты 10 хромосом человека с разрешением 5 нуклеотидов». Наука. 308 (5725): 1149–54. Bibcode:2005Наука ... 308.1149C. Дои:10.1126 / science.1108625. PMID 15790807. S2CID 13047538.
- Pyrah IT, Калиновски А., Джексон Д., Дэвис В., Дэвис С., Олдридж А., Гривз П. (2001). «Токсикологические поражения, связанные с двумя родственными ингибиторами оксидоскваленциклазы у собак и мышей». Токсикологическая патология. 29 (2): 174–9. Дои:10.1080/019262301317052440. PMID 11421484. S2CID 38721319.
- Боналду М.Ф., Леннон Г., Соарес МБ (сентябрь 1996 г.). «Нормализация и вычитание: два подхода для облегчения открытия генов». Геномные исследования. 6 (9): 791–806. Дои:10.1101 / гр.6.9.791. PMID 8889548.
- Руф А., Мюллер Ф., Д'Арси Б., Штиле М., Кушнир Э., Хандшин С., Моранд Огайо, Тома Р. (март 2004 г.). «Монотопный мембранный белок оксидоскваленциклаза человека активен как мономер». Сообщения о биохимических и биофизических исследованиях. 315 (2): 247–54. Дои:10.1016 / j.bbrc.2004.01.052. PMID 14766201.
- Марк М., Мюллер П., Майер Р., Эйзель Б. (январь 1996 г.). «Влияние нового ингибитора 2,3-оксидоскваленциклазы на регуляцию биосинтеза холестерина в клетках HepG2». Журнал липидных исследований. 37 (1): 148–58. PMID 8820110.
внешняя ссылка
- Ланостерин + синтаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)