WikiDer > Лечение рака простаты - Википедия
| Лечение рака простаты | |
|---|---|
| Специальность | онкология |
Лечение рак простаты может включать активное наблюдение, хирургия, радиационная терапия - включая брахитерапия (брахитерапия простаты) и дистанционная лучевая терапия, протонная терапия, сфокусированный ультразвук высокой интенсивности (HIFU), криохирургия, гормональная терапия, химиотерапия, или какая-то комбинация. Лечение также распространяется на вмешательства, основанные на выживании. Эти вмешательства сосредоточены на пяти областях, включая: физические симптомы, психологические симптомы, наблюдение, укрепление здоровья и координацию помощи.[1] Однако опубликованный обзор обнаружил только высокий уровень доказательств для вмешательств, направленных на устранение физических и психологических симптомов и укрепление здоровья, без обзоров вмешательств ни для координации помощи, ни для наблюдения.[2] Предпочтительный вариант лечения зависит от стадии заболевания, Оценка Глисона, а PSA уровень. К другим важным факторам относятся возраст мужчины, его общее состояние здоровья и его мнение о потенциальных методах лечения и их возможных побочных эффектах. Потому что все виды лечения могут иметь значительные побочные эффекты, Такие как Эректильная дисфункция и недержание мочи, обсуждения лечения часто сосредотачиваются на балансировании целей терапии с рисками изменения образа жизни.
Выбор вариантов лечения может потребовать принятия сложных решений с множеством факторов. Например, радикальная простатэктомия после первичной лучевой недостаточности, технически сложная хирургическая операция, может быть неприемлемой.[3] Это может повлиять на решение о лечении.
Если рак распространился за пределы простаты, варианты лечения значительно меняются, поэтому большинство врачей, занимающихся лечением рака простаты, используют различные номограммы прогнозировать вероятность распространения. Лечение методом бдительного ожидания / активного наблюдения, HIFU, лучевой терапией, брахитерапией, криохирургией и хирургическим вмешательством обычно предлагается мужчинам, у которых рак остается в пределах простаты. Клиницисты могут назначить гормональную терапию и химиотерапию при заболевании, распространившемся за пределы простаты. Однако есть исключения: лучевая терапия может лечить некоторые запущенные опухоли, а гормональная терапия - некоторые опухоли на ранней стадии. Врачи также могут предложить криотерапия (процесс замораживания опухоли), гормональную терапию или химиотерапию, если первоначальное лечение не дает результатов и рак прогрессирует.[4]
Активное наблюдение
Активное наблюдение - это наблюдение и регулярное наблюдение без инвазивного лечения. В контексте заболевания простаты это обычно включает регулярные Анализы крови на ПСА и биопсия простаты. Активное наблюдение часто используется при подозрении на раннюю стадию медленно растущего рака простаты. Тем не мение, бдительное ожидание также может быть предложено, когда риски хирургического вмешательства, лучевой терапии или гормональной терапии перевешивают возможные преимущества. Другие методы лечения могут быть начаты при развитии симптомов или при появлении признаков ускорения роста рака.[нужна цитата]
Примерно одна треть мужчин, которые выбирают активное наблюдение за опухолями на ранней стадии, в конечном итоге имеют признаки прогрессирования опухоли, и им может потребоваться начать лечение в течение трех лет.[5] Мужчины, выбирающие активное наблюдение, избегают рисков хирургического вмешательства, лучевой терапии и других видов лечения. Риск прогрессирования заболевания и метастазирования (распространения рака) может быть увеличен, но этот повышенный риск кажется небольшим, если тщательно следовать программе наблюдения, обычно включающей серийные оценки уровня ПСА и повторные биопсии простаты каждые 1-2 года в зависимости от тенденции PSA.
Результаты исследования 2011 года показывают, что активное наблюдение - лучший выбор для пожилых пациентов из группы «низкого риска».[6]
Хирургия
Хирургическое удаление простаты или простатэктомия, является распространенным методом лечения рака простаты на ранней стадии или рака, который не поддавался лучевой терапии. Самый распространенный тип - радикальная позадилонная простатэктомия, когда хирург удаляет простату через разрез брюшной полости. Другой тип радикальная простатэктомия промежности, когда хирург удаляет простату через разрез в промежность, кожа между мошонка и анус. Радикальная простатэктомия также может выполняться лапароскопически через серию небольших (1 см) разрезов в брюшной полости с помощью хирургического робота или без него.
Радикальная простатэктомия
Радикальная простатэктомия эффективен при опухолях, не распространившихся за пределы простаты;[7] частота излечения зависит от факторов риска, таких как уровень ПСА и Глисон оценка. Однако это может вызвать нерв повреждение, которое может значительно изменить качество жизни выжившего после рака простаты. Радикальная простатэктомия была связана с большим снижением сексуальной функции и увеличением недержание мочи (в основном стрессовое недержание мочи) чем внешняя лучевая терапия, альтернативное лечение.[8]
Радикальная простатэктомия традиционно использовалась отдельно, когда рак локализован в простате. В случае положительных пределов или местнораспространенного заболевания, обнаруженного при патологии, адъювантная лучевая терапия может улучшить выживаемость. Хирургическое вмешательство также может быть предложено, когда рак не поддается лучевой терапии. Однако, поскольку лучевая терапия вызывает изменения тканей, простатэктомия после лучевой терапии имеет более высокий риск осложнений.
Лапароскопический доступ
Лапароскопическая радикальная простатэктомияLRP - это новый способ лечения простаты хирургическим путем. В отличие от открытой хирургической формы хирургии рака простаты, лапароскопическая радикальная простатэктомия требует меньшего разреза. Лапароскопическая радикальная простатэктомия, основанная на современных технологиях, таких как миниатюризация, волоконная оптика и т. Д., Является минимально инвазивным лечением рака простаты, но технически сложна и выполняется редко.[нужна цитата] в США.
Роботизированная помощь
Некоторые считают, что в руках опытного хирурга роботизированная лапароскопическая простатэктомия (RALP) может уменьшить положительные хирургические поля по сравнению с радикальная позадилонная простатэктомия (RRP) среди пациентов с раком простаты по данным ретроспективного исследования.[9] В снижение относительного риска составила 57,7%. Для пациентов с таким же риском, как и в этом исследовании (35,5% пациентов имели положительные хирургические поля после RRP), это приводит к абсолютное снижение риска 20,5%. 4.9 пациентов необходимо лечить, чтобы один из них получил пользу (количество, необходимое для лечения = 4,9). Другие недавние исследования показали, что RALP приводит к значительно более высокому уровню положительной маржи.[10] Другие исследования не показали разницы между роботизированной операцией и открытой операцией.[11] Относительные преимущества RALP и потенциальные преимущества перед открытой радикальной простатэктомией в настоящее время являются областью интенсивных исследований и дискуссий в урологии. Единственное доказанное и признанное преимущество RALP - это меньшая интраоперационная кровопотеря. Другие предлагаемые преимущества, помимо этого, не имеют точных данных и не получили широкого признания широким урологическим сообществом.
Трансуретральная резекция
Трансуретральная резекция простаты, обычно называемая «ТУРП», - это хирургическая процедура, выполняемая, когда трубка от мочевого пузыря к пенису (уретра) блокируется увеличением простаты. Как правило, ТУРП проводится по доброкачественная гиперплазия предстательной железы и не предназначен для окончательного лечения рака простаты. Во время ТУРП небольшой инструмент (цистоскоп) вводится в половой член, и блокирующая простата срезается прижигание.
Криохирургия
Криохирургия - еще один метод лечения рака простаты, при котором предстательная железа подвергается воздействию отрицательных температур.[12] Криохирургия менее инвазивна, чем радикальная простатэктомия, и Общая анестезия используется реже. Под контролем УЗИ метод, изобретенный доктором Гэри Оник,[13] металлические стержни вставляются через обшивку промежность в простату. Для охлаждения стержней используется высокоочищенный газ аргон, замораживающий окружающие ткани до −186 °.C (−302 °F). Когда вода в клетках простаты замерзает, клетки умирают. В уретра защищен от замерзания катетер наполненный теплой жидкостью. Импотенция возникает в девяноста процентах случаев.[14]
Хирургическое удаление яичек
При метастатическом заболевании, когда рак распространился за пределы простаты, удаление яички (называется орхиэктомия) можно сделать для снижения уровня тестостерона и контроля роста рака. (См. Гормональную терапию ниже).
Осложнения операции
Наиболее частыми серьезными осложнениями хирургического вмешательства являются потеря контроль мочеиспускания и бессилие. Сообщаемая частота обоих осложнений широко варьируется в зависимости от того, как они оцениваются, кем и через сколько времени после операции, а также от условий (например, академические серии по сравнению с данными на уровне сообщества или населения).
Эректильная дисфункция
Хотя ощущение полового члена и способность достигать оргазм обычно остаются нетронутыми, часто нарушается эрекция и эякуляция. Лекарства, такие как силденафил (Виагра), тадалафил (Сиалис), или варденафил (Левитра) может восстановить некоторую потенцию. Для большинства мужчин с заболеванием, ограниченным органом, более ограниченная «нервосберегающая» техника может помочь уменьшить недержание мочи и импотенцию.[15]
Недержание мочи
Радикальная простатэктомия, трансуретральная резекция простаты (ТУРП) и лучевая терапия являются основными причинами стрессовое недержание мочи у мужчин, главной причиной которого является радикальная простатэктомия.[16] В большинстве случаев недержание мочи проходит в течение 12 месяцев при консервативном лечении. Множественные факторы, такие как травма уретральный сфинктер или нервные пучки могут играть роль, вызывая в основном стрессовое недержание мочи.[17] Стрессовое недержание мочи происходит, когда уретральный сфинктер (мышечный сфинктер, закрывающий мочевой пузырь) не закрывается должным образом, что приводит к утечке мочи в ситуациях, когда давление в брюшной полости выше обычного, например, при смехе, чихании или кашле.
Консервативное лечение, такое как мышца тазового дна обучение персонала (Упражнение Кегеля) был назначен для улучшения удержания мочи, доказательства эффективности у мужчин после радикальной простатэктомии недавно были поставлены под сомнение. Согласно информации рандомизированного контрольного исследования «Мужчины после хирургии простаты» (MAPS), тренировка мышц тазового дна не оказалась терапевтической или рентабельной для улучшения удержания мочи.[18]
Другие методы лечения включают использование зажимы для полового члена, трансуретральные наполнители и катетеры, однако наиболее часто используемые хирургические методы лечения - это установка уретральный слинг или же искусственный мочевой сфинктер.[16] У пациентов с недержанием мочи при стрессе от умеренной до тяжелой после операции на простате искусственный мочевой сфинктер это лечение выбора после того, как все другие консервативные меры не дали результата.[19]
Радиационная терапия
Радиационная терапия, также известная как лучевая терапия, часто используется для лечения всех стадий рака простаты. Его также часто используют после операции, если операция не помогла вылечить рак. Лучевая терапия использует ионизирующего излучения убить раковые клетки простаты. При всасывании в ткани ионизирующего излучения такие как гамма и рентгеновские лучи повреждают ДНК в раковых клетках, что увеличивает вероятность апоптоза (гибели клеток). Нормальные клетки способны восстанавливать радиационные повреждения, а раковые - нет. Лучевая терапия использует этот факт для лечения рака. При лечении рака простаты используются два разных вида лучевой терапии: внешняя лучевая терапия и брахитерапия (конкретно брахитерапия простаты).
Наружная лучевая терапия

Внешняя лучевая терапия (ДЛТ) использует линейный ускоритель для получения рентгеновских лучей высокой энергии, которые направляются лучом в сторону простаты. Методика, называемая лучевой терапией с модуляцией интенсивности (IMRT) может использоваться для регулировки луча излучения в соответствии с формой опухоли, что позволяет вводить более высокие дозы в простату и семенные пузырьки с меньшим повреждением мочевого пузыря и прямой кишки. Внешняя лучевая терапия обычно проводится в течение нескольких недель с ежедневным посещением центра лучевой терапии. Новые виды лучевой терапии, такие как IMRT, имеют меньше побочных эффектов, чем традиционное лечение. Однако в краткосрочной перспективе ДЛТ ассоциируется с резким ухудшением симптомов обструкции мочевыводящих путей и кишечника. Было показано, что со временем эти симптомы уменьшаются.[8] Одиннадцать центров в США сейчас используют протонная терапия для рака простаты, при котором для уничтожения раковых клеток используются протоны, а не рентгеновские лучи. Исследователи также изучают типы стереотаксической лучевой терапии тела (SBRT) для лечения рака простаты.[20]
Брахитерапия
Брахитерапия на постоянных имплантатах является популярным методом лечения пациентов с признаками низкого и среднего риска, может проводиться в амбулаторных условиях и связана с хорошими 10-летними результатами при относительно низкой заболеваемости.[21] Он включает в себя размещение около 100 маленьких «семян», содержащих радиоактивный материал (например, йод-125 или же палладий-103) иглой через кожу промежность непосредственно в опухоль под спинальной или общей анестезией. Эти семена испускают рентгеновские лучи более низкой энергии которые могут путешествовать только на короткие расстояния. Хотя семена со временем становятся инертными, они остаются в простате надолго. Риск контакта с другими людьми с имплантированными семенами обычно считается незначительным.[22] Тем не менее, мужчинам рекомендуется обсудить со своими врачами какие-либо специальные временные меры предосторожности в отношении маленьких детей и беременных женщин.[23]
Использует
Лучевая терапия обычно используется при лечении рака простаты. Его можно использовать вместо хирургического вмешательства или после операции на ранней стадии рака простаты (адъювантная лучевая терапия). Лучевая терапия также может сочетаться с гормональной терапией при заболеваниях промежуточного риска, когда только хирургическое вмешательство или лучевая терапия с меньшей вероятностью излечивают рак. Некоторые онкологи-радиологи комбинируют внешнее лучевое облучение и брахитерапию в ситуациях среднего и высокого риска. Лучевая терапия часто используется в сочетании с гормональной терапией для пациентов из группы высокого риска.[24] Другие используют комбинацию «тройного воздействия»: лучевую терапию, брахитерапию и гормональную терапию. На поздних стадиях рака простаты облучение используется для лечения болезненных метастазов в кости или уменьшения компрессии спинного мозга.
Лучевая терапия также применяется после радикальной простатэктомии при рецидиве рака или при обнаружении нескольких факторов риска во время операции. В двух отдельных рандомизированных исследованиях было продемонстрировано, что лучевая терапия, проводимая сразу после операции при наличии факторов риска (положительный хирургический край, экстракапсулярное расширение, поражение семенных сосудов), снижает рецидив рака, уменьшает отдаленные метастазы и увеличивает общую выживаемость.[25]
Побочные эффекты
Побочные эффекты лучевой терапии могут проявиться через несколько недель после начала лечения. Оба типа лучевой терапии могут вызвать понос и мягкий ректальное кровотечение из-за лучевой проктит, а также возможное недержание мочи и импотенция. Симптомы имеют тенденцию улучшаться со временем, за исключением эрекции, которая обычно ухудшается с течением времени.
Новый метод уменьшения радиационного поражения прямой кишки у пациентов с раком простаты включает использование рассасывающегося распорка помещается между простатой и прямой кишкой.
Такие спейсеры коммерчески доступны в некоторых регионах и проходят клинические испытания в других.[26] Временно изменяя анатомию, эти продукты могут улучшить нацеливание на рак при минимальном риске для соседних здоровых тканей. Распорки для прямой кишки простаты должен быть совместим со всеми видами лечения лучевой терапией рака простаты, включая конформную 3D-терапию, IMRT, стереотаксическое излучение и брахитерапию.
Сравнение с хирургией
Множественные ретроспективные анализы показали, что общая выживаемость и выживаемость без признаков заболевания одинаковы при радикальной простатэктомии, дистанционной лучевой терапии и брахитерапии.[27]Однако недавнее ретроспективное исследование показывает, что у мужчин до 60 лет с раком простаты высокой степени выживаемость выше при хирургическом вмешательстве, чем при лучевом облучении.[28]Показатели импотенции при сравнении лучевой терапии с нервосберегающей хирургией аналогичны. Лучевая терапия приводит к более низким показателям недержания мочи по сравнению с хирургическим вмешательством, но более высокая частота случайных легких ректальных кровотечений.[29] Мужчины, прошедшие дистанционную лучевую терапию, могут иметь немного более высокий риск дальнейшего развития рак толстой кишки и Рак мочевого пузыря.[30]
Поскольку рак простаты, как правило, является мультифокальным заболеванием, традиционная простатэктомия устраняет все локальные поражения, удаляя всю простату. Однако была выдвинута гипотеза, что «индексное поражение» может быть ответственным за прогрессирование заболевания. Следовательно, фокальная терапия, направленная на поражение индекса, может эффективно лечить рак простаты, сохраняя при этом остальную часть железы. Интервенционные радиологи начали лечить рак простаты минимально инвазивными методами лечения, такими как криоабляция, HIFU, радиочастотная абляцияи фотодинамическая терапия, которая позволяет проводить фокальную терапию с использованием визуального контроля. Эти методы лечения все еще находятся на начальной или экспериментальной стадии; однако, поскольку они сохраняют ткань, они потенциально могут уменьшить неблагоприятные исходы лечения, такие как импотенция и недержание мочи. В небольшом проспективном исследовании, опубликованном в European Urology в феврале 2015 года, оценивалось фокальное лечение индексных поражений с помощью HIFU у пациентов с мультифокальным раком простаты, и было обнаружено, что большинство мужчин вернулись к исходной мочеполовой функции, и 86% мужчин не имели клинически значимого рака простаты. в один год.[31] Небольшие нерандомизированные когортные исследования со средним периодом наблюдения 17–47 месяцев показали, что криоабляция, HIFU, и фототерапия связаны с низкими показателями побочных эффектов и ранним контролем над заболеванием, составляющим 83–100% на основании отрицательных биопсий.[32]
Пациенты, которым может быть особенно полезна фокальная терапия с HIFU, - это мужчины с рецидивирующим раком после удаления железы. Частота рецидивов рака после хирургической резекции может достигать 15-20%. МРТ улучшает раннее выявление рака, поэтому терапия под МРТ может применяться для лечения рецидивов заболевания. Кроме того, для мужчин, которые уже не прошли спасительную лучевую терапию и у которых остались ограниченные терапевтические возможности, интервенционная терапия может предложить больше шансов потенциально вылечить их болезнь. Хотя недавние исследования продемонстрировали выполнимость этих методов лечения, необходима дополнительная работа для дальнейшей оценки того, какие пациенты лучше всего подходят для этих процедур, и определения долгосрочной эффективности.[33]
Сфокусированный ультразвук высокой интенсивности
Сфокусированный ультразвук высокой интенсивности (HIFU) впервые был использован в 1940-х и 1950-х годах в попытках уничтожить опухоли в центральной нервной системе. С тех пор было показано, что HIFU эффективен при разрушении злокачественной ткани в головном мозге, простате, селезенке, печени, почках, груди и костях.[34]
HIFU при раке простаты использует ультразвук для удаления / разрушения ткани простаты. Во время процедуры HIFU звуковые волны используются для нагрева ткани простаты, тем самым разрушая раковые клетки. По сути, ультразвуковые волны фокусируются на определенных участках простаты, чтобы устранить рак простаты с минимальным риском поражения других тканей или органов. Температура в фокусе звуковых волн может превышать 100 °.C (212 °F).[34] Однако многие исследования HIFU были выполнены производителями устройств HIFU или членами консультативных комиссий производителей.[35]
Противопоказания к HIFU при раке простаты включают объем простаты более 40 граммов, что может предотвратить попадание целевых волн HIFU в переднюю и переднебазальную области простаты, анатомические или патологические состояния, которые могут препятствовать введению или перемещению зонда HIFU в прямая кишка и большой кальциноз внутри простаты, что может привести к рассеянию HIFU и нарушению передачи.[36]
Проведенное в Великобритании в 2012 г. исследование фокального HIFU на 41 пациенте не сообщило об отсутствии гистологических признаков рака у 77% мужчин, пролеченных (95% доверительный интервал: 61–89%) при 12-месячной целевой биопсии, и о низком уровне побочных эффектов со стороны мочеполовой системы.[37] Однако это не обязательно означает, что 77% мужчин окончательно излечились от рака простаты, поскольку в процессе биопсии присутствуют систематические и случайные ошибки выборки, и, следовательно, рецидивный или ранее не обнаруженный рак можно пропустить.[38]
Изменения образа жизни
Увеличение простаты может вызвать затруднения при полном опорожнении мочевого пузыря. Эта ситуация, при которой в мочевом пузыре есть остаточный объем, может привести к таким осложнениям, как: цистит и камни в мочевом пузыре, также часто встречается у пациентов с доброкачественная гиперплазия простаты. У мужчин с симптомами часто предлагалось изменить положение мочеиспускания, однако результаты исследования показали неоднородность. А метаанализ людей с увеличенной простатой и здоровых мужчин показали значительное уменьшение остаточного объема, в то время как была обнаружена тенденция к улучшению скорости потока мочи и уменьшению времени мочеиспускания.[39] Считается, что эффект смены положения возникает из-за расслабления мускулатуры таза, которая сокращается в положении стоя, что влияет на уродинамику.
Частые упражнения, такие как быстрая ходьба, могут замедлить прогрессирование рака простаты.[40][41][сомнительный ]
Гормональная терапия
Андрогенная депривационная терапия
Гормональная терапия использует лекарства или хирургическое вмешательство, чтобы предотвратить попадание клеток рака простаты дигидротестостерон (DHT), гормон, вырабатываемый простатой и необходимый для роста и распространения большинства клеток рака простаты. Блокирование DHT часто приводит к тому, что рак простаты перестает расти и даже сокращается. Однако гормональная терапия редко излечивает рак простаты, потому что рак, который первоначально реагирует на гормональную терапию, обычно становится устойчивым через один-два года. Поэтому гормональная терапия обычно используется, когда рак распространился из простаты. Его также можно назначать некоторым мужчинам, проходящим лучевую терапию или операцию, чтобы предотвратить возвращение рака.[42]
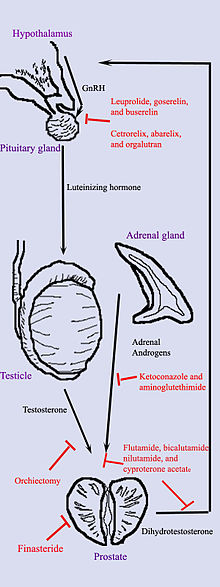
Гормональная терапия рака простаты нацелена на пути, которые организм использует для выработки ДГТ. А Обратная связь вовлечение яичек, гипоталамуса, гипофиза, надпочечников и предстательной железы контролирует уровень DHT в крови. Во-первых, низкий уровень ДГТ в крови стимулирует гипоталамус производить гонадотропин-рилизинг-гормон (ГнРГ). Затем гонадолиберин стимулирует гипофиз производить лютеинизирующий гормон (ЛГ), а ЛГ стимулирует яички производить тестостерон. Наконец, тестостерон из яичек и дегидроэпиандростерон из надпочечники стимулируют простату производить больше ДГТ. Гормональная терапия может снизить уровень ДГТ, прервав этот путь в любой момент. Существует несколько форм гормональной терапии:
- Орхиэктомия«кастрация» - это операция по удалению яичек. Поскольку яички производят большую часть тестостерона в организме, после орхиэктомии уровень тестостерона падает. Теперь простате не только не хватает стимула тестостерона для выработки ДГТ, но и недостаточно тестостерона для превращения в ДГТ. Орхиэктомия считается золотым стандартом лечения.[43]
- Антиандрогены такие лекарства, как флутамид, нилутамид, бикалутамид, энзалутамид, апалутамид, и ципротерона ацетат которые напрямую блокируют действие тестостерона и ДГТ в клетках рака простаты.
- Лекарства, которые блокируют выработку андрогенов надпочечников, таких как ДГЭА, включают: кетоконазол и аминоглутетимид. Поскольку надпочечники вырабатывают лишь около 5% андрогенов организма, эти лекарства, как правило, используются только в сочетании с другими методами, которые могут блокировать 95% андрогенов, вырабатываемых яичками. Эти комбинированные методы называются тотальной андрогенной блокадой (ТАБ). ТАБ также можно получить с помощью антиандрогенов.
- Действие ГнРГ можно прервать одним из двух способов. Антагонисты ГнРГ Такие как абареликс и дегареликс подавляют производство ЛГ, воздействуя непосредственно на переднюю долю гипофиза. Агонисты ГнРГ Такие как лейпрорелин и гозерелин подавляют ЛГ в процессе подавление после начального эффекта стимуляции, который может вызвать начальную вспышку опухоли. Чтобы предотвратить стимуляцию роста опухоли во время начального выброса ЛГ, за неделю до и через три недели после введения агонистов ГнРГ назначают антиандрогены, такие как ацетат ципротерона. Абареликс и дегареликс являются примерами антагонистов GnRH, тогда как агонисты GnRH включают лейпролид, гозерелин, Triptorelin, и Бусерелин. Первоначально агонисты ГнРГ увеличивать производство LH. Однако из-за того, что постоянный запас лекарства не соответствует естественному ритму выработки в организме, выработка как ЛГ, так и ГнРГ снижается через несколько недель.[44]
- Абиратерона ацетат был одобрен FDA в апреле 2011 года для лечения резистентного к кастрации рака простаты у пациентов, которые потерпели неудачу доцетаксел терапия. Ацетат абиратерона ингибирует фермент, известный как CYP17, который используется в организме для выработки тестостерона.[45][46]
Наиболее успешными гормональными препаратами являются орхиэктомия и агонисты гонадолиберина. Несмотря на их более высокую стоимость, агонисты ГнРГ часто выбирают вместо орхиэктомии по косметическим и эмоциональным причинам. В конце концов, полная андрогенная блокада может оказаться лучше, чем орхиэктомия или использование только агонистов ГнРГ.
У каждого лечения есть недостатки, которые ограничивают его использование в определенных обстоятельствах. Хотя орхиэктомия - это операция с низким уровнем риска, психологическое воздействие удаления яичек может быть значительным, и бесплодие несомненно. Потеря тестостерона может вызвать приливы, увеличение веса, потеря либидо, расширение грудь (гинекомастия), импотенция, атрофия полового члена и остеопороз. Агонисты ГнРГ в конечном итоге вызывают те же побочные эффекты, что и орхиэктомия, но могут вызывать ухудшение симптомов в начале лечения. Когда агонисты ГнРГ используются впервые, скачки тестостерона могут привести к усилению боли в костях из-за метастатического рака, поэтому для подавления этих побочных эффектов часто добавляют антиандрогены или абареликс. Эстрогены обычно не используются, поскольку они увеличивают риск сердечно-сосудистые заболевания и сгустки крови. В целом антиандрогены не вызывают импотенции и обычно вызывают меньшую потерю костной и мышечной массы. Кетоконазол может вызвать повреждение печени при длительном применении аминоглютетимид может вызывать кожные высыпания.
Эстрогеновая терапия
Эстроген в высоких дозах терапия применяется при лечении рака простаты.[47] Эстрогены которые были использованы, включают диэтилстильбестрол, фосфестрол, этинилэстрадиол, сульфонат этинилэстрадиола, фосфат полиэстрадиола, и эстрадиол ундецилат, а также двойное эстрогенное и цитостатическое средство эстрамустин фосфат.[47][48] Новые эстрогены с улучшенной переносимостью и безопасностью, такие как GTx-758 также были изучены.[49][50] Эстрогены эффективны при раке простаты, потому что они являются функциональными антиандрогенами.[48][51] Они оба снижают уровень тестостерона до уровня кастрации через антигонадотропный последствия[48][51] и они уменьшают долю свободного и биодоступного тестостерона за счет увеличения глобулин, связывающий половые гормоны уровни.[49][51] Эстрогены также могут иметь прямое цитотоксический эффекты в простата.[48]
Было обнаружено, что эстрогены по эффективности эквивалентны андрогенная депривационная терапия с помощью хирургической или медицинской кастрации и нестероидные антиандрогены.[51] Кроме того, они предотвращают приливы, сохранять плотность костной ткани, сохранить немного сексуальный интерес, имеют качество жизни преимущества и намного дешевле, чем традиционная терапия депривации андрогенов.[52][53][54][55][56][57][58] Однако эстрогены вызывают феминизация и гинекомастия в качестве побочные эффекты.[53][54][55][57][58] Более того, при дозировке от 3 до 5 мг / сут диэтилстильбестрол может увеличивать сердечно-сосудистый смертность - особенно у тех пациентов, у которых уже есть нарушенная сердечно-сосудистая система. Диэтилстильбестрол в дозе 1-2 мг / день, по-видимому, безопасен и эффективен для пациентов с CRPC, у которых есть здоровая сердечно-сосудистая система и которые одновременно принимают аспирин в низких дозах.[51] Хотя наиболее часто используемые эстрогены, устный и синтетический эстрогены, такие как диэтилстильбэстрол и этинилэстрадиол, увеличивают смертность от сердечно-сосудистых заболеваний, некоторые эстрогены, а именно биоидентичный парентеральный эстрогены, такие как фосфат полиэстрадиола и высокие дозы трансдермальный эстрадиол, не делайте этого; это объясняется разной степенью влияния классов эстрогенов на синтез белка в печени и по расширению факторы коагуляции.[51]
| Маршрут / форма | Эстроген | Дозировка | |
|---|---|---|---|
| Устный | Эстрадиол | 1-2 мг 3 раза в день | |
| Конъюгированные эстрогены | 1,25–2,5 мг 3 раза в день | ||
| Этинилэстрадиол | 0,15–3 мг / день | ||
| Сульфонат этинилэстрадиола | 1-2 мг 1 раз в неделю | ||
| Диэтилстильбестрол | 1–3 мг / день | ||
| Диенестрол | 5 мг / день | ||
| Гексэстрол | 5 мг / день | ||
| Фосфестрол | 100–480 мг 1–3 раза в день | ||
| Хлортрианизен | 12–48 мг / день | ||
| Квадросилан | 900 мг / день | ||
| Эстрамустин фосфат | 140–1400 мг / день | ||
| Трансдермальный пластырь | Эстрадиол | 2–6x 100 мкг / день Мошонка: 1x 100 мкг / день | |
| Я или же SC инъекция | Бензоат эстрадиола | 1,66 мг 3 раза в неделю | |
| Дипропионат эстрадиола | 5 мг 1 раз в неделю | ||
| Эстрадиола валерат | 10-40 мг 1 раз в 1-2 недели | ||
| Эстрадиола ундецилат | 100 мг 1 раз в 4 недели | ||
| Полиэстрадиолфосфат | Один: 160–320 мг 1 раз в 4 недели С устным EE: 40–80 мг 1 раз в 4 недели | ||
| Estrone | 2–4 мг 2–3 раза в неделю | ||
| IV инъекция | Фосфестрол | 300–1200 мг 1–7 раз в неделю | |
| Эстрамустин фосфат | 240–450 мг / день | ||
| Примечание: Дозировки не обязательно эквивалентны. Источники: См. Шаблон. | |||
Рецидивирующее заболевание
После хирургия или лучевая терапия, ПСА может снова начать повышаться, что называется биохимическим рецидивом, если достигается определенный порог уровня ПСА (обычно 0,1 или 0,2 нг / мл для хирургии). При 10-летнем наблюдении после операции общий риск биохимического рецидива составляет 30–50%, в зависимости от исходного состояния риска, и спасательная лучевая терапия (СРТ) является единственным методом лечения.[59] СРТ часто назначают в сочетании с терапией по депривации андрогенов на срок до двух лет. Ретроспективное исследование пациентов, получавших СРТ в период с 1987 по 2013 год, показало, что 56% из 2460 пациентов не имели биохимической недостаточности после 5 лет наблюдения.[60] Среди тех, у кого до СРТ уровень ПСА был меньше 0,2, этот показатель составлял 71%.
Обширное заболевание
Паллиативная помощь при раке простаты на поздней стадии направлен на продление жизни и облегчение симптомов метастатического заболевания. Как указано над, абиратерон показывает некоторые перспективы при лечении рака простаты на поздней стадии. Это вызывает резкое снижение PSA уровни и опухоль размеры при агрессивном раке простаты на поздней стадии у 70% пациентов.[45][46] Химиотерапия может быть предложено для замедления прогрессирования заболевания и отсрочки появления симптомов. Наиболее часто используемый режим сочетает в себе химиотерапевтические препараты. доцетаксел с кортикостероид Такие как преднизон. Одно исследование показало, что лечение доцетакселом с преднизоном продлило жизнь с 16,5 месяцев для тех, кто принимал митоксантрон и преднизон, до 18,9 месяцев для тех, кто принимал доцетаксел + преднизон.[61] Бисфосфонаты Такие как золедроновая кислота было показано, что они замедляют развитие скелетных осложнений, таких как переломы или необходимость лучевой терапии у пациентов с гормонорезистентным метастатическим раком простаты.[62] Ксофиго это новый таргетинг на фармацевтические препараты с альфа-излучением костный метастаз. Тестирование фазы II показывает увеличение продолжительности жизни пациентов, уменьшение боли и улучшение качества жизни.
Боль в костях из-за метастатического заболевания лечится опиоид обезболивающие Такие как морфий и оксикодон. Внешняя лучевая терапия, направленная на метастазы в кости, может обеспечить: боль облегчение. Инъекции определенных радиоизотопы, Такие как стронций-89, фосфор-32, или же самарий-153, также нацелены на метастазы в кости и могут помочь облегчить боль.
Альтернативные методы лечения
В качестве альтернативы активному наблюдению или окончательному лечению также исследуются другие методы лечения рака простаты. Было показано, что уровень ПСА снижается у мужчин с очевидным локализованным раком простаты при соблюдении веганской диеты (разрешена рыба), регулярных физических упражнений и снижения стресса.[63] Эти результаты оказались устойчивыми после двухлетнего лечения. Однако это исследование не сравнивало веганскую диету ни с активным наблюдением, ни с окончательным лечением, и поэтому не может комментировать сравнительную эффективность веганской диеты в лечении рака простаты.[64]
В краткосрочных испытаниях было показано, что многие другие единичные агенты снижают уровень ПСА, замедляют время удвоения ПСА или оказывают аналогичное влияние на вторичные маркеры у мужчин с локализованным раком, такие как гранатовый сок или генистеин, изофлавон, обнаруженный в различных бобовых.[65][66]
Возможность совместного использования нескольких таких агентов, не говоря уже о сочетании их с изменением образа жизни, еще не изучена. Опубликован более подробный обзор естественных подходов к лечению рака простаты.[67]
Было показано, что нейтроны превосходят рентгеновские лучи при лечении рака простаты. Обоснование состоит в том, что опухоли, содержащие гипоксические клетки (клетки с достаточной концентрацией кислорода, чтобы быть жизнеспособными, но недостаточно, чтобы быть чувствительными к рентгеновскому излучению), и клетки, дефицитные по кислороду, устойчивы к уничтожению рентгеновскими лучами. Таким образом, нижний Коэффициент увеличения кислорода (OER) нейтронов дает преимущество. Также нейтроны имеют более высокую относительная биологическая эффективность (RBE) для медленно растущих опухолей, чем рентгеновские лучи, что дает преимущество в уничтожении опухолевых клеток.[68]
Профилактика
Ни один селен ни витамин Е оказались эффективными в предотвращении рак простаты.[69]
Компромиссы
В компромисс дилемма относится к выбору между ожидаемыми положительными и вредными эффектами с точки зрения выживаемости и качества жизни для конкретного лечения. Пример такого компромисса в лечении рака простаты включает симптомы мочевыделения и кишечника и уменьшение сексуальная функция.[70] Насколько распространены эти симптомы и какие расстройства они вызывают, варьируется в зависимости от типа лечения и у разных людей.[71]
Один из вариантов - обменять неповрежденный сексуальная функция за возможность увеличения продолжительности жизни из-за отсутствия лечебного лечения. Выбор предполагает компромисс, поэтому для человека и врача крайне важно иметь доступ к информации об установленных преимуществах лечения и побочных эффектах. Шведское исследование показало, что готовность пойти на такой компромисс значительно различается среди мужчин.[70] В то время как шесть из десяти были готовы рассмотреть компромисс между продолжительностью жизни и сохранной сексуальной функцией, учитывая нынешние знания о преимуществах лечения клинически локализованного рака простаты, четверо из десяти заявили, что они при любых обстоятельствах выберут лечение независимо от риск снижения половой функции. Доступ к достоверной эмпирической информации имеет решающее значение для принятия такого решения. Ключевые факторы здесь - это отношение человека к болезни, его эмоциональные ценности и религиозные убеждения. Значительная часть людей и врачей испытывают стресс при оценке компромисса между различными вариантами лечения и побочными эффектами лечения, что усугубляет стресс от диагностированного рака; ситуация усугубляется тем, что восемь из десяти человек с раком простаты не имеют одному, которому можно доверять, кроме супруга, и каждый пятый живет в целом эмоциональная изоляция.[72] Американская урологическая ассоциация (AUA), Американское общество радиационной онкологии (ASTRO) и Общество урологической онкологии (SUO) выпустили совместное руководство по совместному принятию решений с пациентами с локализованным раком простаты, чтобы помочь пациентам ориентироваться в этих решениях.[73]
Смотрите также
Рекомендации
- ^ Резник, Мэтью Дж .; Лаккетти, Кристина; Бергман, Джонатан; Hauke, Ralph J .; Хоффман, Карен Э .; Kungel, Terrence M .; Морганс, Алисия К .; Пенсон, Дэвид Ф. (2015). «Руководство по лечению больных раком простаты: одобрение клинических рекомендаций Американского общества клинической онкологии». Журнал клинической онкологии. 33 (9): 1078–1085. Дои:10.1200 / JCO.2014.60.2557. PMID 25667275.
- ^ Кроуфорд-Уильямс, Фиона; Марш, Соня; Гудвин, Белинда С .; Ральф, Николас; Galvão, Daniel A .; Ньютон, Роберт У .; Чемберс, Сюзанна К .; Данн, Джефф (2018). «Вмешательства для выживания рака простаты: систематический обзор обзоров» (PDF). Психоонкология. 27 (10): 2339–2348. Дои:10.1002 / pon.4888. PMID 30255558.
- ^ Муравьев В., Эванс Б., Полашик Т.Дж. (2006). «Спасательная криоаблация простаты после неудачной первичной интерстициальной брахитерапии: возможный подход». Рак предстательной железы и заболевания предстательной железы. 9 (1): 99–101. Дои:10.1038 / sj.pcan.4500853. PMID 16314889.
- ^ «Краткий обзор рака простаты». shavemagazine.com.
- ^ Wu, H; Sun L; Moul JW; Wu HY; McLeod DG; Амлинг С; Lance R; Кусуда Л; Донахью Т; Фоли Дж; Чанг А; Sexton W; Содердаль Д. (март 2004 г.). «Бдительное ожидание и факторы, позволяющие прогнозировать вторичное лечение локализованного рака простаты». Журнал урологии. 171 (3): 1111–6. Дои:10.1097 / 01.ju.0000113300.74132.8b. PMID 14767282.
- ^ http://www.cancer.gov/ncicancerbulletin/041911/page2 Активное наблюдение может быть предпочтительным вариантом для некоторых мужчин с раком простаты В архиве 3 мая 2011 г. Wayback Machine
- ^ Билл-Аксельсон А., Холмберг Л., Рууту М., Хэггман М., Андерссон С.О., Брателл С., Спонгберг А., Буш С., Нордлинг С., Гармо Х., Палмгрен Дж., Адами ХО, Норлен Б.Дж., Йоханссон Ю.Э. (май 2005 г.). «Радикальная простатэктомия против осторожного ожидания при раннем раке простаты». Медицинский журнал Новой Англии. 352 (19): 1977–84. Дои:10.1056 / NEJMoa043739. PMID 15888698.
- ^ а б Chen C, Chen Z, Wang K, Hu L, Xu R, He X (ноябрь 2017 г.). «Сравнение связанного со здоровьем качества жизни при хирургическом вмешательстве и лучевой терапии локализованного рака простаты: систематический обзор и метаанализ». Oncotarget. 8 (58): 99057–99065. Дои:10.18632 / oncotarget.21519. ЧВК 5716791. PMID 29228751.
- ^ Смит Дж. А., Чан Р. С., Чанг С. С. и др. (Декабрь 2007 г.). «Сравнение частоты и расположения положительных хирургических полей при роботизированной лапароскопической радикальной простатэктомии и открытой позадилонной радикальной простатэктомии». Журнал урологии. 178 (6): 2385–9, обсуждение 2389–90. Дои:10.1016 / j.juro.2007.08.008. PMID 17936849.
- ^ Ou, YC; Ян ЧР; Ван Дж; Cheng CL; Пател В.Р. (май 2009 г.). «Сравнение роботизированной и ретропубической радикальной простатэктомии, выполненной одним хирургом». Противораковые исследования. 29 (5): 1637–42. PMID 19443379.
- ^ Ветчина, WS; Парк SY; Rha KH; Kim WT; Чой Ю.Д. (июнь 2009 г.). «Роботизированная радикальная простатэктомия у пациентов с местнораспространенным раком простаты возможна: результаты исследования в одном учреждении». Журнал лапароэндоскопических и передовых хирургических методов. 19 (3): 329–32. Дои:10.1089 / этап.2008.0344. PMID 19397390.
- ^ PreventProstateCancer.info: Краткий обзор рака простаты В архиве 2008-09-24 на Wayback Machine
- ^ «Криохирургическая система для разрушения опухолей замораживанием». 1994-08-02. Архивировано из оригинал на 2009-03-29.
- ^ Bahn, DK; Ли Ф; Badalament R; Кумар А; Greski J; Черник М. (август 2002 г.). «Прицельная криоаблация простаты: 7-летние результаты первичного лечения рака простаты». Урология. 60 (2 Дополнение 1): 3–11. Дои:10.1016 / S0090-4295 (02) 01678-3. PMID 12206842.
- ^ Гербер Г.С., Тистед Р.А., Скардино П.Т., Фромюллер Г.Г., Шредер Ф.Х., Полсон Д.Ф., Миддлтон А.В.-младший, Руксталис Д.Ф., Смит Д.А.-младший, Шеллхаммер П.Ф., Охори М., Чодак Г.В. (28 августа 1996 г.). «Результаты радикальной простатэктомии у мужчин с клинически локализованным раком простаты». JAMA: журнал Американской медицинской ассоциации. 276 (8): 615–9. Дои:10.1001 / jama.276.8.615. PMID 8773633.
- ^ а б Трост, Лэндон; Эллиотт, Дэниел С. (2012). «Стрессовое недержание мочи у мужчин: обзор вариантов и результатов хирургического лечения». Достижения в урологии. 2012: 287489. Дои:10.1155/2012/287489. ЧВК 3356867. PMID 22649446.
- ^ Хойланд, Кимберли; Васдев, Нихил; Аброф, Ахмед; Бустед, Грегори (2014). «Пострадикальное недержание простатэктомии: этиология и профилактика». Отзывы в урологии. 16 (4): 181–188. ISSN 1523-6161. ЧВК 4274175. PMID 25548545.
- ^ Глейзер С., Боачи С., Бакли Б. и др. (Июль 2011 г.). «Недержание мочи у мужчин после формальной индивидуальной тренировки мышц тазового дна после радикальной простатэктомии или трансуретральной резекции простаты (MAPS): два параллельных рандомизированных контролируемых испытания». Ланцет. 378 (9788): 328–37. Дои:10.1016 / S0140-6736 (11) 60751-4. HDL:2164/2366. PMID 21741700.
- ^ Thüroff, Joachim W .; Абрамс, Пол; Андерссон, Карл-Эрик; Артибани, Вальтер; Чаппл, Кристофер Р .; Дрейк, Маркус Дж .; Хампель, Кристиан; Neisius, Андреас; Шредер, Аннетт; Тубаро, Андреа (01.03.2011). «Рекомендации ЕАУ по недержанию мочи». Европейская урология. 59 (3): 387–400. Дои:10.1016 / j.eururo.2010.11.021. ISSN 0302-2838. PMID 21130559.
- ^ «Архивная копия». Архивировано из оригинал на 2009-07-15. Получено 2009-08-06.CS1 maint: заархивированная копия как заголовок (связь)
- ^ Наг С., Бейер Д., Фридланд Дж., Гримм П., Нат Р. (июль 1999 г.). «Рекомендации Американского общества брахитерапии (ABS) по перманентной трансперинеальной брахитерапии рака простаты». Международный журнал радиационной онкологии, биологии, физики. 44 (4): 789–99. Дои:10.1016 / S0360-3016 (99) 00069-3. PMID 10386635.
- ^ Перес, Калифорния; Hanks GE; Leibel SA; Зитман А.Л .; Fuks Z; Ли WR (1 декабря 1993 г.). «Локализованная карцинома простаты (стадии T1B, T1C, T2 и T3). Обзор лечения с помощью дистанционной лучевой терапии». Рак. 72 (11): 3156–73. Дои:10.1002 / 1097-0142 (19931201) 72:11 <3156 :: AID-CNCR2820721106> 3.0.CO; 2-G. PMID 7694785. Рассмотрение.
- ^ «Архивная копия». Архивировано из оригинал на 2010-03-04. Получено 2010-03-17.CS1 maint: заархивированная копия как заголовок (связь)
- ^ Д'Амико А.В., Манола Дж., Лоффредо М., Реншоу А.А., ДеллаКроче А.В., Кантофф П.В. (2004). «6-месячное подавление андрогенов плюс лучевая терапия против только лучевой терапии для пациентов с клинически локализованным раком простаты: рандомизированное контролируемое исследование». JAMA. 292 (7): 821–7. Дои:10.1001 / jama.292.7.821. PMID 15315996.
- ^ Томпсон И.М., Танген С.М., Парадело Дж. (2009). «Адъювантная лучевая терапия при патологическом раке простаты T3N0M0 значительно снижает риск метастазов и улучшает выживаемость: долгосрочное наблюдение в ходе рандомизированного клинического исследования». Журнал урологии. 181 (3): 956–62. Дои:10.1016 / j.juro.2008.11.032. ЧВК 3510761. PMID 19167731.
- ^ «Продукция - Аугменикс». Augmenix.com. Получено 2012-02-16.
- ^ Купелян П.А., Эльшайх М., Редди К.А., Циппе С., Кляйн Е.А. (август 2002 г.). «Сравнение эффективности местных методов лечения локализованного рака простаты в эпоху простатоспецифического антигена: большой опыт проведения радикальной простатэктомии и дистанционной лучевой терапии в одном учреждении». Журнал клинической онкологии. 20 (16): 3376–85. Дои:10.1200 / JCO.2002.01.150. PMID 12177097.
- ^ Хуанг Х., Мускателли С., Наслунд М., Бадиян С.Н., Кайзер А., Сиддики М.М. (январь 2019 г.). «Оценка смертности от рака с хирургическим вмешательством по сравнению с лучевой терапией в качестве первичной терапии локализованного рака простаты высокой степени у мужчин моложе 60 лет». Журнал урологии. 201 (1): 120–128. Дои:10.1016 / j.juro.2018.07.049. PMID 30059685.
- ^ Лоутон, Калифорния; Выиграл M; Пилепич М.В. Асбелл СО; Shipley WU; Hanks GE; Cox JD; Perez CA; Соус WT; Доггетт SR; и другие. (Сентябрь 1991 г.). «Последствия длительного лечения аденокарциномы простаты после внешнего лучевого облучения: анализ исследований RTOG 7506 и 7706». Международный журнал радиационной онкологии, биологии, физики. 21 (4): 935–9. Дои:10.1016 / 0360-3016 (91) 90732-Дж. PMID 1917622.
- ^ Бреннер, диджей; Curtis RE; Hall EJ; Рон Э (15 января 2000 г.). «Вторые злокачественные новообразования у пациентов с раком простаты после лучевой терапии по сравнению с хирургическим вмешательством». Рак. 88 (2): 398–406. CiteSeerX 10.1.1.385.7956. Дои:10.1002 / (SICI) 1097-0142 (20000115) 88: 2 <398 :: AID-CNCR22> 3.0.CO; 2-V. PMID 10640974.
- ^ Ахмед, Хашим У .; Дикинсон, Луиза; Чарман, Сьюзен; Вейр, Шраддха; Маккартан, Нил; Хиндли, Ричард Дж .; Фриман, Алекс; Киркхэм, Алекс П .; Саху, Махуа; Скотт, Ребекка; Аллен, Клэр; Ван дер Мейлен, Ян; Эмбертон, Марк (2015). «Фокальная абляция, направленная на поражение индекса при мультифокальном локализованном раке простаты: перспективное исследование развития». Европейская урология. 68 (6): 927–936. Дои:10.1016 / j.eururo.2015.01.030. PMID 25682339.
- ^ Каравитакис, Маркос; Ахмед, Хашим У .; Abel, Paul D .; Хейзелл, Стивен; Винклер, Матиас Х. (2011). «Фокальность опухоли при раке простаты: значение для фокальной терапии». Nature Reviews Клиническая онкология. 8 (1): 48–55. Дои:10.1038 / nrclinonc.2010.190. PMID 21116296.
- ^ Общество интервенционной радиологии. «Горячие и холодные методы интервенционной радиологии для лечения рецидивирующего рака простаты». www.biocompare.com. Biocompare: руководство покупателей для ученых-биологов. Получено 18 апреля 2018.
- ^ а б Гарднер Т.А., Кох М.О. (декабрь 2005 г.). «Терапия рака простаты с помощью фокусированного ультразвука высокой интенсивности». Клинический рак мочеполовой системы. 4 (3): 187–92. Дои:10.3816 / CGC.2005.n.031. PMID 16425987.
- ^ Соленья, Том; Гольденберг, Ларри; Стейнхофф, Гэри (2005). «Сфокусированный ультразвук высокой интенсивности для рака простаты» (PDF). Онкологическое агентство Британской Колумбии. Архивировано из оригинал (PDF) на 2014-08-26. Получено 2012-11-10.
- ^ Баркави А.Б., Кроуфорд Э.Д. (2008). «Растущая роль HIFU как неинвазивного абляционного метода лечения локализованного рака простаты». Онкология. 22 (2): 123–9, обсуждение 129, 133, 137 passim. PMID 18409659.
- ^ Ахмед, Хашим У; Хиндли, Ричард Дж; Дикинсон, Луиза; Фриман, Алекс; Киркхэм, Алекс П; Саху, Махуа; Скотт, Ребекка; Аллен, Клэр; Ван дер Меулен, Ян; Эмбертон, Марк (1 июня 2012 г.). «Фокальная терапия локализованного унифокального и мультифокального рака простаты: перспективное исследование развития». Ланцет онкологии. 13 (6): 622–632. Дои:10.1016 / S1470-2045 (12) 70121-3. ЧВК 3366323. PMID 22512844.
- ^ Ахмед, Хашим Уддин; Мур, Кэролайн; Лекорнет, Эмили; Эмбертон, Марк (1 мая 2010 г.). «Фокальная терапия рака простаты: факторы успеха и неудачи». Журнал эндоурологии. 24 (5): 819–825. Дои:10.1089 / конец 2009.0665. PMID 20380513.
- ^ де Йонг И, Пинкаерс Дж. Х., тен Бринк Р. М., Ликлама а Ниджехольт А. А., Деккерс О. М. (2014). «Мочеиспускание стоя или сидя: положение влияет на мужчин с увеличенной простатой. Систематический обзор и метаанализ». PLOS One. 9 (7): e101320. Bibcode:2014PLoSO ... 9j1320D. Дои:10.1371 / journal.pone.0101320. ЧВК 4106761. PMID 25051345.
- ^ Кенфилд С.А., Штампфер М.Дж., Джованнуччи Э., Чан Дж.М. (февраль 2011 г.). «Физическая активность и выживаемость после постановки диагноза рака предстательной железы в последующем исследовании медицинских специалистов». Журнал клинической онкологии. 29 (6): 726–32. Дои:10.1200 / JCO.2010.31.5226. ЧВК 3056656. PMID 21205749.
- ^ Ричман Э.Л., Кенфилд С.А., Стампфер М.Дж., Пасиорек А., Кэрролл П.Р., Чан Дж. М. (июнь 2011 г.). «Физическая активность после постановки диагноза и риск прогрессирования рака простаты: данные стратегического урологического исследования рака простаты». Исследования рака. 71 (11): 3889–95. Дои:10.1158 / 0008-5472.CAN-10-3932. ЧВК 3107352. PMID 21610110.
- ^ Робсон, М; Доусон Н. (июнь 1996 г.). «Как лучше всего лечить андроген-зависимый метастатический рак простаты?». Гематологические / онкологические клиники Северной Америки. 10 (3): 727–47. Дои:10.1016 / S0889-8588 (05) 70364-6. PMID 8773508. Рассмотрение.
- ^ «Немедленное и отсроченное лечение распространенного рака простаты: первые результаты испытаний Совета медицинских исследований. Группа исследователей Рабочей группы по раку простаты Совета медицинских исследований». Британский журнал урологии. 79 (2): 235–46. Февраль 1997 г. Дои:10.1046 / j.1464-410x.1997.d01-6840.x. PMID 9052476.
- ^ Лобло Д.А., Мендельсон Д.С., Талкотт Д.А., Вирго К.С., Сомерфилд М.Р., Бен-Йозеф Е., Миддлтон Р., Портерфилд Х., Шарп С.А., Смит Т.Дж., Таплин М.Э., Фогельзанг Н.Дж., Уэйд Д.Л. младший, Беннетт К.Л., Шер Г.И. клинической онкологии (15 июля 2004 г.). «Рекомендации Американского общества клинической онкологии по начальному гормональному лечению андроген-чувствительного метастатического, рецидивирующего или прогрессирующего рака простаты». Журнал клинической онкологии. 22 (14): 2927–41. Дои:10.1200 / JCO.2004.04.579. PMID 15184404. (Ошибка:Дои:10.1200 / JCO.2004.08.943)
- ^ а б де Боно, Иоганн; Герхард Аттард; Элисон Х. Рид; Тимоти А. Яп; Флоренс Рейно; Митч Доусетт; Сара Сеттатри; Мэри Барретт; Кристофер Паркер; Ванесса Мартинс; Элизабет Фолкерд; Джереми Кларк; Колин С. Купер; Стэн Б. Кэй; Дэвид Дирнали; Глория Ли (21 июля 2004 г.). «Фаза I клинических испытаний селективного ингибитора CYP17, ацетата абиратерона, подтверждает, что устойчивый к кастрации рак простаты обычно остается гормонально-зависимым». Журнал клинической онкологии. 26 (14): 4563–4571. Дои:10.1200 / JCO.2007.15.9749. PMID 18645193. (Ошибка:Дои:10.1200 / JCO.2012.43.7756)
- ^ а б Ричард Уорри (22 июля 2008 г.). «Препарат от смертельного рака простаты». BBC. Получено 2008-07-23.
- ^ а б Кристоффель Йос ван Бокстель; Будионо Сантосо; И. Ральф Эдвардс (2008). Преимущества и риски лекарств: Международный учебник клинической фармакологии. IOS Press. С. 458–. ISBN 978-1-58603-880-9.
- ^ а б c d Майкл Эттель; Эккехард Шиллингер (6 декабря 2012 г.). Эстрогены и антиэстрогены II: фармакология и клиническое применение эстрогенов и антиэстрогенов. Springer Science & Business Media. С. 540–542. Дои:10.1007/978-3-642-60107-1. ISBN 978-3-642-60107-1.
- ^ а б Косс С.К., Джонс А., Парк Д.Н., Нараянан Р., Барретт С.М., Кирби Д.Д., Веверка К.А., Миллер Д.Д., Мортон Р.А., Штайнер М.С., Далтон Д.Т. (март 2012 г.). «Доклиническая характеристика нового селективного агониста ERα дифенилбензамида для гормональной терапии рака простаты». Эндокринология. 153 (3): 1070–81. Дои:10.1210 / en.2011-1608. PMID 22294742.
- ^ Yu EY, Getzenberg RH, Coss CC, Gittelman MM, Keane T., Tutrone R, et al. (Февраль 2015 г.). «Селективный агонист рецептора эстрогена альфа GTx-758 снижает уровень тестостерона с уменьшением побочных эффектов терапии андрогенной депривации у мужчин с распространенным раком простаты». Европейская урология. 67 (2): 334–41. Дои:10.1016 / j.eururo.2014.06.011. PMID 24968970.
- ^ а б c d е ж Ваун Ки Хонг; Джеймс Ф. Холланд (2010). Holland-Frei Cancer Medicine 8. PMPH-США. С. 753–. ISBN 978-1-60795-014-1.
- ^ Али Шах С.И. (2015). «Новый потенциал парентерального эстрогена в качестве андрогенной депривационной терапии рака простаты». Южноазиатский журнал рака. 4 (2): 95–7. Дои:10.4103 / 2278-330X.155699. ЧВК 4418092. PMID 25992351.
- ^ а б Рассел Н., Чунг А., Гроссманн М. (август 2017 г.). «Эстрадиол для смягчения побочных эффектов терапии андрогенной депривации». Эндокринный рак. 24 (8): R297 – R313. Дои:10.1530 / ERC-17-0153. PMID 28667081.
- ^ а б Вибово Э., Вассерсуг Р.Дж. (сентябрь 2013 г.). «Влияние эстрогена на сексуальный интерес кастрированных мужчин: последствия для пациентов с раком простаты на терапии андрогенной депривации». Критические обзоры в онкологии / гематологии. 87 (3): 224–38. Дои:10.1016 / j.critrevonc.2013.01.006. PMID 23484454.
- ^ а б Вибово Э, Шеллхаммер П., Вассерсуг Р.Дж. (январь 2011 г.). «Роль эстрогена в нормальной мужской функции: клиническое значение для пациентов с раком простаты на терапии депривации андрогенов». Журнал урологии. 185 (1): 17–23. Дои:10.1016 / j.juro.2010.08.094. PMID 21074215.
- ^ Norman G, Dean ME, Langley RE, Hodges ZC, Ritchie G, Parmar MK, Sydes MR, Abel P, Eastwood AJ (февраль 2008 г.). «Парентеральный эстроген в лечении рака простаты: систематический обзор». Британский журнал рака. 98 (4): 697–707. Дои:10.1038 / sj.bjc.6604230. ЧВК 2259178. PMID 18268497.
- ^ а б Lycette JL, Bland LB, Garzotto M, Beer TM (декабрь 2006 г.). «Парентеральные эстрогены при раке простаты: может ли новый способ введения преодолеть старую токсичность?». Клинический рак мочеполовой системы. 5 (3): 198–205. Дои:10.3816 / CGC.2006.n.037. PMID 17239273.
- ^ а б Окрим Дж., Лалани Э. Н., Абель П. (октябрь 2006 г.). «Therapy Insight: парентеральное лечение эстрогенами при раке простаты - новая заря для старой терапии». Клиническая практика природы. Онкология. 3 (10): 552–63. Дои:10.1038 / ncponc0602. PMID 17019433.
- ^ Rans, K .; К. Берген; С. Йониау; Г. Де Меерлеер (2020). «Спасательная лучевая терапия при раке простаты». Клиническая онкология. 32 (3): 156–162. Дои:10.1016 / j.clon.2020.01.003. PMID 32035581.
- ^ Tendulkar, Rahul D .; Шри Агравал; Тяньмин Гао; Джейсон А. Эфстатиу; Томас М. Писанский; Джефф М. Михальски; Бриджит Ф. Кунц; и другие. (2016). «Современное обновление мультиинституциональной прогностической номограммы для спасительной лучевой терапии после радикальной простатэктомии». Журнал клинической онкологии. 34 (30): 3648–3654. Дои:10.1200 / JCO.2016.67.9647. PMID 27528718.
- ^ Таннок И.Ф., де Вит Р., Берри В.Р., Хорти Дж., Плузанска А., Чи К.Н., Удард С., Теодор С., Джеймс Н.Д., Турессон И., Розенталь М.А., Эйзенбергер М.А., Следователи TAX 327 (7 октября 2004 г.). «Доцетаксел плюс преднизон или митоксантрон плюс преднизон при распространенном раке простаты». Медицинский журнал Новой Англии. 351 (15): 1502–12. Дои:10.1056 / NEJMoa040720. PMID 15470213.
- ^ Саад Ф., Глисон Д.М., Мюррей Р., Чекмедиан С., Веннер П., Лакомб Л., Чин Дж. Л., Винхолс Дж. Дж., Гоас Дж. А., Чен Б. (2002). «Рандомизированное плацебо-контролируемое исследование золедроновой кислоты у пациентов с гормонорезистентной метастатической карциномой простаты». Журнал Национального института рака. 94 (19): 1458–68. Дои:10.1093 / jnci / 94.19.1458. PMID 12359855.
- ^ Орниш, D; Weidner G; Ярмарка WR; и другие. (2005). «Интенсивные изменения образа жизни могут повлиять на прогрессирование рака простаты». Журнал урологии. 174 (3): 1065–70. Дои:10.1097 / 01.ju.0000169487.49018.73. PMID 16094059.
- ^ Frattaroli J, Weidner G, Dnistrian AM, et al. (Декабрь 2008 г.). «Клинические события в исследовании образа жизни при раке простаты: результаты двухлетнего наблюдения». Урология. 72 (6): 1319–23. Дои:10.1016 / j.urology.2008.04.050. PMID 18602144.
- ^ Пантак, AJ; Leppert JT; Зомородян N; и другие. (2006). «Фаза II исследования гранатового сока для мужчин с повышением уровня специфического антигена простаты после операции или лучевой терапии по поводу рака простаты». Клинические исследования рака. 12 (13): 4018–26. Дои:10.1158 / 1078-0432.CCR-05-2290. PMID 16818701.
- ^ Кумар, Н.Б .; Кантор А; Аллен К; и другие. (2004). «Особая роль изофлавонов в снижении риска рака простаты». Простаты. 59 (2): 141–7. Дои:10.1002 / pros.10362. PMID 15042614.
- ^ Ярнелл, Эрик (1999). «Натуропатический подход к раку простаты, Часть 2: Рекомендации по лечению и профилактике». Альтернативные и дополнительные методы лечения. 5 (6): 360–368. Дои:10.1089 / act.1999.5.360.
- ^ Холл, Эрик Дж. (2000). Радиобиология для радиолога. Филадельфия, Пенсильвания: Липпинкотт Уильямс и Уильямс. стр.432–3. ISBN 978-0-06-141077-2.
- ^ Липпман С.М., Кляйн Э.А., Гудман П.Дж. и др. (Январь 2009 г.). «Влияние селена и витамина Е на риск рака простаты и других видов рака: испытание по профилактике рака селеном и витамином Е (SELECT)». JAMA. 301 (1): 39–51. Дои:10.1001 / jama.2008.864. ЧВК 3682779. PMID 19066370.
- ^ а б Хельгасон АР, Адольфссон Дж., Дикман П., Фредриксон М., Арвер С., Стейнек Г. (1996). «Снижение половой функции - наиболее серьезное расстройство, связанное с заболеванием, для пациентов с раком простаты». Британский журнал рака. 73 (11): 1417–1421. Дои:10.1038 / bjc.1996.268. ЧВК 2074472. PMID 8645589.
- ^ Хельгасон АР, Адольфссон Дж., Дикман П., Фредриксон М., Стейнек Г. (1998). «Дистресс из-за нежелательных побочных эффектов лечения рака простаты связан с ухудшением самочувствия (качества жизни)». Рак предстательной железы и заболевания предстательной железы. 1 (3): 128–133. Дои:10.1038 / sj.pcan.4500226. PMID 12496905.
- ^ Хельгасон АР, Дикман П.В., Адольфссон Дж., Стейнек Г. (2001). «Эмоциональная изоляция: распространенность и влияние на самочувствие среди больных раком простаты в возрасте 50-80 лет». Скандинавский журнал урологии и нефрологии. 35 (2): 97–101. CiteSeerX 10.1.1.549.5736. Дои:10.1080/003655901750170407. PMID 11411666.
- ^ «Обновленные данные для врачей: рак простаты». www.pcori.org. 2018-03-30. Получено 2020-01-29.