WikiDer > Феназин - Википедия
 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC Феназин[1] | |
| Другие имена Дибензопиразин 9,10-диазаантрацен Азофенилен акридизин | |
| Идентификаторы | |
3D модель (JSmol) | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.001.995 |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| C12ЧАС8N2 | |
| Молярная масса | 180,21 г / моль |
| Внешность | от желтого до коричневого кристаллического порошка |
| Плотность | 1,25 г / см3 |
| Температура плавления | 174–177 ° С (345–351 ° F, 447–450 К) |
| Точка кипения | 357,2 ° C (675,0 ° F, 630,3 К) при 760 мм рт. |
| не растворим в воде | |
| Опасности | |
| точка возгорания | 160,3 ° С (320,5 ° F, 433,4 К) |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
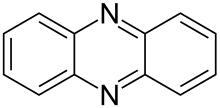
Феназин является органическое соединение с формулой (C6ЧАС4)2N2. Это дибензо аннулированный пиразин, и исходное вещество многих красители, такой как толуиленовый красный, индулины, и сафранины (и близкородственные евродины).[2] Феназин кристаллизуется в желтых иголках, которые плохо растворяются в алкоголь. Серная кислота растворяет его, образуя темно-красный раствор.
Синтез
Классически феназин получают реакцией нитробензола и анилина в Воль-Ауэ реакция. Другие методы включают:
- пиролиз барий соль азобензоата
- окисление анилин с оксид свинца
- окисление дигидрофеназина, который получают нагреванием пирокатехин с о-фенилендиамин.
- окисление орто-аминодифениламина с перекись свинца.
Производные
- Более сложные феназины, такие как нафтофеназины, нафтазины, и нафтолазины, может быть получен конденсацией орто-диамины с орто-хиноны[3] или окисление орто-диамина в присутствии α-нафтол, и разложением орто-анилидо - (- толуидидо- и др.) - азосоединения с разбавленным кислоты.
- Если используются алкил- или арил-орто-диамины, азоний базы получены. Азины в основном желтого цвета, дистиллируются без изменений и устойчивы к окислители. Они добавляют алкилйодиды легко образуя соли алкилазония, ангидрид формирование также происходит между этими гидроксильные группы. Растворяется в концентрированной серной кислоте с желтовато-зеленым цветом. флуоресценция.
- В родамины, которые тесно связаны с фталеинами, образуются путем конденсации алкил метааминофенолы с фталевый ангидрид в присутствии серной кислоты. Их соли мелкие красные красители. У входа в амино- или же гидроксил группы в молекула красители образуются. Моноаминопроизводные или евродины получают, когда арилмонамины конденсируются с ортоаминоазосоединениями; путем конденсации хинон дихлоримида или пара-нитрозодиметиланилина с монаминами, содержащими свободное пара-положение, или путем окисления орто-гидроксидиаминодипбениламинов. Это желтовато-красные твердые вещества, которые ведут себя как слабые базы, их соли претерпевают гидролитический диссоциация в водный раствор. При нагревании концентрированным соляная кислота аминогруппа заменена гидроксильной группой и фенольный евродолы производятся.
Аминофеназин
Многие аминофеназины являются заметными красителями. Двумя первыми синтетическими красителями являются аминофеназины, к ним относятся: снисходительный и нигрозин.[2]
В симметричный диаминофеназин является исходным веществом важного красителя нейтральный красный (диметилдиаминотолуфеназин). Его получают окислением орто-фенилендиамин с хлорид железа.
В родственном процессе окисление холодной смеси параграф-аминодиметиланилин и мета-толуилендиамин дает толуиленовый синий. Этот индамин образуется как промежуточный продукт, переходящий в красный цвет при кипячении; а также окисление диметилпарафенилендиатнина с метатолуилендиамином. Он кристаллизуется в оранжево-красных иголках, а его спиртовой раствор сильно флуоресцирует. Красит шелк и запуганный хлопок мелкий алый. Он коммерчески известен как нейтральный красный. Для феназония соли, видеть сафранин. Бензо [c] циннолин является изомер феназина, к которому он имеет такое же отношение, что и фенантрен несет к антрацен.
Натуральные продукты
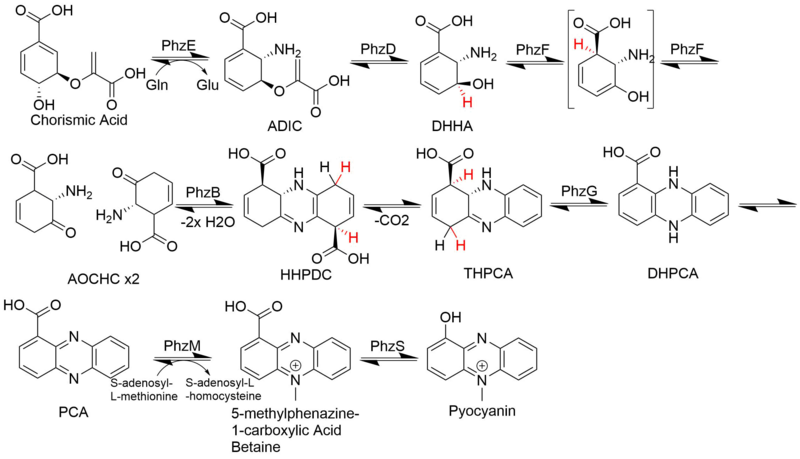
Единственные известные биологические источники соединений феназина имеют бактериальную природу.[4] Некоторые из родов, которые, как известно, продуцируют феназины, включают: Псевдомонады виды, Streptomyces spp. и Pantoea agglomerans. Эти феназины натуральные продукты были вовлечены в вирулентность и конкурентоспособность организмов-продуцентов. Например, феназин пиоцианин произведено Синегнойная палочка способствует его способности колонизировать легкие кистозный фиброз пациенты. Точно так же феназин-1-карбоновая кислота, продуцируемая рядом Pseudomonas, увеличивает выживаемость в почвенных средах и, как было показано, необходима для биологический контроль активность определенных штаммов.[5][6][7]
Биосинтез
Биосинтез феназина является ответвлением путь шикимовой кислоты в точке после хорисминовая кислота. Две молекулы этого промежуточного соединения, полученного из хоризматов, затем объединяются диагонально-симметричным образом с образованием основного феназинового каркаса. Затем последовательные модификации приводят к множеству феназинов с разными биологическая активность. Примером феназиновых алкалоидов являются пиоцианин, подкожная кислота и эсмеральдины.
Рекомендации
- ^ Номенклатура органической химии: Рекомендации ИЮПАК и предпочтительные названия 2013 (Синяя книга). Кембридж: Королевское химическое общество. 2014. с. 211. Дои:10.1039 / 9781849733069-FP001. ISBN 978-0-85404-182-4.
- ^ а б Хорст Бернет (2012). «Азиновые красители». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a03_213.pub3.
- ^ Александр Р. Суррей (1955). «Пиоцианин». Органический синтез.; Коллективный объем, 3, п. 753
- ^ Pierson, Leland S .; Пирсон, Элизабет А. (2010). «Метаболизм и функция феназинов у бактерий: влияние на поведение бактерий в окружающей среде и биотехнологические процессы». Прикладная микробиология и биотехнология. 86 (6): 1659–1670. Дои:10.1007 / s00253-010-2509-3. ISSN 0175-7598. ЧВК 2858273. PMID 20352425.
- ^ Тернер, Дж. М. и А. Дж. Мессенджер (1986). «Возникновение, биохимия и физиология образования феназиновых пигментов». Успехи микробной физиологии. Успехи микробной физиологии. 27: 211–275. Дои:10.1016 / S0065-2911 (08) 60306-9. ISBN 978-0-12-027727-8.
- ^ Макдональд М., Д. В. Мавроди; и другие. (2001). «Биосинтез феназина в Pseudomonas fluorescens: точка ветвления от первичного пути биосинтеза шикимата и роль феназин-1,6-дикарбоновой кислоты». Варенье. Chem. Soc. 123 (38): 9459–9460. Дои:10.1021 / ja011243. PMID 11562236.CS1 maint: несколько имен: список авторов (связь)
- ^ Дитрих Л. Е., Окегбе С., Прайс-Уилан А., Сахтах Н., Хантер Р. К., Ньюман Д. К. (2013). «Морфогенез бактериального сообщества тесно связан с внутриклеточным окислительно-восстановительным состоянием» (PDF). Журнал бактериологии. 195 (7): 1371–80. Дои:10.1128 / JB.02273-12. ЧВК 3624522. PMID 23292774.
![]() В эту статью включен текст из публикации, которая сейчас находится в всеобщее достояние: Чисхолм, Хью, изд. (1911). "Феназин". Британская энциклопедия. 21 (11-е изд.). Издательство Кембриджского университета. С. 364–365.
В эту статью включен текст из публикации, которая сейчас находится в всеобщее достояние: Чисхолм, Хью, изд. (1911). "Феназин". Британская энциклопедия. 21 (11-е изд.). Издательство Кембриджского университета. С. 364–365.