WikiDer > Белок O-GlcNAcase
| OGA | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
 | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Идентификаторы | |||||||||||||||||||||||||
| Псевдонимы | OGA, MEA5, NCOAT, менингиома, экспрессирующая антиген 5 (гиалуронидаза), MGEA5, O-GlcNAcase | ||||||||||||||||||||||||
| Внешние идентификаторы | OMIM: 604039 MGI: 1932139 ГомолоГен: 8154 Генные карты: OGA | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ортологи | |||||||||||||||||||||||||
| Виды | Человек | Мышь | |||||||||||||||||||||||
| Entrez | |||||||||||||||||||||||||
| Ансамбль | |||||||||||||||||||||||||
| UniProt | |||||||||||||||||||||||||
| RefSeq (мРНК) | |||||||||||||||||||||||||
| RefSeq (белок) | |||||||||||||||||||||||||
| Расположение (UCSC) | Chr 10: 101,78 - 101,82 Мб | Chr 19: 45.75 - 45.78 Мб | |||||||||||||||||||||||
| PubMed поиск | [3] | [4] | |||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Протеин О-GlcNAcase (EC 3.2.1.169, OGA, гликозид гидролаза О-GlcNAcase, О-GlcNAcase, BtGH84, О-GlcNAc гидролаза) представляет собой фермент с участием систематическое название (белок) -3-О-(N-ацетил-D-глюкозаминил) -L-серин / треонин N-ацетилглюкозаминилгидролаза.[5][6][7][8][9] OGA кодируется MGEA5 ген. Этот фермент катализирует удаление О-GlcNAc посттрансляционная модификация В следующих химическая реакция:
- [белок] -3-О-(N-ацетил-β-D-глюкозаминил) -L-серин + H2O ⇌ [белок] -L-серин + N-ацетил-D-глюкозамин
- [белок] -3-О-(N-ацетил-β-D-глюкозаминил) -L-треонин + H2O ⇌ [белок] -L-реонин + N-ацетил-D-глюкозамин
Номенклатура
| Протеин О-GlcNAcase | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 3.2.1.169 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| BRENDA | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Другие названия включают:
- Ядерная цитоплазматическая О-GlcNAcase и ацетилтрансфераза
Изоформы
Есть три изоформы из О-GlcNAcase у людей, которые были идентифицированы. Полная длина О-GlcNAcase (fOGA), самый короткий О-GlcNAcase (sOGA) и вариант OGA (vOGA). Ген OGA человека способен производить две отдельные транскрипции, каждая из которых способна кодировать свою изоформу OGA. Ген длинной изоформы кодирует fOGA, бифункциональный фермент, который в основном находится в цитоплазме. Напротив, vOGA находится в ядре. Однако все три изоформы проявляют гликозид гидролаза Мероприятия.[10]
Гомологи
Протеин О-GlcNAcases принадлежат к семейству гликозидгидролаз 84 по классификации углеводно-активных ферментов.[11] Гомологи существуют у других видов как О-GlcNAcase консервативен у высших эукариотических видов. При попарном выравнивании у людей 55% гомологии с Дрозофилия и 43% с C. elegans. Дрозофилия и C. elegans разделяют 43% гомологии. Среди млекопитающих последовательность OGA еще более консервативна. Гомология мыши и человека составляет 97,8%. Однако OGA не имеет значительной гомологии с другими белками. Однако короткие участки длиной около 200 аминокислот в OGA имеют гомологию с некоторыми белками, такими как гиалуронидаза, предполагаемая ацетилтрансфераза, фактор элонгации трансляции эукариот-1γ и полипептид 11-1.[12]
Реакция
Протеин О-GlcNAцилирование
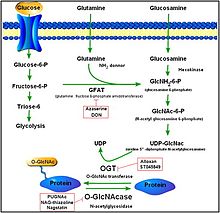
О-GlcNAcylation представляет собой форму гликозилирование, сайт-специфическое ферментативное присоединение сахаридов к белкам и липидам. Эта форма гликозилирования с О-связанный β-N-ацетилглюкозамин или β-О-связанный 2-ацетамидо-2-дезокси-D-гликопираноза (О-GlcNAc). В этой форме один сахар (β-N-ацетилглюкозамин) добавляется к сериновым и треониновым остаткам ядерных или цитоплазматических белков. Два консервативных фермента контролируют гликозилирование серина и треонина: О-GlcNAc трансфераза (OGT) и О-GlcNAcase (OGA). Хотя OGT катализирует добавление О-GlcNAc на серин и треонин, OGA катализирует гидролитическое расщепление О-GlcNAc из белков, модифицированных после перехода.[13]
OGA является членом семьи гексозаминидазы. Однако, в отличие от лизосомальных гексозаминидаз, активность OGA максимальна при нейтральном pH (примерно 7) и локализуется в основном в цитозоле. OGA и OGT синтезируются из двух консервативных генов (OGA кодируется MGEA5) и экспрессируются во всем организме человека с высоким уровнем в головном мозге и поджелудочной железе. Продукция О-GlcNAc и сам процесс играют роль в эмбриональном развитии, мозговой деятельности, выработке гормонов и множестве других видов деятельности.[14][15]
Более 600 белков являются мишенями для О-GlcNAcylation. В то время как функциональные эффекты О-GlcNAc модификация полностью не известна, известно, что ОМодификация -GlcNAc влияет на многие клеточные активности, такие как метаболизм липидов / углеводов и биосинтез гексозамина. Модифицированные белки могут модулировать различные нижестоящие сигнальные пути, влияя на транскрипцию и протеомную активность.[16]
Механизм и торможение
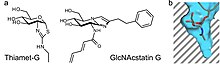
OGA катализирует О-GlcNAc гидролиз через оксазолин промежуточный продукт реакции.[17] Стабильные соединения, которые имитируют промежуточный продукт реакции, могут действовать как селективные ингибиторы ферментов. Тиазолин производные GlcNAc можно использовать в качестве промежуточного продукта реакции. Примером этого является Thiamet-G, как показано справа. Вторая форма торможения может возникать из-за имитации переходного состояния. Семейство ингибиторов GlcNAcstatin использует этот механизм для подавления активности OGA. Для обоих типов ингибиторов OGA можно выбрать отдельно от общих лизосомных гексозаминидаз путем удлинения заместителя C2 в их химической структуре. Это использует преимущества глубокого кармана в активном сайте OGA, который позволяет ему связывать аналоги GlcNAc.[18]
Есть потенциал для регулирования О-GlcNAcase для лечения Болезнь Альцгеймера. Когда тау-белок в головном мозге гиперфосфорилирован, нейрофибриллярные сплетения формы, которые являются патологическим признаком нейродегенеративных заболеваний, таких как болезнь Альцгеймера. Для лечения этого состояния на OGA воздействуют ингибиторы, такие как Thiamet-G, чтобы предотвратить О-GlcNAc не удаляется из тау, что помогает предотвратить фосфорилирование тау.[19]
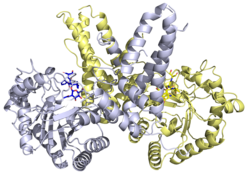
Структура
Рентгеновские структуры доступны для ряда О-GlcNAcase белки. Рентгеновская структура человека О-GlcNAcase в комплексе с Thiamet-G идентифицировал структурную основу ингибирования фермента.[20]
Смотрите также
использованная литература
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000198408 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск ансамбля 89: ENSMUSG00000025220 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Уэллс Л., Гао И., Махони Дж. А., Фосселлер К., Чен С., Розен А., Харт Г. В. (январь 2002 г.). «Динамическое O-гликозилирование ядерных и цитозольных белков: дальнейшая характеристика нуклеоцитоплазматической бета-N-ацетилглюкозаминидазы, O-GlcNAcase». Журнал биологической химии. 277 (3): 1755–61. Дои:10.1074 / jbc.M109656200. PMID 11788610.
- ^ Cetinbaş N, Macauley MS, Stubbs KA, Drapala R, Vocadlo DJ (март 2006 г.). «Идентификация Asp174 и Asp175 как ключевых каталитических остатков человеческой O-GlcNAcase с помощью функционального анализа сайт-направленных мутантов». Биохимия. 45 (11): 3835–44. Дои:10.1021 / bi052370b. PMID 16533067.
- ^ Деннис Р.Дж., Тейлор Э.Дж., Маколи М.С., Стаббс К.А., Тюркенбург, JP, Харт С.Дж. и др. (Апрель 2006 г.). «Структура и механизм бактериальной бета-глюкозаминидазы, обладающей активностью O-GlcNAcase». Структурная и молекулярная биология природы. 13 (4): 365–71. Дои:10.1038 / nsmb1079. PMID 16565725. S2CID 9239755.
- ^ Ким Э.Дж., Кан Д.О., Love DC, Ганновер, JA (июнь 2006 г.). «Ферментативная характеристика изоформ O-GlcNAcase с использованием флуорогенного субстрата GlcNAc». Исследование углеводов. 341 (8): 971–82. Дои:10.1016 / j.carres.2006.03.004. PMID 16584714.
- ^ Донг Д.Л., Харт Г.В. (июль 1994 г.). «Очистка и характеристика O-GlcNAc селективной N-ацетил-бета-D-глюкозаминидазы из цитозоля селезенки крысы». Журнал биологической химии. 269 (30): 19321–30. PMID 8034696.
- ^ Ли Дж., Хуанг К.Л., Чжан Л.В., Линь Л., Ли Чж., Чжан Ф.В., Ван П. (июль 2010 г.). «Изоформы человеческой O-GlcNAcase демонстрируют определенную каталитическую эффективность». Биохимия. Биохимия. 75 (7): 938–43. Дои:10.1134 / S0006297910070175. PMID 20673219. S2CID 2414800.
- ^ Грейг, Ян; Вокадло, Дэвид. «Семейство гликозид гидролаз 84». Казипедия. Получено 28 марта 2017.
- ^ Гао Ю., Уэллс Л., Комер ФИ, Паркер Г.Дж., Харт Г.В. (март 2001 г.). «Динамическое О-гликозилирование ядерных и цитозольных белков: клонирование и характеристика нейтральной цитозольной бета-N-ацетилглюкозаминидазы из человеческого мозга». Журнал биологической химии. 276 (13): 9838–45. Дои:10.1074 / jbc.M010420200. PMID 11148210.
- ^ Лима В.В., Ригсби К.С., Харди Д.М., Уэбб Р.С., Тостес Р.К. (2009). «O-GlcNAcylation: новый посттрансляционный механизм для изменения передачи сигналов в сосудистых клетках при здоровье и болезни: основное внимание уделяется гипертензии». Журнал Американского общества гипертонии. 3 (6): 374–87. Дои:10.1016 / j.jash.2009.09.004. ЧВК 3022480. PMID 20409980.
- ^ Förster S, Welleford AS, Triplett JC, Sultana R, Schmitz B, Butterfield DA (сентябрь 2014 г.). «Повышенные уровни O-GlcNAc коррелируют со снижением уровней O-GlcNAcase в мозге при болезни Альцгеймера». Biochimica et Biophysica Acta (BBA) - Молекулярная основа болезни. 1842 (9): 1333–9. Дои:10.1016 / j.bbadis.2014.05.014. ЧВК 4140188. PMID 24859566.
- ^ Шафи Р., Айер С.П., Эллис Л.Г., О'Доннелл Н., Марек К.В., Чуй Д. и др. (Май 2000 г.). «Ген трансферазы O-GlcNAc находится на Х-хромосоме и необходим для жизнеспособности эмбриональных стволовых клеток и онтогенеза мышей». Труды Национальной академии наук Соединенных Штатов Америки. 97 (11): 5735–9. Дои:10.1073 / pnas.100471497. ЧВК 18502. PMID 10801981.
- ^ Love DC, Ghosh S, Mondoux MA, Fukushige T., Wang P, Wilson MA и др. (Апрель 2010 г.). «Динамический цикл O-GlcNAc на промоторах генов Caenorhabditis elegans, регулирующих долголетие, стресс и иммунитет». Труды Национальной академии наук Соединенных Штатов Америки. 107 (16): 7413–8. Дои:10.1073 / pnas.0911857107. ЧВК 2867743. PMID 20368426.
- ^ Деннис Р.Дж., Тейлор Э.Дж., Маколи М.С., Стаббс К.А., Туркенбург, JP, Харт С.Дж. и др. (Апрель 2006 г.). «Структура и механизм бактериальной бета-глюкозаминидазы, обладающей активностью O-GlcNAcase». Структурная и молекулярная биология природы. 13 (4): 365–71. Дои:10.1038 / nsmb1079. PMID 16565725. S2CID 9239755.
- ^ Алонсо Дж., Шимпл М., Ван Аалтен Д.М. (декабрь 2014 г.). «O-GlcNAcase: беспорядочная гексозаминидаза или ключевой регулятор передачи сигналов O-GlcNAc?». Журнал биологической химии. 289 (50): 34433–9. Дои:10.1074 / jbc.R114.609198. ЧВК 4263850. PMID 25336650.
- ^ Лим С., Хак М.М., Нам Джи, Риу Н., Рим Х., Ким Ю.К. (август 2015 г.). «Мониторинг внутриклеточной агрегации тау-белка, регулируемой ингибиторами OGA / OGT». Международный журнал молекулярных наук. 16 (9): 20212–24. Дои:10.3390 / ijms160920212. ЧВК 4613198. PMID 26343633.
- ^ Рот С., Чан С., Оффен В.А., Хемсворт Г.Р., Виллемс Л.И., Кинг Д.Т. и др. (Июнь 2017). «Структурное и функциональное понимание человеческой O-GlcNAcase». Природа Химическая Биология. 13 (6): 610–612. Дои:10.1038 / nchembio.2358. ЧВК 5438047. PMID 28346405.
дальнейшее чтение
- Накадзима Д., Окадзаки Н., Ямакава Х., Кикуно Р., Охара О., Нагасе Т. (июнь 2002 г.). «Конструирование готовых к экспрессии клонов кДНК для генов KIAA: ручное культивирование 330 клонов кДНК KIAA». ДНК исследования. 9 (3): 99–106. Дои:10.1093 / днарес / 9.3.99. PMID 12168954.
- Исикава К., Нагасе Т., Суяма М., Миядзима Н., Танака А., Котани Х. и др. (Июнь 1998 г.). «Прогнозирование кодирующих последовательностей неидентифицированных генов человека. X. Полные последовательности 100 новых клонов кДНК из мозга, которые могут кодировать большие белки in vitro». ДНК исследования. 5 (3): 169–76. Дои:10.1093 / dnares / 5.3.169. PMID 9734811.
- Гао Й, Уэллс Л., Комер Ф.И., Паркер Г.Дж., Харт Г.В. (март 2001 г.). «Динамическое О-гликозилирование ядерных и цитозольных белков: клонирование и характеристика нейтральной цитозольной бета-N-ацетилглюкозаминидазы из человеческого мозга». Журнал биологической химии. 276 (13): 9838–45. Дои:10.1074 / jbc.M010420200. PMID 11148210.
- Графиня Н, Мальденер Э., Миз Э. (май 2001 г.). «Идентификация ядерного варианта MGEA5, цитоплазматической гиалуронидазы и бета-N-ацетилглюкозаминидазы». Сообщения о биохимических и биофизических исследованиях. 283 (3): 634–40. Дои:10.1006 / bbrc.2001.4815. PMID 11341771.
- Уэллс Л., Гао И., Махони Дж. А., Восселлер К., Чен С., Розен А., Харт Г. В. (январь 2002 г.). «Динамическое O-гликозилирование ядерных и цитозольных белков: дальнейшая характеристика нуклеоцитоплазматической бета-N-ацетилглюкозаминидазы, O-GlcNAcase». Журнал биологической химии. 277 (3): 1755–61. Дои:10.1074 / jbc.M109656200. PMID 11788610.
- Фарук В.С., Богардус С., Прочазка М. (2003). «Анализ MGEA5 на 10q24.1-q24.3, кодирующем бета-O-связанную N-ацетилглюкозаминидазу, в качестве гена-кандидата на сахарный диабет 2 типа у индейцев пима». Молекулярная генетика и метаболизм. 77 (1–2): 189–93. Дои:10.1016 / S1096-7192 (02) 00127-0. PMID 12359146.
- Босолей С.А., Едриховски М., Шварц Д., Элиас Дж. Э., Виллен Дж., Ли Дж. И др. (Август 2004 г.). «Широкомасштабная характеристика ядерных фосфопротеинов клеток HeLa». Труды Национальной академии наук Соединенных Штатов Америки. 101 (33): 12130–5. Дои:10.1073 / pnas.0404720101. ЧВК 514446. PMID 15302935.
- Баллиф Б.А., Виллен Дж., Босолей С.А., Шварц Д., Гиги С.П. (ноябрь 2004 г.). «Фосфопротеомный анализ развивающегося мозга мыши». Молекулярная и клеточная протеомика. 3 (11): 1093–101. Дои:10.1074 / mcp.M400085-MCP200. PMID 15345747.
- Toleman C, Paterson AJ, Whisenhunt TR, Kudlow JE (декабрь 2004 г.). «Характеристика домена гистонацетилтрансферазы (HAT) бифункционального белка с активируемой O-GlcNAcase и активностью HAT». Журнал биологической химии. 279 (51): 53665–73. Дои:10.1074 / jbc.M410406200. PMID 15485860.
- Whisenhunt TR, Yang X, Bowe DB, Paterson AJ, Van Tine BA, Kudlow JE (июнь 2006 г.). «Нарушение ферментного комплекса, регулирующего O-GlcNAcylation, блокирует передачу сигналов и развитие». Гликобиология. 16 (6): 551–63. Дои:10.1093 / glycob / cwj096. PMID 16505006.
- Толеман С., Патерсон А. Дж., Кудлоу Дж. Э. (май 2006 г.). «Расположение и характеристика активного сайта O-GlcNAcase». Biochimica et Biophysica Acta (BBA) - Общие предметы. 1760 (5): 829–39. Дои:10.1016 / j.bbagen.2006.01.017. PMID 16517082.
- Кэмерон Э.А., Мартинес-Мариньяк В.Л., Чан А., Валладарес А., Симмондс Л.В., Вахер Н. и др. (2007). «Полиморфизм MGEA5-14 и диабет 2 типа в Мехико». Американский журнал биологии человека. 19 (4): 593–6. Дои:10.1002 / ajhb.20639. PMID 17546623. S2CID 13712358.
внешние ссылки
- Белок + O-GlcNAcase в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)