WikiDer > Изоформа белка

А изоформа белка, или "вариант белка",[1] входит в набор очень похожих белки которые происходят из одного ген или семейство генов и являются результатом генетических различий.[2] Хотя многие из них выполняют одинаковые или похожие биологические роли, некоторые изоформы обладают уникальными функциями. Набор изоформ белка может быть образован из альтернативные соединения, Переменная промоутер использование или другое посттранскрипционные модификации одного гена; посттрансляционные модификации обычно не рассматриваются. Через Сплайсинг РНК механизмы, мРНК имеет возможность выбирать различные сегменты, кодирующие белок (экзоны) гена или даже разных частей экзонов РНК с образованием различных последовательностей мРНК. Каждая уникальная последовательность производит определенную форму белка.
Открытие изоформ могло бы объяснить несоответствие между небольшим количеством генов кодирующих белки регионов, выявленное проект генома человека и большое разнообразие белков, наблюдаемых в организме: разные белки, кодируемые одним и тем же геном, могут увеличить разнообразие протеом. Изоформы на уровне РНК легко характеризуются: кДНК стенограмма исследований. Многие гены человека обладают подтвержденными альтернативное сращивание изоформы. Было подсчитано, что ~ 100000 выраженных тегов последовательности (EST) могут быть идентифицированы у человека.[1] Изоформы на уровне белка могут проявляться в делеции целых доменов или более коротких петель, обычно расположенных на поверхности белка.[3]
Определение
Один единственный ген способен производить несколько белков, которые различаются как по структуре, так и по составу.[4][5]; этот процесс регулируется альтернативное сращивание мРНК, хотя неясно, в какой степени такой процесс влияет на разнообразие протеома человека, поскольку количество изоформ транскрипта мРНК не обязательно коррелирует с количеством изоформ белка.[6] Специфичность транслируемых изоформ зависит от структуры / функции белка, а также от типа клеток и стадии развития, на которой они продуцируются.[4][5] Определение специфичности становится более сложным, когда белок имеет несколько субъединиц, и каждая субъединица имеет несколько изоформ.
Например, 5 'AMP-активированная протеинкиназа (AMPK), фермент, который выполняет разные функции в клетках человека, состоит из 3 субъединиц:[7]
- α, каталитический домен, имеет две изоформы: α1 и α2, которые кодируются из PRKAA1 и PRKAA2
- β, регуляторный домен, имеет две изоформы: β1 и β2, которые кодируются из ПРКАБ1 и ПРКАБ2
- γ, регуляторный домен, имеет три изоформы: γ1, γ2 и γ3, которые кодируются из ПРКАГ1, ПРКАГ2, и ПРКАГ3
В скелетных мышцах человека предпочтительной формой является α2β2γ1.[7] Но в печени человека наиболее распространенной формой является α1β2γ1.[7]
Механизм
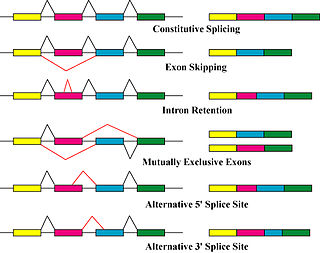
Первичные механизмы, которые продуцируют изоформы белка, - это альтернативный сплайсинг и использование различных промоторов, хотя и модифицируются из-за генетических изменений, таких как мутации и полиморфизмы иногда также считаются отдельными изоформами.[8]
Альтернативная сварка - основная посттранскрипционная модификация процесс, который продуцирует изоформы транскриптов мРНК, и является основным молекулярным механизмом, который может способствовать разнообразию белков.[5] В сплайсосома, большой рибонуклеопротеин, это молекулярная машина внутри ядра, ответственная за расщепление РНК и перевязка, удаляя небелковые кодирующие сегменты (интроны).[9]
Поскольку сращивание - это процесс, который происходит между транскрипция и перевод, его первичные эффекты в основном изучались с помощью геномика техники - например, микрочип анализы и Секвенирование РНК были использованы для идентификации транскриптов с альтернативным сплайсингом и измерения их количества.[8] Обилие транскриптов часто используется как показатель обилия изоформ белка, хотя протеомика эксперименты с использованием гель-электрофореза и масс-спектрометрии продемонстрировали, что корреляция между количеством транскриптов и белков часто низка, и что одна изоформа белка обычно является доминирующей.[10] Одно исследование 2015 года утверждает, что причина этого несоответствия, вероятно, возникает после перевода, хотя механизм по существу неизвестен.[11] Следовательно, хотя альтернативный сплайсинг считается важным связующим звеном между изменчивостью и заболеванием, нет убедительных доказательств того, что он действует в первую очередь за счет продуцирования новых изоформ белка.[10]
Альтернативный сплайсинг обычно описывает строго регулируемый процесс, в котором альтернативные транскрипты намеренно генерируются аппаратом сплайсинга. Однако такие транскрипты также образуются из-за ошибок сплайсинга в процессе, называемом «шумным сплайсингом», и также потенциально транслируются в изоформы белка. Хотя ~ 95% мультиэкзонных генов считаются альтернативным сплайсингом, одно исследование по шумному сплайсингу показало, что большинство различных транскриптов с низким содержанием являются шумом, и предсказывает, что большинство всех альтернативных транскриптов и изоформ белков, присутствующих в клетке не имеют функционального значения.[12]
Другие этапы регуляции транскрипции и посттранскрипции также могут продуцировать различные изоформы белка.[13] Использование переменного промотора происходит, когда транскрипционный аппарат клетки (РНК-полимераза, факторы транскрипции, и другие ферменты) начинают транскрипцию с разных промоторов - области ДНК рядом с геном, который служит начальным сайтом связывания, - в результате получают слегка модифицированные транскрипты и изоформы белка.
Характеристики
Как правило, одна изоформа белка обозначается как каноническая последовательность на основании таких критериев, как ее распространенность и сходство с ортологичный- или функционально аналогичные - последовательности у других видов.[14] Предполагается, что изоформы обладают схожими функциональными свойствами, так как большинство из них имеют сходные последовательности и имеют общие с большинством экзонов канонической последовательности. Однако некоторые изоформы показывают гораздо большее расхождение (например, через транс-сплайсинг), и может иметь несколько экзонов или их отсутствие с канонической последовательностью. Кроме того, они могут иметь разные биологические эффекты - например, в крайнем случае функция одной изоформы может способствовать выживанию клеток, а другая - гибели клеток - или могут иметь сходные основные функции, но различаться по своей субклеточной локализации.[15] Однако исследование 2016 года функционально охарактеризовало все изоформы 1492 генов и определило, что большинство изоформ ведут себя как «функциональные аллоформы». Авторы пришли к выводу, что изоформы ведут себя как отдельные белки, после того, как заметили, что функциональность большинства изоформ не перекрывается.[16] Поскольку исследование проводилось на клетках in vitro, не известно, разделяют ли изоформы в экспрессируемом протеоме человека эти характеристики. Кроме того, поскольку функция каждой изоформы обычно должна определяться отдельно, большинство идентифицированных и предсказанных изоформ все еще имеют неизвестные функции.
Связанная концепция
Гликоформ
А гликоформ представляет собой изоформу белка, которая отличается только количеством или типом прикрепленных гликан. Гликопротеины часто состоят из нескольких различных гликоформ с изменениями в прикрепленных сахарид или олигосахарид. Эти изменения могут быть результатом различий в биосинтез в процессе гликозилирование, или из-за действия гликозидазы или гликозилтрансферазы. Гликоформы могут быть обнаружены посредством детального химического анализа разделенных гликоформ, но более удобно обнаруживать посредством дифференциальной реакции с лектины, как в лектиновая аффинная хроматография и лектин аффинный электрофорез. Типичными примерами гликопротеинов, состоящих из гликоформ, являются: белки крови так как оросомукоид, антитрипсин, и гаптоглобин. Необычная вариация гликоформы наблюдается в молекула адгезии нейрональных клеток, NCAM с участием полисиаловые кислоты, ПСА.
Примеры
- G-актин: несмотря на консервативный характер, он имеет различное количество изоформ (по крайней мере, шесть у млекопитающих).
- Креатинкиназа, наличие которых в крови может быть использовано как помощь в диагностике инфаркт миокарда, существует в 3 изоформах.
- Гиалуронасинтаза, фермент, ответственный за выработку гиалуронана, имеет три изоформы в клетках млекопитающих.
- UDP-глюкуронозилтрансферазасуперсемейство ферментов, ответственных за путь детоксикации многих лекарств, загрязнителей окружающей среды и токсичных эндогенных соединений, имеет 16 известных изоформ, кодируемых в геноме человека.[17]
- G6PDA: нормальное соотношение активных изоформ в клетках любой ткани составляет 1: 1, как и G6PDG. Это как раз нормальное соотношение изоформ при гиперплазии. Только одна из этих изоформ обнаруживается при неоплазии.[18]
МоноаминоксидазаСемейство ферментов, катализирующих окисление моноаминов, существует в двух изоформах: МАО-А и МАО-В.
Смотрите также
Рекомендации
- ^ а б Бретт Д., Поспишил Х., Валькарсель Дж., Райх Дж., Борк П. (январь 2002 г.). «Альтернативный сплайсинг и сложность генома». Природа Генетика. 30 (1): 29–30. Дои:10,1038 / ng803. PMID 11743582.
- ^ Schlüter H, Apweiler R, Holzhütter HG, Jungblut PR (сентябрь 2009 г.). «В поисках пути в протеомике: номенклатура видов белков». Центральный журнал химии. 3: 11. Дои:10.1186 / 1752-153X-3-11. ЧВК 2758878. PMID 19740416.
- ^ Козловский, Л .; Орловски, Дж .; Буйницки, Дж. М. (2012). «Прогнозирование структуры белков с альтернативным сплайсингом». Альтернативный сплайсинг пре-мРНК. п. 582. Дои:10.1002 / 9783527636778.ch54. ISBN 9783527636778.
- ^ а б Андредис А., Гальего М.Э., Надаль-Жинар Б. (1 января 1987 г.). «Создание разнообразия изоформ белка путем альтернативного сплайсинга: механистические и биологические последствия». Ежегодный обзор клеточной биологии. 3 (1): 207–42. Дои:10.1146 / annurev.cb.03.110187.001231. PMID 2891362.
- ^ а б c Брейтбарт Р. Э., Андредис А., Надаль-Жинар Б. (1 января 1987 г.). «Альтернативный сплайсинг: повсеместный механизм для генерации множества изоформ белка из отдельных генов». Ежегодный обзор биохимии. 56 (1): 467–95. Дои:10.1146 / annurev.bi.56.070187.002343. PMID 3304142.
- ^ Лю Ю., Бейер А., Эберсолд Р. (апрель 2016 г.). «О зависимости клеточного уровня белка от количества мРНК». Клетка. 165 (3): 535–50. Дои:10.1016 / j.cell.2016.03.014. PMID 27104977.
- ^ а б c Дасгупта Б., Чипа Р.Р. (март 2016 г.). «Развивающиеся уроки комплексной роли AMPK в нормальной физиологии и раке». Тенденции в фармакологических науках. 37 (3): 192–206. Дои:10.1016 / j.tips.2015.11.007. ЧВК 4764394. PMID 26711141.
- ^ а б Kornblihtt AR, Schor IE, Alló M, Dujardin G, Petrillo E, Muñoz MJ (март 2013 г.). «Альтернативный сплайсинг: поворотный шаг между транскрипцией и трансляцией эукариот». Обзоры природы Молекулярная клеточная биология. 14 (3): 153–65. Дои:10.1038 / nrm3525. PMID 23385723.
- ^ Ли Й, Рио, округ Колумбия (01.01.2015). «Механизмы и регуляция альтернативного сплайсинга пре-мРНК». Ежегодный обзор биохимии. 84 (1): 291–323. Дои:10.1146 / annurev-biochem-060614-034316. ЧВК 4526142. PMID 25784052.
- ^ а б Тресс М.Л., Абаскаль Ф, Валенсия А (февраль 2017 г.). «Альтернативный сплайсинг не может быть ключом к сложности протеома». Тенденции в биохимических науках. 42 (2): 98–110. Дои:10.1016 / j.tibs.2016.08.008. ЧВК 6526280. PMID 27712956.
- ^ Battle A, Хан Z, Ван Ш., Mitrano A, Ford MJ, Pritchard JK, Gilad Y (февраль 2015 г.). «Геномная вариация. Влияние регуляторной вариации от РНК на белок». Наука. 347 (6222): 664–7. Дои:10.1126 / science.1260793. ЧВК 4507520. PMID 25657249.
- ^ Пикрелл Дж. К., Пай А. А., Гилад Ю., Притчард Дж. К. (декабрь 2010 г.). «Шумный сплайсинг стимулирует разнообразие изоформ мРНК в клетках человека». PLoS Genetics. 6 (12): e1001236. Дои:10.1371 / journal.pgen.1001236. ЧВК 3000347. PMID 21151575.
- ^ Смит Л. М., Келлехер Н. Л. (март 2013 г.). «Протеоформа: единый термин, описывающий сложность белка». Методы природы. 10 (3): 186–7. Дои:10.1038 / nmeth.2369. ЧВК 4114032. PMID 23443629.
- ^ Ли HD, Менон Р., Оменн Г.С., Гуань Й. (декабрь 2014 г.). «Пересмотр идентификации канонических изоформ сплайсинга посредством интеграции данных функциональной геномики и протеомики» (PDF). Протеомика. 14 (23–24): 2709–18. Дои:10.1002 / pmic.201400170. ЧВК 4372202. PMID 25265570.
- ^ Сундвалл М., Вейкколайнен В., Курппа К., Салах З., Творогов Д., ван Зоелен Э.Дж., Акилан Р., Элениус К. (декабрь 2010 г.). «Гибель или выживание клеток, которым способствуют альтернативные изоформы ErbB4». Молекулярная биология клетки. 21 (23): 4275–86. Дои:10.1091 / mbc.E10-04-0332. ЧВК 2993754. PMID 20943952.
- ^ Ян X, Куломб-Хантингтон Дж., Кан С., Шейнкман Г. М., Хао Т., Ричардсон А. и др. (Февраль 2016). «Широкое расширение возможностей взаимодействия белков с помощью альтернативного сплайсинга». Клетка. 164 (4): 805–17. Дои:10.1016 / j.cell.2016.01.029. ЧВК 4882190. PMID 26871637.
- ^ Барре Л., Фурнель-Жигле С., Финель М., Неттер П., Магдалу Дж., Оззин М. (март 2007 г.). «Субстратная специфичность человеческой UDP-глюкуронозилтрансферазы UGT2B4 и UGT2B7. Идентификация критического остатка ароматической аминокислоты в положении 33». Журнал FEBS. 274 (5): 1256–64. Дои:10.1111 / j.1742-4658.2007.05670.x. PMID 17263731.
- ^ Патома, основы патологии
внешняя ссылка
| Искать изоформа в Викисловаре, бесплатном словаре. |