WikiDer > Общий синтез хинина
В полный синтез из хинин, встречающийся в природе противомалярийный препарат, разрабатывался более 150 лет. Разработка синтетического хинина считается важной вехой в органическая химия хотя он никогда не производился в промышленных масштабах как заменитель природного хинина. Эта тема также вызывала некоторые споры: Гилберт Аист опубликовал первый стереоселективный полный синтез хинина в 2001 году, тем временем опровергая более раннее утверждение Роберт Бернс Вудворд и Уильям Деринг в 1944 году, утверждая, что последние шаги, необходимые для превращения последнего синтетического промежуточного продукта, хинотоксина, в хинин, не сработали бы, если бы Вудворд и Деринг попытались провести эксперимент. Редакционная статья 2001 г., опубликованная в Новости химии и машиностроения встал на сторону Stork, но в конце концов спор был прекращен раз и навсегда, когда Уильямс и его коллеги успешно повторили предложенное Вудвордом преобразование хинотоксина в хинин в 2007 году.
Химическая структура
Ароматический компонент молекулы хинина представляет собой хинолин с метокси заместитель. В амин компонент имеет хинуклидин скелет и метиленовый мостик между двумя компонентами есть гидроксил группа. Заместитель в положении 3 представляет собой виниловая группа. Молекула оптически активный с пятью стереогенный центров (N1 и C4 составляют единую асимметричную единицу), что делает синтез потенциально трудным, потому что это один из 16 стереоизомеры.
График общего синтеза хинина
- 1817: Первое выделение хинина из хина дерево Пьер Жозеф Пеллетье и Джозеф Кавенту.
- 1853: Луи Пастер получает хинотоксин (или же хиницин в более ранней литературе) кислотным катализатором изомеризация хинина.[1]
- 1856: Уильям Генри Перкин пытается синтезировать хинин путем окисления N-аллилтолуидин основанный на ошибочном представлении о том, что два эквивалента этого соединения с химическая формула C10ЧАС13N плюс три эквивалента кислорода дают один эквивалент C20ЧАС24N2О2 (химическая формула хинина) и один эквивалент воды.[2] Его окисление другими толуидинами ставит его на путь лиловый что в конечном итоге привело к рождению химической промышленности.
- 1907: правильная связь между атомами, установленная Полем Рабе.[3]
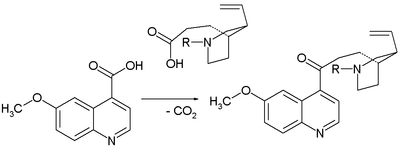
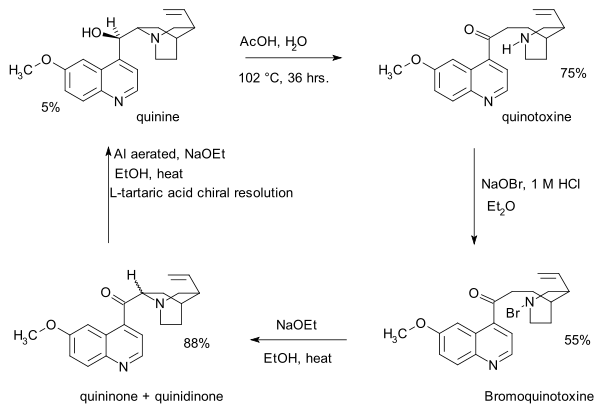
- 1918: Пол Рабе и Карл Киндлер синтезируют хинин из хинотоксина,[4] обращая вспять химию Пастера. Отсутствие экспериментальных деталей в этой публикации стало главной проблемой в полемике между Сторком и Вудвордом почти столетие спустя.
- Первым шагом в этой последовательности является гипобромит натрия дополнение к хинотоксину к N-bromo промежуточное соединение, возможно, со структурой 2. Второй шаг - органическое окисление с этоксид натрия в этиловый спирт. Исходный продукт из-за основных условий хининон взаимодействует с хинидинон через общий энол промежуточный и мутаротация наблюдается. На третьем этапе кетон группа сокращается с алюминий порошок и этоксид натрия в этаноле и хинине могут быть идентифицированы. Хинотоксин - первая молекула-ретранслятор в заявлении Вудворда / Деринга.
- 1939: Рабе и Киндлер повторно исследуют образец, оставшийся от их экспериментов 1918 года, и идентифицируют и выделяют хинин (снова) вместе с диастереомеры хинидин, эпихинин и эпихинидин.[5]
- 1940: Роберт Бернс Вудворд подписывается в качестве консультанта Корпорация Polaroid по запросу Эдвин Х. Лэнд. Хинин представляет интерес для Polaroid своим поляризация света характеристики.
- 1943: Прелог и Проштеник взаимно превращают аллилпиперидин называется гомомерохинен и хинотоксин.[6] Гомомерохинен (вторая ретрансляционная молекула в заявлении Вудворда / Деринга) получается в несколько этапов из биомолекула цинхонин (относится к хинидину, но без метокси группа):
- Ключевым этапом сборки хинотоксина является Клейзеновская конденсация:
- 1944: Боб Вудворд и МЫ. Деринг сообщают о синтезе хинина,[7] начиная с 7-гидроксиизохинолин. Хотя название их одностраничной публикации Полный синтез хинина как ни странно, это не синтез хинина, а синтез предшественника гомомерохинена (рацемического), а затем уже предоставленные Prelog за год до этого исследования хинотоксина (enantiopure после хиральное разрешение), что описано.
- Вудворд и Деринг утверждают, что Рабе в 1918 году уже доказал, что это соединение в конечном итоге даст хинин, но не повторяют работу Рабе. В этом проекте 27-летний доцент Вудворд - теоретик и постдок Деринг (26 лет), слесарь. По словам Уильяма, Боб умел вскипятить воду, но яйцо было проблемой. Как много природных ресурсов хинина было связано в удерживаемых врагом Голландская Ост-Индия, синтетический хинин был многообещающей альтернативой для борьбы с малярией на поле боя, и оба мужчины мгновенно стали героями войны, попавшими в заголовки газет. Нью-Йорк Таймс, Newsweek и Жизнь.
- 1944: Тогда 22-летний Гилберт Сторк пишет Вудворду, спрашивая его, действительно ли он повторял работу Рабе.
- 1945: Вудворд и Деринг публикуют свою вторую длинную статью о хинине.[8] Один из двух рецензентов отклоняет рукопись (слишком много исторического материала, слишком много экспериментальных деталей и плохой литературный стиль с включением таких слов, как обозначенный и уместно), но, тем не менее, публикуется без изменений.
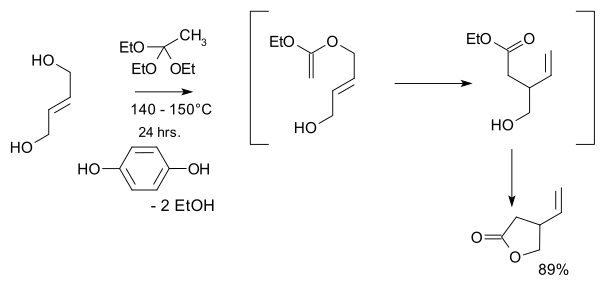
- 1974: Кондо и Мори синтезируют рацемический виниловая гамма-лактоны, ключевой исходный материал в синтезе хинина Stork в 2001 году.[9]
- Исходные материалы транс-2-бутен-1,4-диол и этил ортоацетат и ключевой шаг - это Перестановка Клейзена
- 1988: Ishibashi & Taniguchy преобразовывают указанный лактон в энантиочистые соединения через хиральное разрешение:[10]
- В этом процессе рацемический лактон вступает в реакцию аминолиза с (S)-метилбензиламин при поддержке триэтилалюминий к диастереомерная пара из амиды которые можно разделить колоночная хроматография. В S-энантиомер превращается обратно в S-лактон в две стадии путем гидролиза с гидроксид калия и этиленгликоль с последующим азеотропным замыканием кольца.
- 2001: Гилберт Сторк публикует свой стереоселективный синтез хинина.[11] Он ставит под сомнение обоснованность утверждения Вудворда / Деринга: «основание их характеристики утверждения Рабе как« установленного »неясно». М. Джейкобс, пишет в The Новости химии и машиностроения, столь же критично.[12]
- 2007: Исследователь Джеффри И. Симан в 30-страничном обзоре[13] делает вывод, что полный синтез хинина Вудворда-Деринга-Рабе-Киндлера является действительным достижением. Он отмечает, что Поль Рэйб был чрезвычайно опытным алкалоид химик, что у него была широкая возможность сравнить свой продукт реакции с хинином с аутентичными образцами, и что описанный химический процесс 1918 года был повторен Рабе, хотя и не с самим хинотоксином, а с близкородственными производными.
- 2008: Смит и Уильямс повторно посещают и подтверждают dот хинотоксина к хининовому пути.[14]
- 2018: Нуно Маулиде и его команда сообщают о полном синтезе хинина через C – H активация, в том числе аналоги с улучшенным противомалярийным действием[15]
Общий синтез хинина аиста
Синтез хинина Stork начинается с хирального (S) -4-винилбутиролактон 1. Соединение получают хиральное разрешение и фактически, на последующих этапах все стереогенные центры устанавливаются хиральная индукция: последовательность не содержит асимметричный шаги.
 | 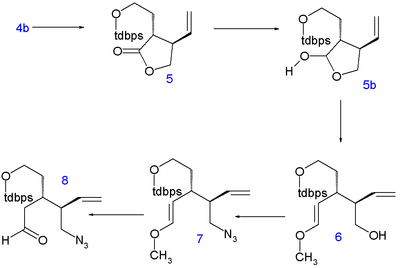 | |
| Синтез хинина аиста | Представляем C8 и азот |
В лактон кольцо открыто с диэтиламин к амид 2 и это гидроксил группа защищенный как терт-бутилдиметил силиловый эфир (TBS) в 3. Атомы C5 и C6 добавляются как терт-бутилдифенилсилил (TBDPS) защищено йодэтанол в нуклеофильное замещение кислого C4 с диизопропиламид лития (LDA) от −78 ° C до 4 с правильной стереохимией. Удаление силильной защитной группы с помощью п-толуолсульфоновая кислота к алкоголь 4b и закрытие кольца азеотропная дистилляция возвращает соединение в лактон 5 (непосредственный алкилирование из 1 встретились с нераскрытыми проблемами).
Затем лактон восстанавливается до лактол 5b с гидрид диизобутилалюминия и его освобожденный альдегид реагирует в Реакция Виттига с метоксиметилентрифенилфосфин (доставляя атом C8) с образованием енольный эфир 6. Гидроксильная группа заменена в Мицунобу реакция по азид группа с дифенилфосфорилазид в 7 и кислотный гидролиз дает азидоальдегид 8.
 |  | |
| Первое закрытие кольца | Закрытие второго кольца |
В метил группа в 6-метокси-4-метилхинолин 9 достаточно кислый за нуклеофильное присоединение его аниона (по реакции с LDA) к альдегидной группе в 8 формировать 10 как смесь эпимеры. Это не имеет значения для стереоконтроля, потому что на следующем этапе спирт окисляется в Окисление Сверна к кетон 11. А Реакция Штаудингера с трифенилфосфин замыкает кольцо между кетоном и азидом до тетрагидропиридин 12. В я добываю группа в этом соединении восстанавливается до амин 13 с борогидрид натрия с правильным стереоспецифичность. Силильная защитная группа удаляется с помощью фтороводород к алкоголю 14 а затем активируется как месил уходящая группа по реакции с мезилхлорид в пиридин что позволяет замкнуть третье кольцо 15. На последней стадии гидроксильная группа C9 была введена окислением гидрид натрия, диметилсульфоксид и кислород с соотношением хинина к эпихинину 14: 1.
Полный синтез формального хинина Вудворда-Деринга
Синтез Вудворда-Деринга 1944 года начинается с 7-гидроксиизохинолина. 3 для хинуклидин скелет, который несколько противоречит интуиции, поскольку происходит переход от стабильной гетероциклической ароматической системы к полностью насыщенному бициклическому кольцу. Это соединение (известное уже с 1895 г.) получают в два этапа.
 | 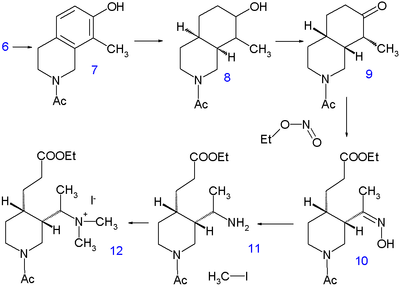 | |
| Синтез хинина Вудворда / Деринга, часть I | Часть II |
Первый этап реакции реакция конденсации из 3-гидроксибензальдегид 1 с (формально) диацеталь из аминоацетальдегид к я добываю 2 а вторая стадия реакции - циклизация в концентрированном серная кислота. Изохинолин 3 затем алкилируется при другой конденсации формальдегид и пиперидин и продукт выделяют в виде натриевой соли 4.
 | |
| Синтез хинина Вудворда / Деринга, часть III |
Гидрирование при 220 ° C в течение 10 часов в метанол с метоксид натрия высвобождает пиперидиновую группу и оставляет метильную группу в 5 с учётом всех атомов углерода и азота. Второй гидрирование происходит с Катализатор Адамса в уксусная кислота к тетрагидроизохинолин 6. Дальнейшее гидрирование не происходит, пока аминогруппа не будет ацилированный с уксусный ангидрид в метанол но к тому времени 7 снова гидрогенизируется Никель Ренея в этиловый спирт при 150 ° C под высоким давлением до декагидроизохинолин 8. Смесь СНГ и транс изомеры затем окисляется хромовая кислота в уксусной кислоте кетон 9. Только цис-изомер кристаллизуется и используется на следующей стадии реакции, при раскрытии цикла с алкилнитрит этилнитрит с этоксид натрия в этиловый спирт к 10 с недавно сформированным эфир карбоновой кислоты группа и оксим группа. Оксимная группа гидрируется до амин 11 с платина в уксусная кислота и алкилирование с йодметан дает четвертичная аммониевая соль 12 и впоследствии бетаин 13 после реакции с оксид серебра.
Хинина виниловая группа затем строится Устранение Хофмана с едкий натр в воде при 140 ° C. Этот процесс сопровождается гидролиз как сложного эфира, так и амидной группы, но выделяется не свободный амин, а мочевина 14 по реакции с цианат калия. На следующем этапе карбоновая кислота группа этерифицированный с этанолом и группой мочевины, замененной на бензоил группа. Последний шаг - это конденсация из 15 с этилхининатом 16, который после кислотной обработки дает рацемический хинотоксин 17. Желаемый энантиомер получают хиральное разрешение с хиральным дибензоиловым эфиром Винная кислота. Превращение этого соединения в хинин основано на химии Рабе-Киндлера, обсуждаемой в таймлайме.
внешняя ссылка
- Общий синтез хинина @ SynArchive.com
- История хинина на Harvard.edu Связь
Рекомендации
- ^ Pasteur, L. Compt. раздирать. 1853, 37, 110.
- ^ Perkin, W.H.J. Chem. Soc. 1896, 69, 596
- ^ Rabe, P .; Ackerman, E .; Schneider, W. Ber. 1907, 40, 3655
- ^ Rabe, P .; Kindler, K. Chem. Бер. 1918, 51, 466
- ^ P. Rabe, K. Kindler, Ber. Dtsch. Chem. Ges. B 1939, 72, 263–264.
- ^ Проштеник, М .; Прелог, В. HelV. Чим. Acta 1943, 26, 1965.
- ^ Полный синтез хинина Р. Б. Вудворд и В. Э. Деринг Варенье. Chem. Soc.; 1944; 66 (5), стр. 849–849; Дои:10.1021 / ja01233a516
- ^ Полный синтез хинина Р. Б. Вудворд и В. Э. Деринг Варенье. Chem. Soc.; 1945; 67 (5), стр. 860–874; Дои:10.1021 / ja01221a051
- ^ СИНТЕЗ γ-ЛАКТОНОВ КОНДЕНСАЦИЕЙ 2-АЛКЕН-1,4-ДИОЛОВ С ОРТОКАРБОКСИЛОВЫМИ ЭФИРАМИ Письма Киеси Кондо и Фумио Мори по химии, том 3 (1974), No7 с.741-742 Дои:10.1246 / кл.1974.741
- ^ Синтез и абсолютная конфигурация ацетального лигнана (+) - фримаролина Фумито Исибаси и Эйдзи Танигучи Бюллетень Химического общества Японии, том 61 (1988), №12 с. 4361-4366 Дои:10.1246 / bcsj.61.4361
- ^ Первый стереоселективный тотальный синтез хинина Гилберт Сторк, Децян Ню, А. Фудзимото, Эмиль Р. Кофт, Джеймс М. Балковек, Джеймс Р. Тата и Грегори Р. Дейк Варенье. Chem. Soc.; 2001; 123 (14), стр. 3239–3242; (Статья) Дои:10.1021 / ja004325r.
- ^ М. Джейкобс, Новости химии и машиностроения 2001, 79 (7 мая), 5.
- ^ Обзор: Полный синтез хинина Вудворда-Деринга / Рабе-Киндлера: установка рекорда Джеффри И. Симан Энгью. Chem. Int. Эд. 2007, 46, 1378–1413 Дои:10.1002 / anie.200601551 PMID 17294412
- ^ Коммуникация Рабе Покойся с миром: подтверждение обращения Рабе – Киндлера d-Хинотоксин в хинин: экспериментальное подтверждение формального полного синтеза хинина Вудворда-Деринга Аарон С. Смит, Роберт М. Уильямс Angewandte Chemie International Edition 2008, 47, 1736–1740 Дои:10.1002 / anie.200705421
- ^ Активация C – H обеспечивает краткий общий синтез хинина и аналогов с повышенной противомалярийной активностью Д. Х. О'Донован и др. Angewandte Chemie International Edition 2018 Дои:10.1002 / anie.201804551