WikiDer > Передача сигнала
Передача сигнала это процесс, посредством которого химический или физический сигнал передается через клетку в виде серия молекулярных событий, Наиболее часто фосфорилирование белков катализируется протеинкиназы, что в конечном итоге приводит к клеточному ответу. Белки, отвечающие за обнаружение стимулов, обычно называют рецепторы, хотя в некоторых случаях используется термин датчик.[1] Изменения, вызываемые связыванием лиганда (или восприятием сигнала) в рецепторе, вызывают биохимический каскад, который представляет собой цепь биохимических событий, известных как сигнальный путь.
Когда сигнальные пути взаимодействуют друг с другом, они образуют сети, которые позволяют координировать клеточные ответы, часто с помощью комбинаторных сигнальных событий.[2] На молекулярном уровне такие ответы включают изменения в транскрипция или же перевод генов и посттрансляционный и конформационные изменения белков, а также изменения их местоположения. Эти молекулярные события являются основными механизмами, контролирующими рост клеток, распространение, метаболизм и многие другие процессы.[3] В многоклеточных организмах пути передачи сигналов регулируют сотовая связь самыми разными способами.
Каждый компонент (или узел) сигнального пути классифицируется в соответствии с ролью, которую он играет по отношению к начальному стимулу. Лиганды называются первые посланники, а рецепторы - преобразователи сигналов, которые затем активируют первичные эффекторы. Такие эффекторы часто связаны с вторые мессенджеры, который может активировать вторичные эффекторы, и так далее. В зависимости от эффективности узлов сигнал может быть усилен (концепция, известная как усиление сигнала), так что одна сигнальная молекула может генерировать ответ, включающий от сотен до миллионов молекул.[4] Как и в случае с другими сигналами, преобразование биологических сигналов характеризуется задержкой, шумом, обратной связью и прямой связью, а также помехами, которые могут варьироваться от незначительных до патологических.[5] С появлением вычислительная биология, то анализ сигнальных путей и сетей стала важным инструментом для понимания клеточных функций и болезнь, включая механизмы перестройки сигналов, лежащие в основе ответов на приобретенную лекарственную устойчивость.[6]
Стимулы
В основе передачи сигнала лежит преобразование определенного стимула в биохимический сигнал. Природа таких стимулов может широко варьироваться, от внеклеточных сигналов, таких как присутствие EGF, на внутриклеточные события, такие как повреждение ДНК в результате репликативный теломер потертость.[7] Традиционно сигналы, которые достигают центральной нервной системы, классифицируются как чувства. Они передаются из нейрон к нейрону в процессе, называемом синаптическая передача. Многие другие механизмы передачи межклеточных сигналов существуют в многоклеточных организмах, например, те, которые управляют эмбриональным развитием.[8]
Лиганды
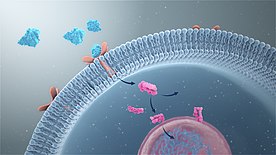
Большинство путей передачи сигнала включают связывание сигнальных молекул, известных как лиганды, с рецепторами, которые запускают события внутри клетки. Связывание сигнальной молекулы с рецептором вызывает изменение конформации рецептора, известное как активация рецептора. Большинство лигандов представляют собой растворимые молекулы из внеклеточной среды, которые связываются с рецепторы клеточной поверхности. К ним относятся факторы роста, цитокины и нейротрансмиттеры. Компоненты внеклеточный матрикс Такие как фибронектин и гиалуронан также может связываться с такими рецепторами (интегрины и CD44, соответственно). Кроме того, некоторые молекулы, такие как стероидные гормоны являются липидорастворимыми и, таким образом, проникают через плазматическую мембрану для достижения ядерные рецепторы.[9] В случае рецепторы стероидных гормонов, их стимуляция приводит к связыванию промоутер регион стероид-чувствительных генов.[10]
Не все классификации сигнальных молекул учитывают молекулярную природу каждого члена класса. Например, одоранты принадлежат к широкому спектру молекулярных классов,[11] как и нейротрансмиттеры, размер которых варьируется от небольших молекул, таких как дофамин[12] к нейропептиды Такие как эндорфины.[13] Более того, некоторые молекулы могут входить в более чем один класс, например адреналин является нейромедиатором, когда секретируется Центральная нервная система и гормон, когда секретируется мозговое вещество надпочечников.
Некоторые рецепторы, такие как HER2 способны лиганд-независимая активация при сверхэкспрессии или мутации. Это приводит к конститутивной активации пути, который может быть отменен или не отменен компенсационными механизмами. В случае HER2, который действует как партнер димеризации других EGFR, конститутивная активация приводит к гиперпролиферации и рак.[14]
Механические силы
Распространенность подвальные мембраны в тканях Eumetazoans означает, что для большинства типов клеток требуется вложение выживать. Это требование привело к развитию сложных путей механотрансдукции, позволяющих клеткам ощущать жесткость субстрата. Такая сигнализация в основном организована в очаговые спайки, регионы, где интегрин-граница актин цитоскелет обнаруживает изменения и передает их вниз по потоку через YAP1.[15] Кальций-зависимый молекулы клеточной адгезии Такие как кадгерины и селектины также может опосредовать механотрансдукцию.[16] Специализированные формы механотрансдукции в нервной системе несут ответственность за: механочувствительность: слушание, трогать, проприоцепция и баланс.[17]
Осмолярность
Сотовый и системный контроль осмотическое давление (разница в осмолярность между цитозоль и внеклеточная среда) имеет решающее значение для гомеостаза. Есть три способа, которыми клетки могут обнаруживать осмотические стимулы: в виде изменений макромолекулярной скученности, ионной силы и изменений свойств плазматической мембраны или цитоскелета (последний является формой механотрансдукции).[18] Эти изменения обнаруживаются белками, известными как осмосенсоры или осморецепторы. У людей лучше всего охарактеризованы осмосенсоры: переходные потенциальные каналы рецепторов присутствует в первичная ресничка клеток человека.[18][19] У дрожжей путь HOG подробно охарактеризован.[20]
Температура
Ощущение температуры в клетках известно как термоцепция и в первую очередь опосредуется: переходные потенциальные каналы рецепторов.[21] Кроме того, клетки животных содержат консервативный механизм предотвращения повреждения клеток высокими температурами, т.е. реакция на тепловой шок. Такой ответ срабатывает, когда высокие температуры вызывают диссоциацию неактивных HSF1 из комплексов с белки теплового шока Hsp40/Hsp70 и Hsp90. С помощью нкРНК hsr1, HSF1 затем тримеризируется, становясь активным и усиливая экспрессию своих генов-мишеней.[22] Многие другие термочувствительные механизмы существуют в обоих прокариоты и эукариоты.[21]
Свет
У млекопитающих свет контролирует чувство достопримечательность и циркадные часы путем активации светочувствительных белков в фоторецепторные клетки в глазс сетчатка. В случае зрения свет обнаруживается родопсин в стержень и конические клетки.[23] В случае с циркадными часами другой фотопигмент, меланопсин, отвечает за обнаружение света в по своей природе светочувствительные ганглиозные клетки сетчатки.[24]
Рецепторы
Рецепторы можно условно разделить на два основных класса: внутриклеточный и внеклеточный рецепторы.
Внеклеточные рецепторы
Внеклеточные рецепторы интегральные трансмембранные белки и составляют большинство рецепторов. Они охватывают плазматическая мембрана клетки, причем одна часть рецептора находится снаружи клетки, а другая - внутри. Передача сигнала происходит в результате связывания лиганда с внешней областью рецептора (лиганд не проходит через мембрану). Связывание лиганд-рецептор вызывает изменение конформация внутренней части рецептора, этот процесс иногда называют «активацией рецептора».[25] Это приводит либо к активации ферментного домена рецептора, либо к обнажению сайта связывания для других внутриклеточных сигнальных белков внутри клетки, что в конечном итоге приводит к распространению сигнала через цитоплазму.
В эукариотический клетки, большинство внутриклеточных белков, активируемых взаимодействием лиганд / рецептор, обладают ферментативной активностью; примеры включают тирозинкиназа и фосфатазы. Часто такие ферменты ковалентно связаны с рецептором. Некоторые из них создают вторые мессенджеры Такие как циклический AMP и IP3последний контролирует высвобождение внутриклеточных запасов кальция в цитоплазму. Другие активированные белки взаимодействуют с адаптерные белки которые способствуют взаимодействию сигнальных белков и координации сигнальных комплексов, необходимых для ответа на определенный стимул. И ферменты, и адаптерные белки реагируют на различные молекулы вторичных мессенджеров.
Многие адаптерные белки и ферменты, активируемые при передаче сигналов, обладают специализированными белковые домены которые связываются со специфическими вторичными молекулами мессенджера. Например, ионы кальция связываются с EF рука домены кальмодулин, позволяя ему связывать и активировать кальмодулин-зависимая киназа. PIP3 и другие фосфоинозитиды делают то же самое с Домены гомологии Плекстрина белков, таких как белок киназы AKT.
G-белковые рецепторы
Рецепторы, связанные с G-белком (GPCR), представляют собой семейство интегральных трансмембранных белков, которые обладают семью трансмембранными доменами и связаны с гетеротримером. G протеин. Это самое большое семейство мембранных белков и рецепторов у млекопитающих, насчитывающее почти 800 членов. С учетом всех видов животных их всего более 5000.[26] GPCR млекопитающих делятся на 5 основных семейств: родопсиноподобный, подобный секрету, метаботропный глутамат, адгезия и завитый/сглаженный, при этом несколько групп GPCR трудно классифицировать из-за низкого сходства последовательностей, например вомероназальные рецепторы.[26] У эукариот существуют и другие классы, такие как Диктиостелиум рецепторы циклического АМФ и грибковые рецепторы феромонов спаривания.[26]
Передача сигнала с помощью GPCR начинается с неактивного G-белка, связанного с рецептором; белок G существует как гетеротример, состоящий из субъединиц Gα, Gβ и Gγ.[27] Как только GPCR распознает лиганд, конформация рецептора изменяется, чтобы активировать G-белок, в результате чего Gα связывает молекулу GTP и диссоциирует от двух других субъединиц G-белка. В результате диссоциации открываются участки субъединиц, которые могут взаимодействовать с другими молекулами.[28] Активированные субъединицы G-белка отделяются от рецептора и инициируют передачу сигналов от многих последующих эффекторных белков, таких как фосфолипазы и ионные каналы, последний позволяет высвобождать вторичные молекулы-мессенджеры.[29] Общая сила усиления сигнала с помощью GPCR определяется временем жизни комплекса лиганд-рецептор и комплекса рецептор-эффекторный белок и временем дезактивации активированного рецептора и эффекторов за счет собственной ферментативной активности; например через фосфорилирование протеинкиназы или b-аррестин-зависимую интернализацию.
Было проведено исследование, в котором точечная мутация был вставлен в ген, кодирующий хемокин рецептор CXCR2; мутировавшие клетки подверглись злокачественная трансформация из-за выражение CXCR2 в активной конформации, несмотря на отсутствие хемокин-связывания. Это означало, что хемокиновые рецепторы могут способствовать развитию рака.[30]
Тирозин, Ser / Thr и гистидин-специфические протеинкиназы
Рецепторные тирозинкиназы (RTK) - это трансмембранные белки с внутриклеточным киназа домен и внеклеточный домен, который связывает лиганды; примеры включают фактор роста рецепторы, такие как рецептор инсулина.[31] Чтобы выполнить преобразование сигнала, RTK должны сформировать димеры в плазматическая мембрана;[32] димер стабилизируется связыванием лигандов с рецептором. Взаимодействие между цитоплазматическими доменами стимулирует автофосфорилирование из тирозин остатки внутри внутриклеточных киназных доменов RTK, вызывающие конформационные изменения. После этого киназные домены рецепторов активируются, инициируя фосфорилирование сигнальные каскады нижележащих цитоплазматических молекул, которые способствуют различным клеточным процессам, таким как дифференциация клеток и метаболизм.[31] Много Ser / Thr и двойная специфичность протеинкиназы важны для передачи сигнала, либо действуя ниже [рецепторных тирозинкиназ], либо как встроенные в мембрану или растворимые в клетках версии сами по себе. В процессе передачи сигнала задействовано около 560 известных протеинкиназы и псевдокиназы, закодированный человеком киноме [33][34]
Как и в случае с GPCR, белки, которые связывают GTP, играют основную роль в передаче сигнала от активированной RTK в клетку. В этом случае G-белки входят в состав Рас, Ро, и семьи Раф, вместе именуемые маленькие G-белки. Они действуют как молекулярные переключатели, обычно прикрепленные к мембранам посредством изопренил группы, связанные с их карбоксильными концами. После активации они связывают белки с определенными субдоменами мембраны, где они участвуют в передаче сигналов. Активированные RTK, в свою очередь, активируют небольшие G-белки, которые активируют факторы обмена гуаниновых нуклеотидов Такие как SOS1. После активации эти факторы обмена могут активировать более мелкие G-белки, тем самым усиливая исходный сигнал рецептора. Мутация некоторых генов RTK, как и в случае с GPCR, может привести к выражение рецепторов, которые существуют в конститутивно активированном состоянии; такие мутировавшие гены могут действовать как онкогены.[35]
Гистидин-специфические протеинкиназы структурно отличаются от других протеинкиназ и обнаруживаются у прокариот, грибов и растений как часть двухкомпонентного механизма передачи сигнала: фосфатная группа из АТФ сначала добавляется к остатку гистидина в киназе, а затем переносится на остаток аспартата на принимающем домене другого белка или самой киназы, таким образом активируя остаток аспартата.[36]
Интегрины

Интегрины производятся самыми разными клетками; они играют роль в прикреплении клеток к другим клеткам и внеклеточный матрикс и в передаче сигналов от компонентов внеклеточного матрикса, таких как фибронектин и коллаген. Связывание лиганда с внеклеточным доменом интегринов изменяет конформацию белка, собирая его в кластеры на клеточной мембране, чтобы инициировать передачу сигнала. Интегрины лишены киназной активности; следовательно, интегрин-опосредованная передача сигнала достигается с помощью различных внутриклеточных протеинкиназ и адапторных молекул, главным координатором является интегрин-связанная киназа.[37] Как показано на рисунке рядом, кооперативная передача сигналов интегрин-RTK определяет время выживания клеток, апоптоз, распространение, и дифференциация.
Существуют важные различия между передачей сигналов интегрином в циркулирующих клетках крови и не циркулирующих клетках, таких как эпителиальные клетки; интегрины циркулирующих клеток обычно неактивны. Например, интегрины клеточной мембраны при циркуляции лейкоциты поддерживаются в неактивном состоянии, чтобы избежать прикрепления эпителиальных клеток; они активируются только в ответ на стимулы, например, полученные в месте воспалительная реакция. Подобным образом интегрины на клеточной мембране циркулирующих тромбоциты обычно остаются неактивными, чтобы избежать тромбоз. Эпителиальные клетки (которые не циркулируют) обычно имеют активные интегрины на своей клеточной мембране, помогая поддерживать их стабильную адгезию с нижележащими стромальными клетками, которые обеспечивают сигналы для поддержания нормального функционирования.[38]
У растений до настоящего времени не выявлено подлинных рецепторов интегрина; тем не менее, несколько интегрин-подобных белков были предложены на основе структурной гомологии с рецепторами многоклеточных животных.[39] Растения содержат связанные с интегрином киназы, которые очень похожи по своей первичной структуре с ILK животных. В экспериментальном модельном заводе Arabidopsis thaliana, один из генов интегрин-связанных киназ, ILK1, было показано, что это критический элемент в иммунном ответе растений на сигнальные молекулы от бактериальных патогенов и чувствительности растений к солевому и осмотическому стрессу.[40] Белок ILK1 взаимодействует с высокоаффинным транспортером калия. HAK5 и с датчиком кальция CML9.[40][41]
Толл-подобные рецепторы
При активации toll-подобные рецепторы (TLR) захватывают адапторные молекулы в цитоплазме клеток для распространения сигнала. Известно, что в передаче сигналов участвуют четыре адапторные молекулы: Myd88, ТИРАП, TRIF, и Трамвай.[42][43][44] Эти адаптеры активируют другие внутриклеточные молекулы, такие как ИРАК1, ИРАК4, TBK1, и IKKi усиливают сигнал, что в конечном итоге приводит к индукция или подавление генов, вызывающих определенные реакции. Тысячи генов активируются с помощью передачи сигналов TLR, что означает, что этот метод представляет собой важный шлюз для модуляции генов.
Ионные каналы, управляемые лигандами
Ионный канал, управляемый лигандом, после связывания с лигандом изменяет конформацию, открывая канал в клеточной мембране, через который могут проходить ионы, передающие сигналы. Пример этого механизма находится в принимающей клетке нервной системы. синапс. Приток ионов, который происходит в ответ на открытие этих каналов, вызывает потенциалы действия, такие как те, которые перемещаются по нервам, деполяризуя мембрану постсинаптических клеток, что приводит к открытию потенциалзависимых ионных каналов.
Примером иона, попадающего в клетку во время открытия лиганд-зависимого ионного канала, является Ca2+; он действует как второй посланник, инициирующий каскады передачи сигналов и изменяющий физиологию отвечающей клетки. Это приводит к усилению синаптического ответа между синаптическими клетками за счет ремоделирования дендритные шипы участвует в синапсе.
Внутриклеточные рецепторы
Внутриклеточные рецепторы, такие как ядерные рецепторы и цитоплазматические рецепторы, представляют собой растворимые белки, локализованные в соответствующих областях. Типичные лиганды ядерных рецепторов - это неполярные гормоны, такие как стероидный препарат гормоны тестостерон и прогестерон и производные витаминов A и D. Чтобы инициировать передачу сигнала, лиганд должен пройти через плазматическую мембрану путем пассивной диффузии. Связываясь с рецептором, лиганды проходят через ядерная мембрана в ядро, изменяя экспрессию генов.
Активированные ядерные рецепторы прикрепляются к ДНК на рецептор-специфических гормонально-чувствительный элемент (HRE) последовательности, расположенные в промоутер область генов, активируемых комплексом гормон-рецептор. Из-за того, что они активируют транскрипцию генов, их также называют индукторами экспрессия гена. Все гормоны, которые действуют путем регуляции экспрессии генов, имеют два следствия в механизме своего действия; их эффекты возникают после характерно длительного периода времени, и их эффекты сохраняются в течение еще одного длительного периода времени, даже после того, как их концентрация была снижена до нуля, из-за относительно медленного оборота большинства ферментов и белков, которые либо дезактивируют, либо прекращают действие лиганда. связывание с рецептором.
Нуклеиновые рецепторы имеют ДНК-связывающие домены, содержащие цинковые пальцы и лиганд-связывающий домен; цинковые пальцы стабилизируют связывание ДНК, удерживая ее фосфатный остов. Последовательности ДНК, соответствующие рецептору, обычно представляют собой гексамерные повторы любого типа; последовательности похожи, но их ориентация и расстояние различают их. Лиганд-связывающий домен дополнительно отвечает за димеризация нуклеиновых рецепторов до связывания и обеспечения структур для трансактивация используется для связи с переводческим аппаратом.
Стероидные рецепторы представляют собой подкласс ядерных рецепторов, расположенных в основном в цитозоле. В отсутствие стероидов они связываются в апорецепторный комплекс, содержащий сопровождающий или же белки теплового шока (СЧЛ). HSP необходимы для активации рецептора, помогая белку складывать таким образом, чтобы сигнальная последовательность возможность его прохождения в ядро доступна. С другой стороны, стероидные рецепторы могут подавлять экспрессию генов, когда их домен трансактивации скрыт. Рецепторная активность может быть усилена фосфорилированием серин остатки на их N-конце в результате другого пути передачи сигнала, процесса, называемого перекрестные помехи.
Рецепторы ретиноевой кислоты являются еще одним подмножеством ядерных рецепторов. Они могут быть активированы эндокринно-синтезируемым лигандом, который проник в клетку путем диффузии, лиганд, синтезируемый из предшественник подобно ретинол доставляется в клетку через кровоток или полностью внутриклеточно синтезированный лиганд, такой как простагландин. Эти рецепторы расположены в ядре и не сопровождаются HSP. Они репрессируют свой ген, связываясь со своей конкретной последовательностью ДНК, когда с ними не связывается лиганд, и наоборот.
Некоторые внутриклеточные рецепторы иммунной системы являются цитоплазматическими рецепторами; недавно идентифицированный NOD-подобные рецепторы (NLR) находятся в цитоплазме некоторых эукариотический клетки и взаимодействуют с лигандами с помощью богатый лейцином повтор (LRR) мотив, похожий на TLR. Некоторые из этих молекул, например NOD2 взаимодействовать с Киназа RIP2 что активирует NF-κB сигнализация, а другим нравится NALP3 взаимодействуют с воспалительным каспасы и инициировать обработку определенных цитокины подобно интерлейкин-1β.[45][46]
Вторые посланники
Первыми посланниками являются сигнальные молекулы (гормоны, нейротрансмиттеры и паракринные / аутокринные агенты), которые достигают клетки из внеклеточной жидкости и связываются со своими специфическими рецепторами. Вторичные посланники - это вещества, которые проникают в цитоплазму и действуют внутри клетки, вызывая ответную реакцию. По сути, вторичные мессенджеры служат в качестве химических ретрансляторов от плазматической мембраны к цитоплазме, тем самым осуществляя внутриклеточную передачу сигнала.
Кальций
Высвобождение ионов кальция из эндоплазматический ретикулум в цитозоль приводит к его связыванию с сигнальными белками, которые затем активируются; затем он изолируется в гладкая эндоплазматическая сеть[47] и митохондрии. Два комбинированных белка рецептор / ионный канал контролируют транспорт кальция: InsP3-рецептор который транспортирует кальций при взаимодействии с инозитолтрифосфат на его цитозольной стороне; и рецептор рианодина названный в честь алкалоид рианодин, аналогично InsP3 рецептор, но имеющий механизм обратной связи который высвобождает больше кальция при связывании с ним. Природа кальция в цитозоле означает, что он активен в течение очень короткого времени, что означает, что его концентрация в свободном состоянии очень низкая и в основном связана с молекулами органелл, такими как кальретикулин когда неактивен.
Кальций используется во многих процессах, включая сокращение мышц, высвобождение нейромедиаторов из нервных окончаний и миграция клеток. Три основных пути, которые приводят к его активации, - это пути GPCR, пути RTK и закрытые ионные каналы; он регулирует белки либо напрямую, либо путем связывания с ферментом.
Липидные посланники
Липофильные вторичные молекулы-мессенджеры получают из липидов, находящихся в клеточных мембранах; Ферменты, стимулируемые активированными рецепторами, активируют липиды, изменяя их. Примеры включают диацилглицерин и керамид, первый необходим для активации протеинкиназа C.
Оксид азота
Оксид азота (NO) действует как вторичный мессенджер, потому что он свободный радикал которые могут диффундировать через плазматическую мембрану и влиять на соседние клетки. Он синтезируется из аргинин и кислород БЕЗ синтазы и работает через активацию растворимая гуанилилциклаза, который при активации создает еще один второй мессенджер, cGMP. NO может также действовать посредством ковалентной модификации белков или их металлических кофакторов; некоторые имеют окислительно-восстановительный механизм и обратимы. Он токсичен в высоких концентрациях и вызывает повреждения во время Инсульт, но является причиной многих других функций, таких как расслабление кровеносных сосудов, апоптоз, и половой член эрекция.
Редокс-сигнализация
Помимо оксида азота, другие электронно-активированные частицы также являются агентами, передающими сигнал в процессе, называемом редокс-сигнализация. Примеры включают супероксид, пероксид водорода, монооксид углерода, и сероводород. Редокс-сигнализация также включает активную модуляцию электронных потоков в полупроводниковый биологические макромолекулы.[48]
Сотовые ответы
Активации генов[49] и нарушения обмена веществ[50] являются примерами клеточных ответов на внеклеточную стимуляцию, которые требуют передачи сигнала. Активация генов приводит к дальнейшим клеточным эффектам, поскольку продукты отвечающих генов включают в себя инициаторы активации; Факторы транскрипции, образующиеся в результате каскада передачи сигналов, могут активировать еще больше генов. Следовательно, первоначальный стимул может вызвать экспрессию большого количества генов, что приведет к физиологическим событиям, таким как повышенное поглощение глюкозы из кровотока.[50] и миграция нейтрофилы к участкам заражения. Набор генов и порядок их активации на определенные стимулы называется генетическая программа.[51]
Клеткам млекопитающих требуется стимуляция для деления и выживания клеток; в отсутствие фактор роста, апоптоз следует. Такие требования для внеклеточной стимуляции необходимы для управления поведением клеток в одноклеточных и многоклеточных организмах; Пути передачи сигналов считаются настолько важными для биологических процессов, что большое количество заболеваний объясняется их нарушением. Три основных сигнала определяют рост клеток:
- Стимулирующий (факторы роста)
- Зависящий от транскрипции ответ
Например, стероиды действуют непосредственно как фактор транскрипции (дает медленный ответ, поскольку фактор транскрипции должен связывать ДНК, которую необходимо транскрибировать. Произведенная мРНК должна транслироваться, а продуцируемый белок / пептид может подвергаться посттрансляционная модификация (PTM)) - Независимый от транскрипции ответ
Например, фактор роста эпидермиса (EGF) связывает рецептор эпидермального фактора роста (EGFR), который вызывает димеризацию и аутофосфорилирование EGFR, что, в свою очередь, активирует внутриклеточный сигнальный путь.[52]
- Зависящий от транскрипции ответ
- Тормозное (межклеточный контакт)
- Пермиссивный (межклеточные взаимодействия)
Комбинация этих сигналов интегрируется в измененный цитоплазматический аппарат, что приводит к изменению поведения клеток.
Основные пути
Ниже приведены некоторые основные пути передачи сигналов, демонстрирующие, как лиганды, связывающиеся с их рецепторами, могут влиять на вторичных мессенджеров и в конечном итоге приводить к измененным клеточным ответам.
- Путь MAPK / ERK: Путь, который связывает внутриклеточные ответы на связывание факторы роста к клетка поверхность рецепторы. Этот путь очень сложен и включает в себя множество белок составные части.[53] Во многих типах клеток активация этого пути способствует деление клеток, и многие формы рак связаны с аберрациями в нем.[54]
- цАМФ-зависимый путь: У людей цАМФ работает путем активации протеинкиназы A (PKA, цАМФ-зависимая протеинкиназа) (см. рисунок), поэтому дальнейшие эффекты зависят в основном от цАМФ-зависимая протеинкиназа, которые различаются в зависимости от типа ячейки.
- IP3/ DAG путь: ПЛК расщепляет фосфолипид фосфатидилинозитол-4,5-бисфосфат (PIP2), что дает диацилглицерин (DAG) и инозитол 1,4,5-трифосфат (IP3). DAG остается связанным с мембраной, а IP3 выделяется в виде растворимой структуры в цитозоль. IP3 затем диффундирует через цитозоль, чтобы связываться с IP3 рецепторы, частности кальциевые каналы в эндоплазматический ретикулум (ER). Эти каналы предназначены для кальций и позволить проходить только кальцию. Это вызывает повышение цитозольной концентрации кальция, вызывая каскад внутриклеточных изменений и активности.[55] Кроме того, кальций и DAG вместе работают, чтобы активировать PKC, который затем фосфорилирует другие молекулы, что приводит к изменению клеточной активности. Конечные эффекты включают вкусовые ощущения, маниакальную депрессию, распространение опухоли и т. Д.[55]
История

Самые ранние представления о передаче сигналов восходят к 1855 году, когда Клод Бернард предположил, что железы без протоков, такие как селезенка, то щитовидная железа и надпочечники, были ответственны за высвобождение «внутренних секретов» с физиологическими эффектами.[56] «Выделения» Бернара позже были названы «гормоны" к Эрнест Старлинг в 1905 г.[57] Вместе с Уильям Бейлисс, Старлинг обнаружил секретин в 1902 г.[56] Хотя многие другие гормоны, в первую очередь инсулин, были открыты в последующие годы, механизмы оставались в значительной степени неизвестными.
Открытие фактор роста нервов к Рита Леви-Монтальчини в 1954 г. и фактор роста эпидермиса к Стэнли Коэн в 1962 г., привел к более детальному пониманию молекулярных основ клеточной передачи сигналов, в частности факторы роста.[58] Их работа вместе с Эрл Уилбур Сазерлендоткрытие циклический AMP в 1956 г. подтолкнул к пересмотру определения эндокринная сигнализация включить только сигнал от желез, а термины автокринный и паракринный начал использоваться.[59] Сазерленд был награжден 1971 г. Нобелевская премия по физиологии и медицине, а Леви-Монтальчини и Коэн поделились им в 1986 году.
В 1970 г. Мартин Родбелл изучили влияние глюкагон на рецептор мембраны клетки печени крысы. Он отметил, что гуанозинтрифосфат диссоциировал глюкагон от этого рецептора и стимулировал G-белок, что сильно повлияло на метаболизм клетки. Таким образом, он пришел к выводу, что G-белок является преобразователем, который принимает молекулы глюкагона и воздействует на клетку.[60] Для этого он разделил 1994 год. Нобелевская премия по физиологии и медицине с Альфред Г. Гилман. Таким образом, характеристика RTK и GPCR привела к формулировке концепции «передачи сигнала», слова, впервые использованного в 1972 году.[61] В некоторых ранних статьях использовались термины передача сигнала и сенсорная трансдукция.[62][63] В 2007 г. было опубликовано 48 377 научных работ, в том числе 11 211 обзорные статьи- были опубликованы по данной теме. Этот термин впервые появился в названии статьи в 1979 году.[64][65] Широкое распространение этого термина восходит к обзорной статье Родбелла 1980 года:[60][66] Исследовательские работы, посвященные передаче сигналов, впервые появились в большом количестве в конце 1980-х - начале 1990-х годов.[46]
Передача сигнала в Иммунология
Цель этого раздела - кратко описать некоторые разработки в иммунологии 1960-х и 1970-х годов, имеющие отношение к начальным этапам трансмембранной передачи сигнала, и их влияние на наше понимание иммунологии и, в конечном итоге, других областей клеточной биологии.
Соответствующие события начинаются с последовательности миеломный белок легкие цепи, которые в изобилии обнаруживаются в моче людей с множественная миелома. Биохимические эксперименты показали, что эти так называемые белки Бенс-Джонса состоят из двух дискретных доменов - одного, который варьируется от одной молекулы к другой (V-домен), а другой - нет (Fc-домен или Фрагмент кристаллизующейся области) [67]. Анализ множественных последовательностей V-области, проведенный Wu и Kabat [68] идентифицировали участки в V-области, которые были гипервариабельными и которые, как они предположили, объединялись в свернутый белок с образованием сайта распознавания антигена. Таким образом, за относительно короткое время была разработана правдоподобная модель для молекулярной основы иммунологической специфичности и опосредования биологической функции через домен Fc. Вскоре последовала кристаллизация молекулы IgG. [69] ) подтверждение выводов, основанных на секвенировании, и обеспечение понимания иммунологической специфичности на самом высоком уровне разрешения.
Биологическое значение этих достижений было заключено в теории клональный отбор [70] который утверждает, что a В клетка имеет на своей поверхности рецепторы иммуноглобулина, чей антигенсвязывающий сайт идентичен сайту связывания антител, которые секретируются клеткой при встрече с антигеном, и, более конкретно, конкретный клон В-клетки секретирует антитела с идентичными последовательностями. Последняя часть истории, Модель жидкой мозаики плазматической мембраны предоставили все ингредиенты для новой модели для инициации передачи сигнала; а именно димеризация рецепторов.
Первые намеки на это были получены Becker et al. [71] кто продемонстрировал, насколько человеческий базофилы - для каких двухвалентных Иммуноглобулин E (IgE) функционирует как поверхностный рецептор - дегранулят, зависит от концентрации анти-IgE-антител, которым они подвергаются, и приводит к перераспределению поверхностных молекул, которое отсутствует при моновалентном лиганд используется. Последнее наблюдение согласуется с более ранними выводами Fanger et al. [72]. Эти наблюдения связали биологический ответ на события и структурные детали молекул на поверхности клетки. Вскоре появилось большинство доказательств того, что димеризация рецепторов инициирует ответы (см. [73]) в различных типах клеток, включая B-клетки.
Такие наблюдения привели к ряду теоретических (математических) разработок. Первой из них была простая модель, предложенная Беллом. [74] что разрешило очевидный парадокс: кластеризация формирует стабильные сети; т.е. связывание по существу необратимо, тогда как аффинность антител, секретируемых В-клетками, увеличивается по мере развития иммунного ответа. Теория динамики кластеризации клеточной поверхности на мембранах лимфоцитов была разработана Делиси и Перельсон [75] которые обнаружили распределение кластеров по размерам как функцию времени и его зависимость от аффинности и валентности лиганда. Последующие теории базофилов и тучных клеток были разработаны Гольдштейном и Соботкой и их сотрудниками. [76] [77], все направлено на анализ дозовых характеристик иммунных клеток и их биологических коррелятов. [78]. Для недавнего обзора кластеризации в иммунологических системах см.[79].
Связывание лиганда с рецепторами клеточной поверхности также имеет решающее значение для подвижности - феномена, который лучше всего понимается у одноклеточных организмов. Примером может служить обнаружение градиентов концентрации бактерий и реакция на них. [80]-– классическая математическая теория, появляющаяся в [81]. Недавний аккаунт можно найти в [82]
Смотрите также
- Адаптерный белок
- Каркасный белок
- Биосемиотика
- Передача сигналов клетки
- Сеть регулирования генов
- Гормональный импринтинг
- Метаболический путь
- Белково-белковое взаимодействие
- Двухкомпонентная система регулирования
Рекомендации
- ^ Брэдшоу Р.А., Деннис Е.А., ред. (2010). Справочник по сотовой сигнализации (2-е изд.). Амстердам, Нидерланды: Academic Press. ISBN 9780123741455.
- ^ Папин Дж. А., Хантер Т., Палссон Б. О., Субраманиам С. (февраль 2005 г.). «Реконструкция сотовых сетей сигнализации и анализ их свойств». Обзоры природы. Молекулярная клеточная биология. 6 (2): 99–111. Дои:10.1038 / nrm1570. PMID 15654321.
- ^ Краусс Г (2008). Биохимия передачи и регуляции сигналов. Wiley-VCH. п. 15. ISBN 978-3527313976.
- ^ Рис Дж, Кэмпбелл Н. (2002). Биология. Сан-Франциско: Бенджамин Каммингс. ISBN 978-0-8053-6624-2.
- ^ Колч В., Халаш М., Грановская М., Холоденко Б.Н. (сентябрь 2015 г.). «Динамический контроль сетей передачи сигнала в раковых клетках». Обзоры природы. Рак. 15 (9): 515–27. Дои:10.1038 / nrc3983. PMID 26289315.
- ^ Bago R, Sommer E, Castel P, Crafter C, Bailey FP, Shpiro N, Baselga J, Cross D, Eyers PA, Alessi DR (2016) Путь hVps34-SGK3 облегчает устойчивое ингибирование PI3K / Akt, стимулируя mTORC1 и рост опухоли. EMBO Journal 35: 1902-22
- ^ Smogorzewska A, de Lange T (август 2002 г.). «Различные пути передачи сигналов о повреждении теломер в клетках человека и мыши». Журнал EMBO. 21 (16): 4338–48. Дои:10.1093 / emboj / cdf433. ЧВК 126171. PMID 12169636.
- ^ Лоуренс П.А., Левин М. (апрель 2006 г.). «Мозаика и регулирующая разработка: две стороны одной монеты». Текущая биология. 16 (7): R236-9. Дои:10.1016 / j.cub.2006.03.016. PMID 16581495.
- ^ Беато М., Чавес С., Ферма М. (апрель 1996 г.). «Регуляция транскрипции стероидными гормонами». Стероиды. 61 (4): 240–51. Дои:10.1016 / 0039-128X (96) 00030-X. PMID 8733009.
- ^ Hammes SR (март 2003 г.). «Дальнейшее переосмысление стероид-опосредованной передачи сигналов». Труды Национальной академии наук Соединенных Штатов Америки. 100 (5): 2168–70. Bibcode:2003ПНАС..100.2168Н. Дои:10.1073 / пнас.0530224100. ЧВК 151311. PMID 12606724.
- ^ Роннетт Г.В., Moon C (2002). «G-белки и передача обонятельного сигнала». Ежегодный обзор физиологии. 64 (1): 189–222. Дои:10.1146 / annurev.physiol.64.082701.102219. PMID 11826268.
- ^ Missale C, Nash SR, Robinson SW, Jaber M, Caron MG (январь 1998 г.). «Дофаминовые рецепторы: от структуры к функции». Физиологические обзоры. 78 (1): 189–225. Дои:10.1152 / Physrev.1998.78.1.189. PMID 9457173.
- ^ Гольдштейн А. (сентябрь 1976 г.). «Опиоидные пептиды эндорфины в гипофизе и головном мозге». Наука. 193 (4258): 1081–6. Bibcode:1976Научный ... 193.1081Г. Дои:10.1126 / science.959823. PMID 959823.
- ^ Koboldt DC, Fulton RS, McLellan MD, Schmidt H, Kalicki-Veizer J, McMichael JF, et al. (Сеть атласа генома рака) (октябрь 2012 г.). «Комплексные молекулярные портреты опухолей груди человека». Природа. 490 (7418): 61–70. Bibcode:2012Натура 490 ... 61 т. Дои:10.1038 / природа11412. ЧВК 3465532. PMID 23000897.
- ^ Dupont S, Morsut L, Aragona M, Enzo E, Giulitti S, Cordenonsi M и др. (Июнь 2011 г.). «Роль ЯП / ТАЗ в механотрансдукции». Природа. 474 (7350): 179–83. Дои:10.1038 / природа10137. PMID 21654799.
- ^ Ingber DE (май 2006 г.). «Клеточная механотрансдукция: снова собираем все вместе». Журнал FASEB. 20 (7): 811–27. Дои:10.1096 / fj.05-5424rev. PMID 16675838.
- ^ Кунг С. (август 2005 г.). «Возможный объединяющий принцип механочувствительности». Природа. 436 (7051): 647–54. Bibcode:2005Натура 436..647K. Дои:10.1038 / природа03896. PMID 16079835.
- ^ а б Педерсен С.Ф., Капус А., Хоффманн Е.К. (сентябрь 2011 г.). «Осмосенсорные механизмы в регуляции клеточного и системного объема». Журнал Американского общества нефрологов. 22 (9): 1587–97. Дои:10.1681 / ASN.2010121284. PMID 21852585.
- ^ Verbalis JG (декабрь 2007 г.). "Как мозг ощущает осмоляльность?". Журнал Американского общества нефрологов. 18 (12): 3056–9. Дои:10.1681 / ASN.2007070825. PMID 18003769.
- ^ Хохманн С. (июнь 2002 г.). «Сигнализация осмотического стресса и осмоадаптация дрожжей». Обзоры микробиологии и молекулярной биологии. 66 (2): 300–72. Дои:10.1128 / MMBR.66.2.300-372.2002. ЧВК 120784. PMID 12040128.
- ^ а б Сенгупта П., Гаррити П. (апрель 2013 г.). «Измерение температуры». Текущая биология. 23 (8): R304-7. Дои:10.1016 / j.cub.2013.03.009. ЧВК 3685181. PMID 23618661.
- ^ Шамовский И., Иванников М., Кандел Е.С., Гершон Д., Нудлер Э. (март 2006 г.). «РНК-опосредованный ответ на тепловой шок в клетках млекопитающих». Природа. 440 (7083): 556–60. Bibcode:2006Натура.440..556С. Дои:10.1038 / природа04518. PMID 16554823.
- ^ Бернс М.Э., Аршавский В.Ю. (ноябрь 2005 г.). «Помимо счета фотонов: испытания и тенденции в визуальной трансдукции позвоночных». Нейрон. 48 (3): 387–401. Дои:10.1016 / j.neuron.2005.10.014. PMID 16269358.
- ^ Берсон Д.М. (август 2007 г.). «Фототрансдукция в фоторецепторах ганглиозных клеток». Архив Пфлюгерс. 454 (5): 849–55. Дои:10.1007 / s00424-007-0242-2. PMID 17351786.
- ^ Молекулярная модель активации рецепторов
- ^ а б c Fredriksson R, Schiöth HB (май 2005 г.). «Репертуар рецепторов, связанных с G-белком, в полностью секвенированных геномах». Молекулярная фармакология. 67 (5): 1414–25. Дои:10.1124 / моль.104.009001. PMID 15687224.
- ^ Цинь К., Донг С., Ву Г., Ламберт Н.А. (август 2011 г.). «Предварительная сборка в неактивном состоянии рецепторов, связанных с G (q), и гетеротримеров G (q)». Природа Химическая Биология. 7 (10): 740–7. Дои:10.1038 / nchembio.642. ЧВК 3177959. PMID 21873996.
- ^ Берг Дж. М., Тимочко Дж. Л., Страйер Л., Кларк Н. Д. (2002). Биохимия. Сан-Франциско: W.H. Фримен. ISBN 978-0-7167-4954-7.
- ^ Ян В., Ся С. (2006). «Механизмы регуляции и функции G-протеин-связанных рецепторных киназ». Мир Дж Гастроэнтерол. 12 (48): 7753–7. Дои:10.3748 / wjg.v12.i48.7753. PMID 17203515.
- ^ Burger M, Burger JA, Hoch RC, Oades Z, Takamori H, Schraufstatter IU (август 1999). «Точечная мутация, вызывающая конститутивную передачу сигналов CXCR2, приводит к трансформирующей активности, аналогичной активности рецептора, сопряженного с герпесвирусом G саркомы Капоши». Журнал иммунологии. 163 (4): 2017–22. PMID 10438939.
- ^ а б Ли Э., Христова К. (май 2006 г.). «Роль трансмембранных доменов рецепторной тирозинкиназы в передаче сигналов в клетках и патологиях человека». Биохимия. 45 (20): 6241–51. Дои:10.1021 / bi060609y. ЧВК 4301406. PMID 16700535.
- ^ Шлессингер Дж. (Ноябрь 1988 г.). «Передача сигнала путем олигомеризации аллостерических рецепторов». Тенденции в биохимических науках. 13 (11): 443–7. Дои:10.1016/0968-0004(88)90219-8. PMID 3075366.
- ^ Мэннинг Дж., Уайт Д. Б., Мартинес Р., Хантер Т., Сударсанам С. (декабрь 2002 г.). «Комплемент протеинкиназы генома человека». Наука. 298 (5600): 1912–34. Bibcode:2002Наука ... 298.1912М. Дои:10.1126 / science.1075762. PMID 12471243.
- ^ Reiterer V, Eyers PA, Farhan H (сентябрь 2014 г.). «День мертвых: псевдокиназы и псевдофосфатазы в физиологии и болезнях». Тенденции в клеточной биологии. 24 (9): 489–505. Дои:10.1016 / j.tcb.2014.03.008. PMID 24818526.
- ^ Роскоски Р. (июнь 2004 г.). «Протеин-тирозинкиназы рецептора ErbB / HER и рак». Сообщения о биохимических и биофизических исследованиях. 319 (1): 1–11. Дои:10.1016 / j.bbrc.2004.04.150. PMID 15158434.
- ^ Воланин PM, Томасон PA, Stock JB (сентябрь 2002 г.). «Гистидиновые протеинкиназы: ключевые преобразователи сигналов за пределами животного мира». Геномная биология. 3 (10): ОБЗОРЫ 3013. Дои:10.1186 / gb-2002-3-10-reviews3013. ЧВК 244915. PMID 12372152.
- ^ а б Hehlgans S, Haase M, Cordes N (январь 2007 г.). «Передача сигналов через интегрины: последствия для выживания клеток и противоопухолевых стратегий». Biochimica et Biophysica Acta (BBA) - Обзоры на рак. 1775 (1): 163–80. Дои:10.1016 / j.bbcan.2006.09.001. PMID 17084981.
- ^ Gilcrease MZ (март 2007 г.). «Передача сигналов интегрина в эпителиальных клетках». Письма о раке. 247 (1): 1–25. Дои:10.1016 / j.canlet.2006.03.031. PMID 16725254.
- ^ Knepper C, Savory EA, День B (май 2011 г.). «Arabidopsis NDR1 представляет собой интегрин-подобный белок, играющий роль в потере жидкости и адгезии плазматической мембраны к клеточной стенке». Физиология растений. 156 (1): 286–300. Дои:10.1104 / стр.110.169656. ЧВК 3091050. PMID 21398259.
- ^ а б Брауэр Е.К., Ахсан Н., Дейл Р., Като Н., Колуччио А.Е., Пиньерос М.А. и др. (Июнь 2016). «Raf-подобная киназа ILK1 и высокоаффинный транспортер K + HAK5 необходимы для врожденного иммунитета и реакции на абиотический стресс». Физиология растений. 171 (2): 1470–84. Дои:10.1104 / стр. 16.00035. ЧВК 4902592. PMID 27208244.
- ^ Popescu SC, Popescu GV, Bachan S, Zhang Z, Seay M., Gerstein M, et al. (Март 2007 г.). «Дифференциальное связывание белков, связанных с кальмодулином, с их мишенями, выявленное с помощью микрочипов белков Arabidopsis высокой плотности». Труды Национальной академии наук Соединенных Штатов Америки. 104 (11): 4730–5. Bibcode:2007ПНАС..104.4730П. Дои:10.1073 / pnas.0611615104. ЧВК 1838668. PMID 17360592.
- ^ Ямамото М., Сато С., Хемми Х., Хосино К., Кайсё Т., Сандзё Х. и др. (Август 2003 г.). «Роль адаптера TRIF в MyD88-независимом пути передачи сигналов toll-подобных рецепторов». Наука. 301 (5633): 640–3. Bibcode:2003Наука ... 301..640Y. Дои:10.1126 / science.1087262. PMID 12855817.
- ^ Ямамото М., Сато С., Хемми Х., Уэмацу С., Хосино К., Кайсё Т. и др. (Ноябрь 2003 г.). «TRAM специфически участвует в опосредованном Toll-подобным рецептором 4 MyD88-независимом сигнальном пути». Иммунология природы. 4 (11): 1144–50. Дои:10.1038 / ni986. PMID 14556004.
- ^ Ямамото М., Сато С., Хемми Х., Санджо Х., Уэмацу С., Кайсё Т. и др. (Ноябрь 2002 г.). «Важная роль TIRAP в активации сигнального каскада, разделяемого TLR2 и TLR4». Природа. 420 (6913): 324–9. Bibcode:2002Натура.420..324л. Дои:10.1038 / природа01182. PMID 12447441.
- ^ Дельбридж Л.М., О'Риордан М.Х. (февраль 2007 г.). «Врожденное распознавание внутриклеточных бактерий». Текущее мнение в иммунологии. 19 (1): 10–6. Дои:10.1016 / j.coi.2006.11.005. PMID 17126540.
- ^ а б Вандер А.Дж., Шерман Дж., Лучано Д. (1998). Физиология человека (7-е изд.). Макгроу-Хилл. С. 159–60. ISBN 978-0-07-067065-5.
- ^ Уилсон Ч., Али Э. С., Скримджер Н., Мартин А. М., Хуа Дж., Таллис Г. А. и др. (Март 2015 г.). «Стеатоз подавляет поступление Ca²⁺, управляемое хранилищами клеток печени, и снижает Ca² в ER посредством механизма, зависимого от протеинкиназы C». Биохимический журнал. 466 (2): 379–90. Дои:10.1042 / bj20140881. PMID 25422863.
- ^ Forman HJ (ноябрь 2009 г.). «Сигнальная трансдукция и реактивные формы». Свободная радикальная биология и медицина. 47 (9): 1237–8. Дои:10.1016 / j.freeradbiomed.2009.09.002. PMID 19735727.
- ^ Лалли Е., Сассоне-Корси П. (июль 1994 г.). «Сигнальная трансдукция и регуляция генов: ядерный ответ на цАМФ». Журнал биологической химии. 269 (26): 17359–62. PMID 8021233.
- ^ а б Розен О.М. (сентябрь 1987 г.). «После связывания инсулина». Наука. 237 (4821): 1452–8. Bibcode:1987Научный ... 237.1452R. Дои:10.1126 / science.2442814. PMID 2442814.
- ^ Massagué J, Gomis RR (май 2006 г.). «Логика сигнализации TGFbeta». Письма FEBS. 580 (12): 2811–20. Дои:10.1016 / j.febslet.2006.04.033. PMID 16678165.
- ^ Сако Ю., Миноччи С., Янагида Т. (март 2000 г.). «Визуализация одной молекулы передачи сигналов EGFR на поверхности живых клеток». Природа клеточной биологии. 2 (3): 168–72. Дои:10.1038/35004044. PMID 10707088.
- ^ Ортон Р.Дж., Штурм О.Е., Вышемирский В., Колдер М., Гилберт Д.Р., Колч В. (декабрь 2005 г.). «Вычислительное моделирование пути MAPK, активируемого рецепторами тирозинкиназы». Биохимический журнал. 392 (Pt 2): 249–61. Дои:10.1042 / BJ20050908. ЧВК 1316260. PMID 16293107.
- ^ Фогельштейн Б., Кинцлер К.В. (август 2004 г.). «Раковые гены и пути, которые они контролируют». Природа Медицина. 10 (8): 789–99. Дои:10,1038 / нм1087. PMID 15286780.
- ^ а б Альбертс Б., Льюис Дж., Рафф М., Робертс К., Уолтер П. (2002). Молекулярная биология клетки (4-е изд.). Нью-Йорк: Наука Гарланд. ISBN 978-0-8153-3218-3.
- ^ а б Брэдшоу и Деннис (2010) стр. 1.
- ^ Тата-младший (июнь 2005 г.). «Сто лет гормонов». EMBO отчеты. 6 (6): 490–6. Дои:10.1038 / sj.embor.7400444. ЧВК 1369102. PMID 15940278.
- ^ Коуэн WM (март 2001 г.). «Виктор Гамбургер и Рита Леви-Монтальчини: путь к открытию фактора роста нервов». Ежегодный обзор нейробиологии. 24 (1): 551–600. Дои:10.1146 / annurev.neuro.24.1.551. PMID 11283321.
- ^ Брэдшоу и Деннис (2010) стр. 2.
- ^ а б Родбелл М. (март 1980 г.). «Роль рецепторов гормонов и GTP-регуляторных белков в мембранной трансдукции». Природа. 284 (5751): 17–22. Bibcode:1980Натура 284 ... 17R. Дои:10.1038 / 284017a0. PMID 6101906.
- ^ Ренсинг Л. (1972). «Периодические геофизические и биологические сигналы как Zeitgeber и экзогенные индукторы в животных организмах». Международный журнал биометеорологии. 16 Дополнение: 113–25. PMID 4621276.
- ^ Тонндорф Дж (сентябрь 1975 г.). «Возвращение к Дэвису-1961. Передача сигнала в соединении волосковых клеток и нервов улитки». Архив отоларингологии. 101 (9): 528–35. Дои:10.1001 / archotol.1975.00780380006002. PMID 169771.
- ^ Эшкрофт SJ, Crossley JR, Crossley PC (март 1976 г.). «Влияние N-ацилглюкозаминов на биосинтез и секрецию инсулина у крыс». Биохимический журнал. 154 (3): 701–7. Дои:10.1042 / bj1540701. ЧВК 1172772. PMID 782447.
- ^ Хильдебранд Э (апрель 1977 г.). «Что Halobacterium говорит нам о фоторецепции?». Биофизика структуры и механизма. 3 (1): 69–77. Дои:10.1007 / BF00536457. PMID 857951.
- ^ Кенни Дж. Дж., Мартинес-Маза О, Фенигер Т., Ашман РФ (апрель 1979 г.). «Синтез липидов: индикатор антиген-индуцированной передачи сигнала в антигенсвязывающих клетках». Журнал иммунологии. 122 (4): 1278–84. PMID 376714.
- ^ Гомпертс Б.Д., Крамер И.М., Татам П.Е. (2002). Передача сигнала. Академическая пресса. ISBN 978-0-12-289631-6.
- ^ Steiner, L.A. (1996) Эволюция иммуноглобулинов, 30 лет спустя. Гликобиология 6, 649-656
- ^ Wu, T. T., Kabat, E. A. (1970) Анализ последовательностей вариабельных областей белков Бенс-Джонса и легких цепей миеломы и их значение для комплементарности антител. J. Exp. Med. 132: 211-250
- ^ Сарма, В. Р., Сильвертон, Е. В., Дэвис, Д. Р., Терри В. Д. (1971) Трехмерная структура молекулы человеческого гамма-иммуноглобулина G1 с разрешением 6 A, J. Biol. Chem. 246 (11) 3752-9
- ^ Бернет, Ф. М. (1976) Модификация теории продуцирования антител Джерна с использованием концепции клонального отбора. КА: Онкологический журнал для врачей 26 (2) 119–21
- ^ Беккер, К. Э., Ишизака, Т., Мецгер, Х., Ишизака, К. и Гримли, П. М. (1973) Поверхностный IgE на базофилах человека во время высвобождения гистамина. J Exp med, 138, 394-408
- ^ Фангер, М. У., Харт, Д. А., Уэллс, Дж. В., и Нисонофф, А. Дж. (1970) Требование перекрестного связывания при стимуляции трансформации периферических лимфоцитов кролика антиглобулиновыми реагентами J. Immun., 105, 1484 - 92
- ^ Клемм Дж. Д., Шрайбер С. Л., Крабтри Г. Р. (1998) Ann. Rev. Immunol. Димеризация как регуляторный механизм передачи сигнала 16: 569-592
- ^ Белл, Г. I. (1974) Модель связывания поливалентных антигенов с клетками, Nature Lond. 248, 430
- ^ ДеЛизи С. и Перельсон А. (1976). Кинетика явлений агрегации, J. theor. Биол. 62, 159-210
- ^ Дембо, М. и Гольдштейн, Б. (1978) Теория равновесного связывания симметричных двухвалентных гаптенов с антителами на клеточной поверхности: применение для высвобождения гистамина из базофилов. Журнал иммунологии 121 (1), 345-353
- ^ Соботка, А. Дембо, М., Гольдштейн, Б. и Лихтенштейн, Л. М. (1979) Антиген-специфическая десенсибилизация базофилов человека The Journal of Immunology, 122 (2) 511-517
- ^ Кагей-Соботка, А., Дембо, М., Гольдштейн, Б., Мецгер, Х. и Лихтенштейн, Л. М. (1981) Качественные характеристики высвобождения гистамина из базофилов человека ковалентно сшитым IgE. Журнал иммунологии 127 (6), 2285-2291
- ^ Как кластеризация рецепторов Т-клеток влияет на передачу сигнала? Джесси Гойетт, Даниэль Дж. Ньевес, Юаньцин Ма, Катарина Гаус Журнал клеточных наук, 2019 г. 132: jcs226423 doi: 10.1242 / jcs.226423 Опубликован 11 февраля 2019 г.
- ^ Макнаб, Р., Д. Э. Кошланд, младший (1972). Механизм определения градиента в бактериальном химиотаксисе. Proc. Natl. Акад. Sci. США 69: 2509-2512
- ^ Берг, Х.С. и Перселл, Э.М. (1977) Физика хеморецепции, Biophys. Дж 20 (2): 193-219
- ^ Кирстен Юнг, Флориан Фабиани, Элизабет Хойер и Юрген Лассак, 2018 Системы бактериальной трансмембранной передачи сигналов и их разработка для биосенсинга Open Biol. Апр; 8 (4): 180023
внешняя ссылка
| Викискладе есть медиафайлы по теме Передача сигнала. |
- Netpath - тщательно подобранный ресурс путей передачи сигналов у людей.
- Преобразование сигналов - виртуальная библиотека биохимии, молекулярной биологии и клеточной биологии
- ТРАНСПАТ (R) - База данных о путях передачи сигналов
- Наука's STKE - Среда знаний о преобразовании сигналов, из журнала Наука, опубликованный AAAS.
- Сигнал + Трансдукция в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)
- UCSD-Nature сигнальный шлюз, от Nature Publishing Group
- LitInspector - Анализ путей передачи сигналов в аннотациях PubMed
- Huaxian Chen и др. Клеточный иммуноцитохимический анализ для мониторинга путей передачи сигналов киназ и эффективности лекарств (PDF) Аналитическая биохимия 338 (2005) 136-142
- www.Redoxsignaling.com
- Сигнализация базы данных PAthway - Университет Кюсю
- Клеточный цикл - Homo sapiens (человек) - КЕГГ ПУТЬ [1]
- База данных Pathway Interaction - NCI
- Созданная в литературе сеть передачи сигналов людей, крупнейшая база данных сетей передачи сигналов людей.