WikiDer > Меланопсин
Меланопсин это тип фотопигмент принадлежат к большему семейству светочувствительных белков сетчатки, называемых опсины и кодируется геном Opn4.[5] В сетчатке млекопитающих есть две дополнительные категории опсинов, обе участвующие в формировании зрительных образов: родопсин и фотопсин (типы I, II и III) в стержень и конус фоторецепторные клетки соответственно.
В организме человека меланопсин содержится в по своей природе светочувствительные ганглиозные клетки сетчатки (IPRGCs).[6] Он также содержится в радужной оболочке мышей и приматов.[7] Меланопсин также содержится у крыс, амфиокс, и другие хордовые.[8] ipRGC представляют собой фоторецепторные клетки, которые особенно чувствительны к поглощению коротковолнового (синего) видимого света и передают информацию непосредственно в область мозга, называемую супрахиазматическое ядро (SCN), также известный как центральные «биологические часы» у млекопитающих.[9] Меланопсин играет важную роль, не формирующую образ в параметр циркадных ритмов, а также других функций. Мутации в Opn4 ген может привести к клиническим нарушениям, таким как Сезонное аффективное расстройство (ГРУСТНЫЙ).[10] Согласно одному исследованию, меланопсин был обнаружен в восемнадцати участках головного мозга человека (вне ретиногипоталамического тракта), внутриклеточно, в виде гранул, в коре головного мозга, коре мозжечка и в нескольких филогенетически старых областях, прежде всего в нейронной соме, а не в ядрах.[11] Меланопсин также экспрессируется в колбочках человека. Однако только от 0,11% до 0,55% колбочек человека экспрессируют меланопсин и обнаруживаются исключительно в периферических областях сетчатки.[12] Периферическая сетчатка человека воспринимает свет с высокой интенсивностью, что лучше всего объясняется четырьмя различными классами фотопигментов.[13]
Открытие
Меланопсин был впервые открыт Игнасио Провенсио как роман опсин в меланофоры, или светочувствительные клетки кожи, Африканская когтистая лягушка в 1998 г.[14] Год спустя исследователи обнаружили, что мыши без каких-либо стержни или же шишки, клетки, участвующие в формировании изображения, по-прежнему увлеченный к свето-темному циклу.[15] Это наблюдение привело к выводу, что ни стержни, ни конусы, расположенные во внешнем сетчатка, необходимы для циркадного увлечения, и что третий класс фоторецепторов существует в глазах млекопитающих.[5] Затем Провенсио и его коллеги обнаружили в 2000 году, что меланопсин также присутствует в сетчатке мышей, особенно в ганглиозные клетки, и что он опосредует невизуальные фоторецептивные задачи.[16] Было обнаружено, что меланопсин кодируется Opn4 с ортологи у самых разных организмов.[5]
Было обнаружено, что эти ганглиозные клетки сетчатки обладают врожденной светочувствительностью, поскольку они реагируют на свет даже в изолированном состоянии, и поэтому были названы по своей природе светочувствительные ганглиозные клетки сетчатки (ipRGC).[17] Они составляют третий класс фоторецепторные клетки в сетчатке млекопитающих, помимо уже известных палочек и колбочек, и было показано, что они являются основным каналом поступления света в циркадные ритмы. фотообучение.[16] Фактически, позже Сатчидананда Панда и его коллеги продемонстрировали, что пигмент меланопсин может участвовать в захвате циркадный осциллятор для световых циклов у млекопитающих, поскольку меланопсин был необходим слепым мышам для реакции на свет.[18]
Распространение видов
Млекопитающие имеют ортологичный названы гены меланопсина Opn4m, которые происходят из одной ветви Opn4 семьи, и примерно на 50-55% сохранены.[19] Однако позвоночные животные, не относящиеся к млекопитающим, включая кур и рыбок данио, имеют другую версию гена меланопсина, Opn4x, который, по-видимому, имеет четкое происхождение, которое расходится с Opn4m около 360 миллионов лет назад.[20] Млекопитающие потеряли ген Opn4x относительно рано в их эволюции, что привело к общему снижению светочувствительности. Считается, что это событие можно объяснить тем фактом, что это произошло во время эволюции ночных млекопитающих.[19]
Структура
Ген меланопсина человека, opn4, выражается в ipRGCs, что составляет всего 1-2% РГК во внутренней сетчатке млекопитающих, как исследовали Самер Хаттар и коллеги.[9] Ген занимает площадь примерно 11,8 т.п.н. и отображается на длинном плече хромосома 10. Ген включает девять интроны и десять экзоны по сравнению с четырьмя-семью экзонами, обычно обнаруживаемыми в других человеческих опсинах.[16] У позвоночных, не являющихся млекопитающими, меланопсин обнаружен в более широком подмножестве клеток сетчатки, а также в светочувствительных структурах за пределами сетчатки, таких как Ирис мышцы глаза, глубокие области мозга, шишковидная железа, и кожа.[19] Паралоги из Opn4 включают OPN1LW, OPN1MW, RHO и OPN3 и были обнаружены в рамках Genome Project.[21]
Меланопсин, как и все другие животные опсины (например. родопсин), является членом Рецептор, связанный с G-белком (GPCR) семья. Белок меланопсин имеет семь альфа спирали интегрирован в плазматическую мембрану, N-концевой домен и С-концевой домен.[22] Это напоминает беспозвоночный опсины гораздо больше, чем позвоночное животное фотопигменты, особенно в аминокислотной последовательности и ниже по течению сигнальный каскад.[17] Подобно опсинам беспозвоночных, это фотопигмент с присущими ему свойствами. фотоизомераза Мероприятия[23] и сигналы через G-белок семейства Gq.
Функция
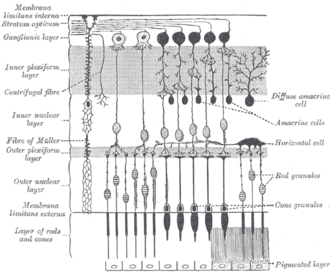
Меланопсин-содержащие ганглиозные клетки,[24] как палочки и колбочки, проявляют как светлые, так и темные приспособление; они регулируют свою чувствительность в соответствии с недавней историей воздействия света.[25] Однако, в то время как палочки и колбочки отвечают за восприятие изображений, узоров, движения и цвета, меланопсин-содержащие ipRGCs способствуют различным рефлексивным реакциям мозга и тела на присутствие света.[17]
Доказательства физиологического обнаружения света меланопсином были протестированы на мышах. Линия клеток мыши, которая обычно не является светочувствительной, Нейро-2а, становится светочувствительным благодаря добавлению человеческого меланопсина. Фотоответ избирательно чувствителен к коротковолновому свету (пиковое поглощение ~ 479 нм),[26][27] и имеет внутреннюю фотоизомераза функция регенерации, хроматически смещенная в сторону более длинных волн.[28]
Фоторецепторы меланопсина чувствительны к диапазону длин волн и достигают пика поглощения света при длине волны синего света около 480 нанометров.[29] Световые волны других длин активируют сигнальную систему меланопсина со снижением эффективности по мере удаления от оптимальных 480 нм. Например, более короткие волны около 445 нм (ближе к фиолетовому в видимый спектр) вдвое менее эффективны для стимуляции фоторецепторов меланопсина, чем свет при 480 нм.[29]
Меланопсин в радужной оболочке некоторых, в первую очередь ночных, млекопитающих закрывает радужную оболочку при воздействии света. Этот локальный световой рефлекс зрачка (PLR) отсутствует у приматов, хотя их радужная оболочка экспрессирует меланопсин.[7]
Механизм
Когда свет соответствующей частоты попадает в глаз, он активирует меланопсин, содержащийся в по своей природе светочувствительные ганглиозные клетки сетчатки (ipRGCs), вызывая потенциал действия. Эти электрические сигналы нейронов проходят через нейроны. аксоны к определенным целям мозга, таким как центр зрачкового контроля, называемый оливарное претектальное ядро (ОПН) среднего мозга. Следовательно, стимуляция меланопсина в ipRGC опосредует поведенческие и физиологические реакции на свет, такие как сужение зрачка и ингибирование мелатонин освобождение от шишковидная железа.[30][31] IpRGC в сетчатке млекопитающих являются одним из концов ретиногипоталамический тракт что проектирует супрахиазматическое ядро (SCN) гипоталамус. Супрахиазматическое ядро иногда называют «главными часами» мозга.[32] поскольку он поддерживает циркадный ритм, а нервные сигналы от ipRGCs к SCN увлекают внутренний циркадный ритм на восход и заход солнца.[9] SCN также получает входные данные от палочек и колбочек через ретиногипоталамический тракт, поэтому информация от всех трех типов светочувствительных клеток (палочки, колбочки и ipRGC) в сетчатке млекопитающих передается в (SCN) SCN.[33]
Считается, что содержащие меланопсин ганглиозные клетки влияют на эти цели, высвобождая нейротрансмиттеры глутамат и полипептид, активирующий аденилатциклазу гипофиза (PACAP) от их аксонных окончаний.[34] Меланопсин-содержащие ганглиозные клетки также получают входные данные от палочек и колбочек, которые могут вносить вклад в эти пути.
Влияние на циркадный ритм
Меланопсин играет важную роль в фотообучение циркадных ритмов у млекопитающих. Организм, который фототренированный выровнял свою деятельность примерно с 24-часовым циклом, солнечный цикл на земле.[35] У млекопитающих аксоны, экспрессирующие меланопсин, нацелены на супрахиазматическое ядро (SCN) сквозь ретиногипоталамический тракт (RHT).[9]
У млекопитающих глаз является основным светочувствительным органом, передающим световые сигналы в мозг. Тем не менее, слепые люди все еще могут вовлекаться в круговорот света и темноты в окружающей среде, несмотря на то, что они не имеют сознательного восприятия света. В одном исследовании испытуемые подвергались воздействию яркого света в течение длительного времени и измеряли их мелатонин концентрации. Мелатонин подавлялся не только у незрячих людей, но и у слепых участников, что позволяет предположить, что световой путь, используемый циркадной системой, функционально не нарушен, несмотря на слепоту.[36] Поэтому врачи больше не практикуют энуклеация слепых пациентов или удаление глаз при рождении, так как глаза играют решающую роль в фотоэнтренинге циркадного водителя ритма.
У мутантных пород мышей, у которых отсутствовали только палочки, только колбочки или и палочки, и колбочки, все породы мышей все еще были вовлечены в изменение световых стимулов в окружающей среде, но с ограниченным ответом, что позволяет предположить, что стержни и шишки не являются необходимыми для циркадного фотоэнтренмента и что в глазу млекопитающих должен быть другой фотопигмент, необходимый для регуляции циркадный Часы.[15]
Меланопсин-нокаутные мыши отображать пониженное фотообмена. По сравнению с мышами дикого типа, которые нормально экспрессировали меланопсин, дефицит индуцированных светом фазовых сдвигов в двигательной активности был отмечен у мышей без меланопсина (Опн4 - / -).[18] Эти мыши с дефицитом меланопсина не полностью утратили свои циркадные ритмы, так как они все еще могли подчиняться меняющимся стимулам окружающей среды, хотя и медленнее, чем обычно.[37] Это указывает на то, что, хотя меланопсина достаточно для увлечения, он должен работать в сочетании с другими фотопигментами для нормальной активности фототравления. Мыши с тройным мутантом, которые были без стержней, конусов и меланопсина, демонстрируют полную потерю циркадных ритмов, поэтому все три фотопигмента в этих фоторецепторах, родопсин, фотопсин и меланопсин необходимы для фотоэпиляции.[38] Следовательно, существует функциональная избыточность между тремя фотопигментами в пути фотоэлементации млекопитающих. Удаление только одного фотопигмента не устраняет способность организма вовлекаться в циклы свет-темнота окружающей среды, но снижает интенсивность реакции.
Регулирование
Меланопсин подвергается фосфорилирование на его внутриклеточном карбоксильный хвост как способ отключить его функцию. По сравнению с другими опсинами, меланопсин имеет необычно длинный карбоксильный хвост, который содержит 37 серин и треонин аминокислотные участки, которые могут подвергаться фосфорилированию.[39] Однако кластера из семи аминокислот достаточно, чтобы дезактивировать меланопсин рыбок данио. Эти сайты дефосфорилируются при воздействии света на меланопсин и отличаются от тех, которые регулируют родопсин.[40] Они важны для правильного ответа на ионы кальция в ipRGC; Отсутствие функциональных сайтов фосфорилирования, особенно по серину-381 и серину-398, снижает реакцию клетки на индуцированный светом приток ионов кальция, когда открываются потенциалзависимые каналы ионов кальция.[41]
Что касается гена Opn4, Дофамин (DA) является фактором регуляции меланопсина. мРНК в ipRGC.[42]
Клиническое значение
Открытие роли меланопсина в зрении, не формирующем изображение, привело к росту оптогенетика. Эта область показала себя многообещающей в клинических применениях, включая лечение глазных заболеваний человека, таких как пигментный ретинит и сахарный диабет.[43] А миссенс-мутация в Opn4, P10L, был вовлечен у 5% пациентов с Сезонное аффективное расстройство (ГРУСТНЫЙ).[10] Это состояние, при котором люди испытывают депрессивные мысли зимой из-за недостатка света. Кроме того, рецептор на основе меланопсина был связан с мигрень боль.[44]
Восстановление зрения
Недавно было проведено исследование роли меланопсина в оптогенетический терапия для пациентов с дегенеративным заболеванием глаз пигментный ретинит (РП).[45] Повторное введение функционального меланопсина в глаза мышей с дегенерацией сетчатки восстанавливает зрачковый световой рефлекс (PLR). Эти же мыши могли отличать световые стимулы от темных стимулов и показали повышенную чувствительность к комнатному свету. Более высокая чувствительность, продемонстрированная этими мышами, дает надежду на восстановление зрения, что может быть применимо к людям и глазным заболеваниям человека.[43][46]
Контроль режима сна / бодрствования
Меланопсин может помочь контролировать циклы сна и бодрствования. Цунемацу и его коллеги создали трансгенный мышей, экспрессирующих меланопсин в гипоталамический орексин нейроны. Коротким 4-секундным импульсом синего света (ориентируясь на оптические волокна) трансгенные мыши могли успешно перейти из медленный сон (SWS), который широко известен как «глубокий сон», до длительного бодрствования. После выключения синего света гипоталамический орексин нейроны проявляли активность в течение нескольких десятков секунд.[43][47] Было показано, что палочки и колбочки не играют никакой роли в наступлении засыпания под действием света, что отличает их от ipRGC и меланопсина. Это убедительно доказывает, что существует связь между ipRGC у людей и бдительностью, особенно при использовании высокочастотного света (например, синего света). Следовательно, меланопсин можно использовать в качестве терапевтической мишени для контроля цикла сна-бодрствования.[48]
Регулирование уровня глюкозы в крови
В статье, опубликованной Йе и коллегами в 2011 году, меланопсин был использован для создания оптогенетического синтетического устройства транскрипции, которое было протестировано в терапевтических условиях для получения Fc-глюкагоноподобный пептид 1 (Fc-GLP-1), гибридный белок, который помогает контролировать уровень глюкозы в крови у млекопитающих с Диабет II типа. Исследователи подкожно имплантировали мышам микрокапсулированный трансгенный HEK 293 клетки которые были котрансфицированы двумя векторами, включая ген меланопсина и интересующий ген, в рамках NFAT (ядерный фактор активированных Т-клеток) промоутер соответственно. Именно через этот сконструированный путь они успешно контролировали экспрессию Fc-GLP-1 у мышей с двойным рецессивным диабетом и снижали гипергликемияили высокий уровень глюкозы в крови у этих мышей. Это указывает на перспективность использования меланопсина в качестве оптогенетического инструмента для лечения диабета II типа.[43][49]
Смотрите также
- Световые эффекты на циркадный ритм
- Опсины
- Собственно светочувствительные ганглиозные клетки сетчатки (ipRGC)
- Супрахиазматическое ядро (SCN)
- Ретиногипоталамический тракт
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000122375 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000021799 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ «Ссылка на Mouse PubMed:». Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ а б c Хэнкинс М.В., Пирсон С.Н., Фостер Р.Г. (январь 2008 г.). «Меланопсин: захватывающий фотопигмент» (PDF). Тенденции в неврологии. 31 (1): 27–36. Дои:10.1016 / j.tins.2007.11.002. PMID 18054803. S2CID 1645433.
- ^ Провенсио I, Warthen DM (2012). «Меланопсин, фотопигмент по своей природе светочувствительных ганглиозных клеток сетчатки». Междисциплинарные обзоры Wiley: мембранный транспорт и передача сигналов. 1 (2): 228–237. Дои:10.1002 / wmts.29.
- ^ а б Xue T, Do MT, Riccio A, Jiang Z, Hsieh J, Wang HC и др. (Ноябрь 2011 г.). «Передача сигналов меланопсина в радужке и сетчатке глаза млекопитающих». Природа. 479 (7371): 67–73. Bibcode:2011Натура 479 ... 67X. Дои:10.1038 / природа10567. ЧВК 3270891. PMID 22051675.
- ^ Angueyra JM, Pulido C, Malagón G, Nasi E, Gomez MD (2012). «Экспрессирующие меланопсин фоторецепторы амфиоксуса передают свет через сигнальный каскад фосфолипазы C». PLOS ONE. 7 (1): e29813. Bibcode:2012PLoSO ... 729813A. Дои:10.1371 / journal.pone.0029813. ЧВК 3250494. PMID 22235344.
- ^ а б c d Хаттар С., Ляо Х.В., Такао М., Берсон Д.М., Яу К.В. (февраль 2002 г.). «Меланопсин-содержащие ганглиозные клетки сетчатки: архитектура, проекции и внутренняя светочувствительность». Наука. 295 (5557): 1065–70. Bibcode:2002Научный ... 295.1065H. Дои:10.1126 / science.1069609. ЧВК 2885915. PMID 11834834.
- ^ а б Роклейн К.А., Рохан К.Дж., Дункан В.К., Роллаг М.Д., Розенталь Н.Е., Липски Р.Х., Провенсио I (апрель 2009 г.). «Миссенс вариант (P10L) гена меланопсина (OPN4) при сезонном аффективном расстройстве». Журнал аффективных расстройств. 114 (1–3): 279–85. Дои:10.1016 / j.jad.2008.08.005. ЧВК 2647333. PMID 18804284.
- ^ Ниссила Дж., Мянттяри С., Туоминен Х., Сяркиоя Т., Такала Т., Саарела С., Тимонен М. (2012). «P-780 - Изобилие и распределение белка меланопсина (OPN4) в мозге человека». Европейская психиатрия. 27: 1–8. Дои:10.1016 / S0924-9338 (12) 74947-7.
- ^ Dkhissi-Benyahya O, Rieux C, Hut RA, Cooper HM (апрель 2006 г.). «Иммуногистохимическое доказательство наличия конуса меланопсина в сетчатке человека». Исследовательская офтальмология и визуализация. 47 (4): 1636–41. Дои:10.1167 / iovs.05-1459. PMID 16565403.
- ^ Хоригучи Х., Винавер Дж., Догерти Р.Ф., Ванделл Б.А. (январь 2013 г.). "Новый взгляд на трихроматию человека". Труды Национальной академии наук Соединенных Штатов Америки. 110 (3): E260-9. Bibcode:2013PNAS..110E.260H. Дои:10.1073 / pnas.1214240110. ЧВК 3549098. PMID 23256158.
- ^ Провенсио I, Цзян Джи, Де Грип В.Дж., Хейс В.П., Роллаг Мэриленд (январь 1998 г.). «Меланопсин: опсин в меланофорах, мозге и глазах». Труды Национальной академии наук Соединенных Штатов Америки. 95 (1): 340–5. Bibcode:1998ПНАС ... 95..340П. Дои:10.1073 / пнас.95.1.340. ЧВК 18217. PMID 9419377.
- ^ а б Фридман М.С., Лукас Р.Дж., Сони Б., фон Шанц М., Муньос М., Дэвид-Грей З., Фостер Р. (апрель 1999 г.). «Регуляция циркадного поведения млекопитающих с помощью не-стержневых, неконусных, глазных фоторецепторов». Наука. 284 (5413): 502–4. Bibcode:1999Научный ... 284..502F. Дои:10.1126 / science.284.5413.502. PMID 10205061.
- ^ а б c Провенсио I, Родригес И.Р., Цзян Г., Хейс В.П., Морейра Э.Ф., Роллаг, доктор медицины (январь 2000 г.). «Новый человеческий опсин во внутренней сетчатке». Журнал неврологии. 20 (2): 600–5. Дои:10.1523 / JNEUROSCI.20-02-00600.2000. ЧВК 6772411. PMID 10632589.
- ^ а б c Берсон Д.М., Данн Ф.А., Такао М. (февраль 2002 г.). «Фототрансдукция ганглиозными клетками сетчатки, которые устанавливают циркадные часы». Наука. 295 (5557): 1070–3. Bibcode:2002Наука ... 295.1070B. Дои:10.1126 / science.1067262. PMID 11834835. S2CID 30745140.
- ^ а б Panda S, Sato TK, Castrucci AM, Rollag MD, DeGrip WJ, Hogenesch JB и др. (Декабрь 2002 г.). «Требование меланопсина (Opn4) для нормального светоиндуцированного циркадного фазового сдвига» (PDF). Наука. 298 (5601): 2213–6. Bibcode:2002Научный ... 298.2213P. Дои:10.1126 / science.1076848. PMID 12481141. S2CID 20602808.
- ^ а б c Беллингем Дж., Чауразия С.С., Мелян З., Лю С., Камерон М.А., Тарттелин Э.Е. и др. (Июль 2006 г.). «Эволюция фоторецепторов меланопсина: открытие и характеристика нового меланопсина у позвоночных, не являющихся млекопитающими». PLOS Биология. 4 (8): e254. Дои:10.1371 / journal.pbio.0040254. ЧВК 1514791. PMID 16856781.

- ^ Бентон MJ (май 1990 г.). «Филогения основных групп четвероногих: морфологические данные и даты дивергенции». Журнал молекулярной эволюции. 30 (5): 409–24. Bibcode:1990JMolE..30..409B. Дои:10.1007 / BF02101113. PMID 2111854. S2CID 35082873.
- ^ Бараас Р.К., Хаген Л.А., Дис Е.В., Нейтц М. (ноябрь 2012 г.). «Замена изолейцина на треонин в положении 190 S-опсина вызывает нарушения функции S-конуса». Исследование зрения. 73: 1–9. Дои:10.1016 / j.visres.2012.09.007. ЧВК 3516400. PMID 23022137.
- ^ Тобин А.Б. (март 2008 г.). «Фосфорилирование рецептора, сопряженного с G-белком: где, когда и кем». Британский журнал фармакологии. 153 Дополнение 1: С167-76. Дои:10.1038 / sj.bjp.0707662. ЧВК 2268057. PMID 18193069.
- ^ Панда С., Наяк С.К., Кампо Б., Уокер Дж. Р., Хогенеш Дж. Б., Джегла Т. (январь 2005 г.). «Освещение сигнального пути меланопсина». Наука. 307 (5709): 600–4. Bibcode:2005Наука ... 307..600П. Дои:10.1126 / science.1105121. PMID 15681390. S2CID 22713904.
- ^ Фейгл Б., Зеле А.Дж. (август 2014 г.). «Меланопсин-экспрессирующие по своей природе светочувствительные ганглиозные клетки сетчатки при заболевании сетчатки» (PDF). Оптометрия и зрение. 91 (8): 894–903. Дои:10.1097 / OPX.0000000000000284. PMID 24879087. S2CID 34057255.
- ^ Вонг К.Ю., Данн Ф.А., Берсон Д.М. (декабрь 2005 г.). «Адаптация фоторецепторов во внутренних светочувствительных ганглиозных клетках сетчатки». Нейрон. 48 (6): 1001–10. Дои:10.1016 / j.neuron.2005.11.016. PMID 16364903.
- ^ Бейлс Х.Дж., Лукас Р.Дж. (май 2013 г.). «Человеческий меланопсин образует пигмент, максимально чувствительный к синему свету (λmax ≈ 479 нм), поддерживающий активацию сигнальных каскадов G (q / 11) и G (i / o)». Ход работы. Биологические науки. 280 (1759): 20122987. Дои:10.1098 / rspb.2012.2987. ЧВК 3619500. PMID 23554393.
- ^ Берсон Д.М. (август 2007 г.). «Фототрансдукция в фоторецепторах ганглиозных клеток». Pflügers Archiv. 454 (5): 849–55. Дои:10.1007 / s00424-007-0242-2. PMID 17351786.
- ^ Melyan Z, Tarttelin EE, Bellingham J, Lucas RJ, Hankins MW (февраль 2005 г.). «Добавление человеческого меланопсина делает клетки млекопитающих светочувствительными». Природа. 433 (7027): 741–5. Bibcode:2005Натура.433..741М. Дои:10.1038 / природа03344. PMID 15674244. S2CID 4426682.
- ^ а б Энези Дж., Ревелл В., Браун Т., Винн Дж., Шланген Л., Лукас Р. (август 2011 г.). «Меланопическая» функция спектральной эффективности предсказывает чувствительность фоторецепторов меланопсина к полихроматическому свету ». Журнал биологических ритмов. 26 (4): 314–23. Дои:10.1177/0748730411409719. PMID 21775290. S2CID 22369861.
- ^ Марквелл Э.Л., Фейгл Б., Зеле А.Дж. (май 2010 г.). «Вклад в светочувствительный меланопсин ганглиозных клеток сетчатки в световой рефлекс зрачка и циркадный ритм» (PDF). Клиническая и экспериментальная оптометрия. 93 (3): 137–49. Дои:10.1111 / j.1444-0938.2010.00479.x. PMID 20557555. S2CID 21778407.
- ^ Заиди Ф.Х., Халл Дж. Т., Пирсон С. Н., Вульф К., Эшбах Д., Гули Дж. Дж. И др. (Декабрь 2007 г.). «Коротковолновая световая чувствительность циркадного, зрачкового и зрительного восприятия у людей, у которых отсутствует внешняя сетчатка». Текущая биология. 17 (24): 2122–8. Дои:10.1016 / j.cub.2007.11.034. ЧВК 2151130. PMID 18082405.
- ^ Эванс Дж. А. (июль 2016 г.). «Коллективное хронометрирование среди ячеек главных циркадных часов». Журнал эндокринологии. 230 (1): Р27-49. Дои:10.1530 / JOE-16-0054. ЧВК 4938744. PMID 27154335.
- ^ Репперт С.М., Уивер Д.Р. (август 2002 г.). «Координация суточного ритма у млекопитающих». Природа. 418 (6901): 935–41. Bibcode:2002Натура 418..935р. Дои:10.1038 / природа00965. PMID 12198538. S2CID 4430366.
- ^ Ганнибал Дж., Фаренкруг Дж. (Апрель 2004 г.). «Целевые области, иннервируемые PACAP-иммунореактивными ганглиозными клетками сетчатки». Исследования клеток и тканей. 316 (1): 99–113. Дои:10.1007 / s00441-004-0858-х. PMID 14991397. S2CID 24148323.
- ^ Аллада Р., Эмери П., Такахаши Дж. С., Росбаш М. (2001). «Остановка времени: генетика циркадных часов мух и мышей». Ежегодный обзор нейробиологии. 24 (1): 1091–119. Дои:10.1146 / annurev.neuro.24.1.1091. PMID 11520929.
- ^ Cheisler CA, Shanahan TL, Klerman EB, Martens H, Brotman DJ, Emens JS и др. (Январь 1995 г.). «Подавление секреции мелатонина у некоторых слепых пациентов при воздействии яркого света». Медицинский журнал Новой Англии. 332 (1): 6–11. Дои:10.1056 / NEJM199501053320102. PMID 7990870.
- ^ Rollag MD, Berson DM, Provencio I (июнь 2003 г.). «Меланопсин, фоторецепторы ганглиозных клеток и фотоэлемент млекопитающих». Журнал биологических ритмов. 18 (3): 227–34. Дои:10.1177/0748730403018003005. PMID 12828280. S2CID 9034442.
- ^ Panda S, Provencio I, Tu DC, Pires SS, Rollag MD, Castrucci AM и др. (Июль 2003 г.). «Меланопсин необходим для световых ответов, не формирующих изображения у слепых мышей». Наука. 301 (5632): 525–7. Bibcode:2003Наука ... 301..525П. Дои:10.1126 / science.1086179. PMID 12829787. S2CID 37600812.
- ^ Blasic JR, Lane Brown R, Robinson PR (май 2012 г.). «Светозависимое фосфорилирование карбоксильного хвоста меланопсина мыши». Клеточные и молекулярные науки о жизни. 69 (9): 1551–62. Дои:10.1007 / s00018-011-0891-3. ЧВК 4045631. PMID 22159583.
- ^ Blasic JR, Matos-Cruz V, Ujla D, Cameron EG, Hattar S, Halpern ME, Robinson PR (апрель 2014 г.). «Идентификация критических сайтов фосфорилирования на карбоксильном хвосте меланопсина». Биохимия. 53 (16): 2644–9. Дои:10.1021 / bi401724r. ЧВК 4010260. PMID 24678795.
- ^ Фаренкруг Дж., Фальктофт Б., Георг Б., Ганнибал Дж., Кристиансен С.Б., Клаузен Т.К. (декабрь 2014 г.). «Фосфорилирование меланопсина крысы по Ser-381 и Ser-398 светом / темнотой и его значение для передачи сигналов Ca2 + по внутренним светочувствительным ганглиозным клеткам (ipRGC)». Журнал биологической химии. 289 (51): 35482–93. Дои:10.1074 / jbc.M114.586529. ЧВК 4271233. PMID 25378407.
- ^ Сакамото К., Лю С., Касамацу М., Поздеев Н.В., Ювоне П.М., Тосини Дж. (Декабрь 2005 г.). «Дофамин регулирует экспрессию мРНК меланопсина в светочувствительных ганглиозных клетках сетчатки». Европейский журнал нейробиологии. 22 (12): 3129–36. Дои:10.1111 / j.1460-9568.2005.04512.x. PMID 16367779. S2CID 21517576.
- ^ а б c d Коидзуми А., Танака К.Ф., Яманака А. (январь 2013 г.). «Манипуляция нервной и клеточной активностью путем эктопической экспрессии меланопсина». Нейробиологические исследования. 75 (1): 3–5. Дои:10.1016 / j.neures.2012.07.010. PMID 22982474. S2CID 21771987.
- ^ Дженнифер Кузен-Франкель (2010). «Почему свет ухудшает мигрень - ScienceNOW». В архиве из оригинала 31 июля 2016 г.. Получено 3 апреля 2011.
- ^ Busskamp V, Picaud S, Sahel JA, Roska B (февраль 2012 г.). «Оптогенетическая терапия пигментного ретинита». Генная терапия. 19 (2): 169–75. Дои:10.1038 / gt.2011.155. PMID 21993174.
- ^ Лин Б., Коидзуми А., Танака Н., Панда С., Масланд Р. Х. (октябрь 2008 г.). «Восстановление зрительной функции у мышей с дегенерацией сетчатки путем эктопической экспрессии меланопсина». Труды Национальной академии наук Соединенных Штатов Америки. 105 (41): 16009–14. Bibcode:2008ПНАС..10516009Л. Дои:10.1073 / pnas.0806114105. ЧВК 2572922. PMID 18836071.
- ^ Цунемацу Т., Танака К.Ф., Яманака А., Коидзуми А. (январь 2013 г.). «Эктопическая экспрессия меланопсина в нейронах орексина / гипокретина позволяет контролировать бодрствование мышей in vivo с помощью синего света». Нейробиологические исследования. 75 (1): 23–8. Дои:10.1016 / j.neures.2012.07.005. PMID 22868039. S2CID 207152803.
- ^ Лупи Д., Остер Х., Томпсон С., Фостер Р. Г. (сентябрь 2008 г.). «Острая световая индукция сна опосредуется фоторецепцией на основе OPN4» (PDF). Природа Неврологии. 11 (9): 1068–73. Дои:10.1038 / № 2179. HDL:11858 / 00-001M-0000-0012-DD96-A. PMID 19160505. S2CID 15941500.
- ^ Йе Х, Дауд-Эль-Баба М., Пэн Р.В., Фуссенеггер М. (июнь 2011 г.). «Синтетическое оптогенетическое устройство для транскрипции усиливает гомеостаз глюкозы в крови у мышей». Наука. 332 (6037): 1565–8. Bibcode:2011Научный ... 332.1565Y. Дои:10.1126 / science.1203535. PMID 21700876. S2CID 6166189.
дальнейшее чтение
- Ровере Дж., Надаль-Николас FM, Ван Дж., Бернал-Гарро Дж. М., Гарсия-Каррильо Н., Вильегас-Перес депутат и др. (Декабрь 2016 г.). "Меланопсин-содержащий или немеланопсин-содержащий ответ ганглиозных клеток сетчатки на острую глазную гипертензию с нейропротекцией нейротрофического фактора мозга или без нее". Исследовательская офтальмология и визуализация. 57 (15): 6652–6661. Дои:10.1167 / iovs.16-20146. PMID 27930778.




