WikiDer > Термолизин
| Термолизин | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Кристаллографическая структура Bacillus thermoproteolyticus термолизин.[1] | |||||||||
| Идентификаторы | |||||||||
| Номер ЕС | 3.4.24.27 | ||||||||
| Количество CAS | 9073-78-3 | ||||||||
| Базы данных | |||||||||
| IntEnz | Просмотр IntEnz | ||||||||
| БРЕНДА | BRENDA запись | ||||||||
| ExPASy | Просмотр NiceZyme | ||||||||
| КЕГГ | Запись в KEGG | ||||||||
| MetaCyc | метаболический путь | ||||||||
| ПРИАМ | профиль | ||||||||
| PDB структуры | RCSB PDB PDBe PDBsum | ||||||||
| |||||||||
Термолизин (EC 3.4.24.27, Нейтральная протеиназа Bacillus thermoproteolyticus, термоаз, термоаз Y10, TLN) это термостабильный нейтральный металлопротеиназа фермент произведенный Грамположительный бактерии Bacillus thermoproteolyticus.[2] Это требует одного ион цинка для ферментативной активности и четыре ионы кальция для структурной устойчивости.[3] Термолизин специфически катализирует гидролиз из пептидные связи содержащий гидрофобные аминокислоты. Однако термолизин также широко используется для образования пептидной связи посредством обратной реакции гидролиза.[4] Термолизин - самый стабильный член семейства металлопротеиназ, продуцируемых различными Бациллы разновидность. Эти ферменты также называют «нейтральными» протеиназами или термолизин-подобными протеиназами (TLP).
Синтез
Как и все бактериальные внеклеточный протеазы термолизин сначала синтезируется бактериями как пре-профермент.[5] Термолизин синтезируется как пре-профермент, состоящий из сигнальный пептид Длина 28 аминокислот, длина пропептида 204 аминокислоты и длина самого зрелого фермента 316 аминокислот. Сигнальный пептид действует как сигнал для перемещение препротермолизина к бактериальному цитоплазматическая мембрана. в периплазма затем препротермолизин превращается в протермолизин посредством сигнальная пептидаза. Затем последовательность действий действует как молекулярный шаперон и приводит к авторасщеплению пептидной связи, связывающей про- и зрелые последовательности. Затем зрелый белок секретируется во внеклеточную среду.[6]
Структура
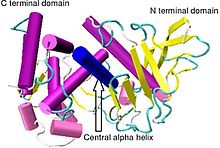
Термолизин имеет молекулярную массу 34 600 Да. Его общая структура состоит из двух примерно сферических домены с глубокой щелью, проходящей через середину молекулы, разделяющей два домена. В вторичная структура каждого домена совершенно разные, N-концевой домен состоит в основном из бета плиссированный лист, в то время как C-терминал домен в основном альфа спиральный в структуре. Эти два домена связаны центральной альфа-спиралью, охватывающей аминокислоты 137–151.[7]
В отличие от многих белков, которые претерпевают конформационные изменения при нагревании и денатурациятермолизин не претерпевает каких-либо серьезных конформационных изменений, по крайней мере, до 70 ° C.[8] Термическая стабильность членов семейства TLP измеряется с помощью Т50 температура. Инкубация при этой температуре в течение 30 минут снижает активность ферментов вдвое. Термолизин имеет Т50 значение 86,9 ° C, что делает его наиболее термостабильным членом семейства TLP.[9] Исследования вклада кальций на стабильность термолизина показали, что при термической инактивации из молекулы высвобождается единственный ион кальция.[10] Предотвращение первоначального связывания этого кальция с молекулой посредством мутация его сайта связывания снижает стабильность термолизина на 7 ° C. Однако, хотя связывание кальция вносит значительный вклад в стабилизацию термолизина, более важным для стабильности является небольшой кластер аминокислот N-концевого домена, расположенный на поверхности белков.[9] В частности фенилаланин (F) в положении 63 аминокислоты и пролин (P) в положении 69 аминокислоты вносит значительный вклад в стабильность термолизина. Замена этих аминокислот на треонин (T) и аланин (A) соответственно в менее стабильной термолизин-подобной протеиназе, продуцируемой Bacillus stearothermophillus (TLP-ste), приводит к индивидуальному снижению стабильности на 7 ° C (F63 → T) и 6,3 ° C (P69 → A), а в сочетании - к снижению стабильности на 12,3 ° C.[9]
Приложения
- В синтезе аспартам, менее горький на вкус побочный продукт образуется, когда реакция катализируется термолизином.[11]
- Определение стабильности белка в клеточном лизате с помощью быстрый параллельный протеолиз (FASTpp) проба.[12]
Рекомендации
- ^ PDB: 3ТМН; Холден Х.М., Мэтьюз Б.В. (март 1988 г.). «Связывание L-валил-L-триптофана с кристаллическим термолизином иллюстрирует способ взаимодействия продукта гидролиза пептидов». J. Biol. Chem. 263 (7): 3256–60. PMID 3343246.
- ^ Эндо, С. (1962). «Исследования протеаз, продуцируемых термофильными бактериями». J. Ferment. Technol. 40: 346–353.
- ^ Таджима М., Урабе И. и др. (1976). «Роль ионов кальция в термостабильности термолизина и нейтральной протеазы Bacillus subtilis var. Amylosacchariticus». Евро. J. Biochem. 64 (1): 243–247. Дои:10.1111 / j.1432-1033.1976.tb10293.x. PMID 819262.
- ^ Трусек-Холовня А. (2003). «Синтез ZAlaPheOMe, предшественника горького дипептида в двухфазной системе этилацетат-вода, катализируемый термолизином». J. Biotechnol. 102 (2): 153–163. Дои:10.1016 / S0168-1656 (03) 00024-5. PMID 12697393.
- ^ Ясукава К., Кусано М., Иноуэ К. (2007). «Новый метод внеклеточного производства рекомбинантного термолизина путем совместной экспрессии зрелой последовательности и пропоследовательности в Escherichia coli». Protein Eng. Des. Sel. 20 (8): 375–383. Дои:10.1093 / белок / gzm031. PMID 17616558.
- ^ Иноуэ К., Кусано М. и др. (2007). Разработка, экспрессия, очистка и производство рекомбинантного термолизина. Biotechnol. Анну. Rev. Ежегодный обзор биотехнологии. 13. С. 43–64. Дои:10.1016 / S1387-2656 (07) 13003-9. ISBN 978-0-444-53032-5. PMID 17875473.
- ^ Холмс М.А., Мэтьюз Б.В. (1982). «Структура термолизина уточнена при разрешении 1,6 А». J. Mol. Биол. 160 (4): 623–639. Дои:10.1016/0022-2836(82)90319-9. PMID 7175940.
- ^ Мэтьюз Б.В., Уивер Л.Х., Кестер В.Р. (1974). «Конформация термолизина». J. Biol. Chem. 249 (24): 8030–8044. PMID 4214815.
- ^ а б c Эйсинк В.Г., Велтман О.Р. и др. (1995). «Структурные детерминанты стабильности термолизиноподобных протеиназ». Nat. Struct. Биол. 2 (5): 374–379. Дои:10.1038 / nsb0595-374. PMID 7664094.
- ^ Далквист Ф. В., Лонг Дж. В., Бигби В. Л. (1976). «Роль кальция в термостабильности термолизина». Биохимия. 15 (5): 1103–1111. Дои:10.1021 / bi00650a024. PMID 814920.
- ^ Ягасаки, Макото; Хасимото, Син-ичи (ноябрь 2008 г.). «Синтез и применение дипептидов; современное состояние и перспективы». Прикладная микробиология и биотехнология. 81 (1): 13–22. Дои:10.1007 / s00253-008-1590-3. PMID 18795289.
- ^ Минде, Дэвид П .; Морис, Маделон М .; Рюдигер, Стефан Г. Д. (2012). «Определение биофизической стабильности белков в лизатах с помощью анализа быстрого протеолиза, FASTpp». PLOS ONE. 7 (10): e46147. Дои:10.1371 / journal.pone.0046147. ЧВК 3463568. PMID 23056252.
внешняя ссылка
- В МЕРОПЫ онлайн-база данных пептидаз и их ингибиторов: M04.001
- Термолизин в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)