WikiDer > Токсокароз - Википедия
| Токсокароз | |
|---|---|
| Другие имена | аскарида |
 | |
| Toxocara canis | |
| Специальность | Инфекционное заболевание |
| Дифференциальная диагностика | филяриоз |
| Медикамент | ивермектин |
Токсокароз болезнь человека, вызванная личинки (незрелые черви) собаки аскарида (Toxocara canis), кошачий аскарид (Toxocara cati) или аскариды лисицы (Toxocara canis).[1] Токсокароз часто называют висцеральная мигрирующая личинка (VLM). В зависимости от географического положения степень эозинофилия, глазные и / или легочные признаки, термины окуляр личинка мигрирующая (ОЛМ), Болезнь Вайнгартена, Фримодт-Мёллерсиндром и эозинофильный псевдолейкоз[2] применяются при токсокарозе. Другие термины, которые иногда или редко используются, включают нематодный офтальмит, токсокаральное заболевание, токсокароз и скрытый токсокароз.[3] Этот зоонозный, глистный инфекция - редкая причина слепоты и может спровоцировать ревматический, неврологический, или же астматик симптомы.[4] Люди обычно заражаются при проглатывании яиц с зародышем (каждое из которых содержит полностью развитую вторую стадию личинка, L2) из загрязненных источников (почва, недоваренное мясо, свежие или немытые овощи).[2]
Toxocara canis и Toxocara cati возможно, самые повсеместно желудочно-кишечный черви (гельминты) домашних собак, кошек, койотов, волков и лисиц.[1] Есть много «случайных» или паратенический хозяева, включая людей, птиц, свиней, грызунов, коз, обезьян и кроликов.[2] У паратенических хозяев личинки никогда не созревают и остаются на стадии L2.[3]
Выделяют три основных синдрома: висцеральная мигрирующая личинка (VLM), который включает заболевания, связанные с основными органами; скрытый токсокароз, которая является более мягкой версией VLM; и глазная мигрирующая личинка (OLM), при котором патологическое воздействие на хозяина ограничивается глазом и Зрительный нерв.[5]
Признаки и симптомы
Физиологические реакции на Токсокара Инфекция зависит от иммунного ответа хозяина и паразитарной нагрузки.[6] В большинстве случаев Токсокара инфекции бессимптомный, особенно у взрослых.[6][7][8] Когда симптомы действительно возникают, они являются результатом миграции второй стадии. Токсокара личинки по телу.[3]
Скрытый токсокароз является наименее серьезным из трех синдромов и, как полагают, возникает в результате хронического воздействия. [9] Признаками и симптомами скрытого токсокароза являются кашель, лихорадка, боль в животе, головные боли, а также изменение поведения и способности спать.[6][10] При медицинском осмотре хрипы, гепатомегалия, и лимфаденит часто отмечаются.[6]
Высокие паразитарные нагрузки или повторное инфицирование могут привести к висцеральной мигрирующей личинке (VLM).[7] VLM в первую очередь диагностируется у маленьких детей, потому что они более подвержены воздействию и проглатыванию инфекционных яиц.[3] Токсокара инфекция обычно проходит в течение нескольких недель, но хроническая эозинофилия может привести.[6] При VLM миграция личинок вызывает воспаление внутренних органов, а иногда и центральной нервной системы.[6][7] Симптомы зависят от пораженного органа (ов).[6] Пациенты могут иметь бледность, утомляемость, потерю веса, анорексию, лихорадку, головную боль, кожную сыпь, кашель, астму, стеснение в груди, повышенную раздражительность, боль в животе, тошноту и рвоту.[3][6] Иногда можно увидеть следы подкожной миграции личинок.[3] Пациентам обычно ставят диагноз: пневмония, бронхоспазмы, хроническое воспаление легких, гиперэозинофилия, гепатомегалия, гипергаммаглобулинемия (Классы IgM, IgG и IgE), лейкоцитоз, и повышенный уровень анти-A и –B изогемагглютининов.[3][5][7][10] Тяжелые случаи имели место у людей с повышенной чувствительностью к аллергенам; в редких случаях эпилепсия, воспаление сердца, плевральный выпот, дыхательная недостаточность и смерть наступили в результате VLM.[6][10]
Глазная мигрирующая личинка (OLM) встречается редко по сравнению с VLM.[3][11] Свет Токсокара Считается, что нагрузка вызывает слабый иммунный ответ, позволяя личинке попасть в глаз хозяина.[10] Хотя были случаи одновременного использования OLM и VLM, это исключительно исключительные случаи.[10] OLM часто возникает только в одном глазу и от одной личинки, мигрирующей в орбиту и инцистирующей ее.[3][12] Потеря зрения происходит в течение нескольких дней или недель.[10] Другие признаки и симптомы: красные глаза, белый зрачок, фиксированный зрачок, фиброз сетчатки, отслойка сетчатки, воспаление тканей глаза, сетчатка гранулемы, и косоглазие.[3][10][12][13] Глазные гранулемы, возникшие в результате OLM, часто ошибочно диагностируются как ретинобластомы.[3] Токсокара повреждение глаза необратимо и может привести к слепоте.[6][7][12]
Тематическое исследование, опубликованное в 2008 году, подтвердило гипотезу о том, что эозинофильный целлюлит также может быть вызван инфекцией Токсокара. В этом исследовании взрослый пациент представил эозинофильный целлюлит, гепатоспленомегалия, анемия, и положительный ELISA за T. caniс.[14]
Период инкубации
Инкубационный период для Toxocara canis и кати яйца зависит от температуры и влажности.[3][15] Т. canis в частности, самки способны производить до 200000 яиц в день, что требует 2–6 недель минимум за пару месяцев до полного развития инфекционной стадии.[16] Под идеальным летние условия, яйца могут созреть до инфекционной стадии через две недели вне хозяина.[6][10][15] При условии наличия достаточного количества кислорода и влаги, Токсокара яйца могут оставаться заразными в течение многих лет, поскольку их устойчивая внешняя оболочка обеспечивает защиту от большинства угроз окружающей среды.[17][6][18][19] Однако, как показано в тематическом исследовании, представленном в журнале гельминтологии, вторая стадия развития личинок представляет собой строгую уязвимость для определенных элементов окружающей среды.[17] Высокие температуры и низкий уровень влажности быстро приведут к деградировать личинки на этой стадии роста.[17]
| Токсокароз | |
|---|---|
| Научная классификация | |
| Королевство: | Animalia |
| Тип: | Нематода |
| Учебный класс: | Хромадорея |
| Заказ: | Аскаридида |
| Семья: | Toxocaridae |
| Род: | Токсокара |
| Разновидность | |
Виды включают:[20] | |
Передача инфекции
Передача Токсокара для людей обычно через прием инфекционных яиц.[7][15] Т. canis может откладывать около 200 000 яиц в день.[22] Эти яйца передаются с фекалиями кошек или собак, но привычки собак к дефекации вызывают Т. canis передача более распространена, чем Т. cati.[3][15] Обе Toxocara canis и Toxocara cati Яйцам требуется инкубационный период в течение нескольких недель во влажной, влажной погоде, вне организма-хозяина, прежде чем они станут заразными, поэтому свежие яйца не могут вызвать токсокароз.[3][6][15][22]
Многие предметы и поверхности могут быть заражены инфекционными Токсокара яйца. Мухи, питающиеся фекалиями, могут распространяться Токсокара яйца на поверхности или продукты.[10] Маленькие дети, которые берут в рот зараженные предметы или едят грязь (пика) подвержены риску развития симптомов.[3][5][10] Люди также могут заразить пищу, если не мыть руки перед едой.[6][7]
Люди - не единственные случайные хозяева Токсокара.[23] Недоваренный кролик, курица или овца может привести к заражению; Инцистированные личинки в мясе могут реактивироваться и мигрировать через человека-хозяина, вызывая токсокароз.[23] Особое внимание следует уделить тщательной варке потрохов и печени, чтобы избежать передачи инфекции.[3][10]
Резервуар
Собаки и лисы - это резервуар для Toxocara canis, но щенки и детеныши представляют наибольший риск распространения инфекции среди людей.[6][7] Инфекция у большинства взрослых собак характеризуется наличием инцистированных личинок второй стадии. Однако эти личинки могут реактивироваться у беременных самок и преодолевать плацентарный барьер, заражая детенышей. Вертикальная передача также может происходить через грудное молоко.[3][15][24] Инфекционные матери и щенки младше пяти недель откладывают яйца с фекалиями.[15][24] Примерно 50% щенков и 20% взрослых собак инфицированы Т. canis.[3]
Кошки - это резервуар для Toxocara cati.[6][7] Как и с Т. canisинцистированные личинки второй стадии у беременных или кормящих кошек реактивируются. Однако вертикальная передача может происходить только при грудном вскармливании.[15]
Мухи могут действовать как механические переносчики Токсокара, но большинство инфекций происходит без переносчика.[10] Большинство случаев токсокароза являются следствием прокариотических векторов экспрессии и их передачи через прямой физический контакт с фекалиями, что приводит к заражению.[25]
Морфология
Оба вида производят коричневые яйца без косточек.[11][18][19] Т. canis размер яиц 75-90 мкм и сферической формы, тогда как яйца Т. cati имеют диаметр 65-70 мкм и продолговатую форму.[3][18][19] Из этих яиц вылупляются личинки второй стадии, их длина составляет примерно 0,5 мм, а ширина 0,02 мм.[6] Взрослые особи обоих видов имеют полноценную пищеварительную систему и три губы, каждая из которых состоит из зубчатого гребня.[18][19]
Взрослый Т. canis встречаются только у собак и лисиц, а самцы имеют длину 4–6 см с загнутым задним концом.[5][18] У самцов есть спикулы и один «трубчатый семенник».[18] Женщины могут достигать 15 см в длину, при этом длина вульвы составляет одну треть их длины тела.[18] Самки на заднем конце не изгибаются.[5][18]
Т. cati Взрослые самки имеют длину примерно 10 см, а самцы обычно 6 см или меньше. В Т. cati взрослые особи встречаются только у кошек, а самцы Т. cati изогнуты на заднем конце.[19]
Жизненный цикл
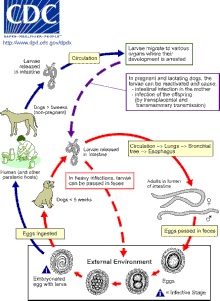
Кошки, собаки и лисы могут заразиться Токсокара в результате проглатывания яиц или передачи личинок от матери к ее потомству.[15][24] Передача кошкам и собакам также может происходить при попадании в организм зараженных случайных хозяев, таких как дождевые черви, тараканы, грызуны, кролики, куры или овцы.[3][10][19]
Яйца вылупляются как личинки второй стадии в кишечнике кошки, собаки или лисы-хозяина (для согласованности в этой статье предполагается, что личинки второй стадии появляются из Токсокара яйца, хотя ведутся споры о том, действительно ли личинки находятся на второй или третьей стадии развития).[5][10] Личинки попадают в кровоток и мигрируют в легкие, где их кашляют и проглатывают. Личинки созревают во взрослых особей в тонком кишечнике кошки, собаки или лисы, где происходит спаривание и откладка яиц.[10][12][15][18] Яйца выводятся с калом и становятся заразными только через три недели вне организма хозяина.[26] Во время этого инкубационного периода внутри яйца происходит линька личинки с первой стадии на вторую (и, возможно, третью).[10][19] У большинства взрослых собак, кошек и лисиц не происходит полного жизненного цикла, а вместо этого происходит энцистирование личинок второй стадии после периода миграции по телу. Реактивация личинок характерна только для беременных или кормящих кошек, собак и лисиц. Полный жизненный цикл обычно происходит только у этих самок и их потомства.[15][24]
Личинки второй стадии также вылупляются в тонком кишечнике случайного хозяина, например человека, после проглатывания инфекционных яиц.[27] Затем личинки мигрируют через органы и ткани случайного хозяина, чаще всего через легкие, печень, глаза и мозг.[28] Поскольку личинки L2 не могут созревать в случайных хозяевах, после этого периода миграции, Токсокара личинки инцистируются как личинки второй стадии.[3][6][15]
Диагностика
обнаружение Токсокара личинки внутри пациента - единственный окончательный диагноз токсокароза; однако биопсия для поиска личинок второй стадии у человека обычно не очень эффективна.[6][10] ПЦР, ELISA, и серологическое тестирование чаще используются для диагностики Токсокара инфекционное заболевание.[6][10] Серологические тесты зависят от количества личинок в организме пациента и, к сожалению, не очень специфичны.[10] ELISA намного надежнее и в настоящее время имеет чувствительность 78% и специфичность 90%.[29] В исследовании 2007 г. было объявлено об ИФА, специфичном для Toxocara canis, что минимизирует ложные срабатывания от перекрестных реакций с аналогичными круглыми червями и поможет определить, инфицирован ли пациент Т. canis или же Т. cati.[30] OLM часто диагностируется после клинического обследования.[29] Гранулемы можно найти по всему телу, и их можно визуализировать с помощью УЗИ, МРТ и КТ.[10]
Профилактика
Активное привлечение ветеринаров и владельцев домашних животных важно для контроля передачи Токсокара от домашних животных к людям. Группа, очень активно участвующая в продвижении сокращения инфекций у собак в Соединенных Штатах, - это Совет по паразитам животных-компаньонов - CAPC. Поскольку беременные или кормящие собаки и кошки и их потомство имеют наибольшую активную паразитарную нагрузку, этих животных следует включить в программу дегельминтизации.[7][10][15] Фекалии домашних животных следует собирать и утилизировать или закапывать в землю, поскольку они могут содержать Токсокара яйца.[7] Применение этой меры в общественных местах, таких как парки и пляжи, особенно важно для снижения передачи.[3][5] До 20% образцов почвы детских площадок в США обнаружили яйца аскариды.[22] Кроме того, песочницы следует накрывать, когда они не используются, чтобы кошки не использовали их в качестве туалетных лотков. Мытье рук перед едой и после игр с домашними животными, а также после работы с грязью снижает вероятность проглатывания Токсокара яйца.[3][7][10] Мытье всех фруктов и овощей, не пускать домашних животных в сад и тщательно готовить мясо также может предотвратить передачу инфекции.[10] Наконец, научите детей не класть в рот непродовольственные товары, особенно грязь, резко снизит вероятность заражения.[7]
Токсокароз был назван одной из забытых болезней бедности в США из-за его распространенности в Аппалачах, на юге США, в центральных городских районах и среди меньшинств.[31] К сожалению, в настоящее время вакцина отсутствует или находится в стадии разработки.[8][31] Однако митохондриальные геномы обоих Т. cati и Т. canis были недавно секвенированы, что может привести к прорыву в лечении и профилактике.[32]
Уход
Токсокароз часто проходит сам по себе, потому что Токсокара личинки не могут созревать внутри человека-хозяина.[3] Кортикостероиды назначают в тяжелых случаях VLM или если у пациента диагностирован OLM. Могут быть назначены альбендазол (предпочтительно) или мебендазол («терапия второй линии»).[3][6][12][29] Гранулемы можно удалить хирургическим путем, или для разрушения глазных гранулем можно использовать лазерную фотокоагуляцию и криоретинопексию.[10][12][29][33]
Висцеральный токсокароз у людей можно лечить противопаразитарными препаратами, такими как альбендазол или же мебендазол, тиабендазол или же диэтилкарбамазин обычно в сочетании с противовоспалительными препаратами. Использование стероидов дало некоторые положительные результаты. Антигельминтная терапия предназначена для тяжелых инфекций (легких, головного мозга), поскольку терапия может вызвать сильную воспалительную реакцию из-за массового уничтожения личинок. Лечение глазного токсокароза сложнее и обычно состоит из мер по предотвращению прогрессирующего повреждения глаза.[34]
Эпидемиология
Люди - случайные хозяева Токсокара, но токсокароз встречается во всем мире. Большинство случаев токсокароза встречается у людей в возрасте до двадцати лет.[8] Распространенность серотипа выше в развивающихся странах, но также может быть значительной и в странах первого мира.[10] На Бали, Сент-Люсии, Непале и других странах распространенность серотипа превышает пятьдесят процентов.[10] До 2007 года считалось, что серологическая распространенность среди детей в США составляла около 5%.[3] Однако Вон и др. обнаружил, что распространенность серотипа в США составляет 14% для населения в целом.[6][8] Во многих странах токсокароз считается очень редким явлением. Ежегодно в США регистрируется около 10000 клинических случаев, из которых десять процентов составляют OLM.[8][12] Необратимая потеря зрения происходит в 700 из этих случаев.[12]
Маленькие дети подвергаются наибольшему риску заражения, потому что они играют на улице и склонны класть зараженные предметы и грязь в рот.[3][5][10] Владение собакой - еще один известный фактор риска передачи.[5] Также существует значительная корреляция между высокими Токсокара титры антител и эпилепсия у детей.[3][35]
У людей отмечалась паразитарная нагрузка до 300 личинок на один грамм печени.[10] «Экскреторно-секреторные антигены личинок… высвобождающиеся из их внешней оболочки эпикутикулы [и]… легко отделяющиеся при связывании со специфическими антителами», вызывают иммунный ответ хозяина.[6] Считается, что переломный момент между развитием VLM и OLM составляет от 100 до 200 личинок.[10] Считается, что более легкая инфекция в OLM стимулирует более низкий иммунный ответ и способствует миграции личинки в глаз. Считается, что личинки попадают в глаз через зрительный нерв, центральную артерию сетчатки, короткие задние цилиарные артерии, мягкие ткани или спинномозговую жидкость.[10][12] Глазные гранулемы, которые образуются вокруг личинки, обычно находятся на периферии сетчатки или диска зрительного нерва.[12]
Висцеральная мигрирующая личинка, по-видимому, чаще поражает детей в возрасте 1–4 лет, в то время как мигрирующая глазная личинка чаще поражает детей в возрасте 7–8 лет. От 4,6% до 23% детей в США инфицированы яйцом собачьей аскариды. Это число намного выше в других частях мира, в странах с тропическим климатом серологическая распространенность достигает 80-90, например в Колумбии, где инфицировано до 81% детей.[22] [35] В западной части мира распространенность серотипа ниже - 35 - 42%.[35]
История
Вернер описал паразитическую нематоду у собак в 1782 году, которую он назвал Аскарида обыкновенная. Джонстон определил, что то, что описал Вернер, на самом деле было членом рода Токсокара основана Стайлзом в 1905 году. Фюллеборн предположил, что Т канис личинки могут вызывать гранулематозные узелки у человека. В 1947 году Perlingiero и Gyorgy описали первый случай, вероятно, токсокароза. Их пациентом был 2-летний мальчик из Флориды, у которого были классические симптомы и эзоинофильные некротические гранулемы.[2] В 1950 году Кэмпбелл-Уайлдер первым описал токсокароз у людей; она опубликовала статью, описывающую глазные гранулемы у пациентов с эндофтальмитом, болезнью Коута или псевдоглиомой. Два года спустя Бивер и др. опубликовал наличие Токсокара личинки в гранулемах, удаленных у пациентов с симптомами, аналогичными симптомам у пациентов с болезнью Уайлдера.[10][5] Опасность токсокароза впервые была поднята в Великобритании в 1970-х годах, что вызвало опасения в отношении общественного здравоохранения.[36]
Другие животные
Кошки
Некоторые методы лечения инфекции Toxocara cati включают препараты, предназначенные для частичного обезболивания взрослых червей и их отделения от слизистой оболочки кишечника, что позволяет им выводиться живыми с фекалиями. К таким лекарствам относятся: пиперазин и пирантел. Их часто сочетают с препаратом. празиквантел что, по-видимому, приводит к потере устойчивости червя к перевариванию животным-хозяином. Другие эффективные методы лечения включают: ивермектин, милбемицин, и селамектин.[37] Дихлофос также было доказано, что он эффективен как яд, хотя меры по его запрету из-за опасений по поводу его токсичности сделали его недоступным в некоторых регионах.
Однако лечение диких кошачьих для этого паразита затруднено, поскольку обнаружение - лучший способ определить, у кого есть паразит. Это может быть сложно, так как инфицированные виды трудно обнаружить. После обнаружения инфицированные люди должны быть удалены из популяции, чтобы снизить риск постоянного контакта с паразитами. Основным методом, который использовался для снижения количества инфекции, является удаление путем охоты. Удаление также может происходить через землевладельцев, как обнаружили Дэйр и Уоткинс (2012) в ходе своих исследований на пумах. И охотники, и землевладельцы могут предоставить образцы, которые могут быть использованы для обнаружения присутствия кошачьих аскарид в районе, а также для удаления их из популяции. Этот метод более практичен, чем введение лекарств диким популяциям, поскольку диких животных, как упоминалось ранее, труднее найти для оказания медицинской помощи.[нужна цитата]
Однако лекарственная помощь - это еще один метод, используемый в исследованиях аскариды; такие как эксперимент по борьбе с аскаридами енотов, проведенный Smyser et al. (2013), в котором они применили медицинскую травлю. Однако лекарства часто бывают дорогими, и успех приманки зависит от того, употребляют ли приманку инфицированные. Кроме того, проверка мест наживки может быть дорогостоящей (по времени и ресурсам). Удаление с помощью охоты позволяет агентствам снизить затраты и дает агентствам больше шансов удалить инфицированных людей.[нужна цитата]
Рекомендации
- ^ а б Ву Т, Боумен Д.Д. (2020). «Висцеральные мигрирующие личинки Toxocara canis и Toxocara cati у хозяев, отличных от собак и кошек». Достижения в паразитологии. Эльзевир. 109: 63–88. Дои:10.1016 / bs.apar.2020.02.001. ISBN 978-0-12-820958-5. PMID 32381221.
- ^ а б c d Марти А. (2000). «Токсокароз Глава 27». В Meyers WM, Neafie RC, Marty AM, Wear DJ (ред.). Патология инфекционных заболеваний. I: Гельминтозы. Вашингтон, округ Колумбия: Институт патологии вооруженных сил. С. 411–421. Архивировано из оригинал 27 декабря 2010 г.. Получено 20 ноября 2014.
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Икс у z аа ab Маркелл EK, Voge M (2006). Медицинская паразитология Маркелла и Фоге (9-е изд.). Сент-Луис: Сондерс Эльзевьер.
- ^ Шанц PM (апрель 1994 г.). «О червях, собаках и людях-хозяевах: постоянные проблемы для ветеринаров в предотвращении болезней человека». Журнал Американской ветеринарной медицинской ассоциации. 204 (7): 1023–8. PMID 8045801.
- ^ а б c d е ж грамм час я j Despommier D (апрель 2003 г.). «Токсокароз: клинические аспекты, эпидемиология, медицинская экология, молекулярные аспекты». Обзоры клинической микробиологии. 16 (2): 265–72. Дои:10.1128 / CMR.16.2.265-272.2003. ЧВК 153144. PMID 12692098.
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Токсокароз в eMedicine
- ^ а б c d е ж грамм час я j k л м «Информационный бюллетень: токсокароз». Отдел паразитарных болезней. Центры по контролю и профилактике заболеваний. Ноябрь 2007 г. В архиве из оригинала 27 марта 2011 г.. Получено 17 сентября 2017.
- ^ а б c d е «Результаты нового исследования CDC показывают, что инфекция Toxocara встречается чаще, чем считалось ранее» (PDF). Отдел паразитарных болезней. Центры по контролю и профилактике заболеваний. 19 января 2009 г. В архиве (PDF) из оригинала 10 марта 2010 г.. Получено 17 сентября 2017.
- ^ Сариего И., Канобана К., Рохас Л., Спейбрук Н., Полман К., Нуньес Ф.А. (28 февраля 2012 г.). Карабин Н (ред.). «Токсокароз на Кубе: обзор литературы». PLOS забытые тропические болезни. 6 (2): e1382. Дои:10.1371 / journal.pntd.0001382. ЧВК 3289590. PMID 22389726.
- ^ а б c d е ж грамм час я j k л м п о п q р s т ты v ш Икс у z аа ab ac объявление ае Холланд С., Смит Х.В., ред. (2006). Токсокара: загадочный паразит. Уоллингфорд, Великобритания и Кембридж, Массачусетс: CABI Publishing.
- ^ а б «Аскариды». Ветеринарное руководство Merck. Январь 2008. Архивировано с оригинал 26 мая 2011 г.
- ^ а б c d е ж грамм час я j «Токсокароз: мигранты глазной личинки». Обзор оптометрии в Интернете: руководство по лечению глазных заболеваний. Январь 2009 г. В архиве из оригинала 19 ноября 2011 г.. Получено 3 июля 2011.
- ^ Стюарт JM, Cubillan LD, Cunningham ET (декабрь 2005 г.). «Распространенность, клинические особенности и причины потери зрения среди пациентов с токсокарозом глаз». Retina (Филадельфия, Пенсильвания). 25 (8): 1005–13. Дои:10.1097/00006982-200512000-00009. PMID 16340531. S2CID 8659870.
- ^ Бассукас И.Д., Гайтанис Г., Зиога А., Бобоянни С., Стергиопулу С. (ноябрь 2008 г.). «Фебрильный» мигрирующий эозинофильный целлюлит с гепатоспленомегалией: токсокароз у взрослых - описание случая ». Журнал случаев. 1 (1): 356. Дои:10.1186/1757-1626-1-356. ЧВК 2621125. PMID 19038064.
- ^ а б c d е ж грамм час я j k л м «Рекомендации для ветеринаров: предотвращение зоонозной передачи аскарид и анкилостомов собак и кошек». Отдел паразитарных болезней. Центры по контролю и профилактике заболеваний. 27 сентября 2004 г. В архиве из оригинала 21 августа 2010 г.. Получено 17 сентября 2017.
- ^ Азам Д., Укпай О.М., Саид А., Абдаллах Г.А., Морган Э.Р. (февраль 2012 г.). «Температура, развитие и выживаемость инфекционных личинок Toxocara canis». Паразитологические исследования. 110 (2): 649–56. Дои:10.1007 / s00436-011-2536-8. PMID 21779864. S2CID 10075744.
- ^ а б c Гамбоа Мичиган (декабрь 2005 г.). «Влияние температуры и влажности на развитие яиц Toxocara canis в лабораторных условиях». Журнал гельминтологии. 79 (4): 327–31. Дои:10.1079 / JOH2005287. PMID 16336716. ProQuest 213503935.
- ^ а б c d е ж грамм час я j Харрис-Линтон М (январь 2001 г.). "Toxocara canis". Музей зоологии Мичиганского университета: Сеть разнообразия животных. В архиве из оригинала 1 мая 2010 г.. Получено 23 февраля 2009.
- ^ а б c d е ж грамм Соскольне Г (январь 2001 г.). "Toxocara cati". Музей зоологии Мичиганского университета: Сеть разнообразия животных. В архиве из оригинала 5 июня 2011 г.. Получено 17 января 2010.
- ^ Джонстон C (январь 2000 г.). «Немс-топики». Нематоды. Пенсильванский университет. В архиве из оригинала 16 февраля 2009 г.. Получено 23 февраля 2009.
- ^ а б c «Браузер таксономии». www.ncbi.nlm.nih.gov. Получено 14 января 2019.
- ^ а б c d Чепрасов А (2012). «Смерть на детской площадке». Журнал Гуру. 11: 59–61.
- ^ а б Fan CK, Holland CV, Loxton K, Barghouth U (июль 2015 г.). «Церебральный токсокароз: бесшумное развитие нейродегенеративных заболеваний?». Обзоры клинической микробиологии. 28 (3): 663–86. Дои:10.1128 / CMR.00106-14. ЧВК 4462679. PMID 26062575.
- ^ а б c d «Токсокароз». DPDx: паразиты и здоровье. Центры по контролю и профилактике заболеваний. 19 января 2009 г. В архиве из оригинала 13 мая 2006 г.. Получено 7 марта 2006.
- ^ Мохамад С., Азми, Северная Каролина, Нордин Р. (июнь 2009 г.). «Разработка и оценка чувствительного и специфического теста для диагностики токсокароза человека с использованием трех рекомбинантных антигенов (TES-26, TES-30USM и TES-120)». Журнал клинической микробиологии. 47 (6): 1712–7. Дои:10.1128 / JCM.00001-09. ЧВК 2691092. PMID 19369434.
- ^ Бесерил Флорес, Массачусетс (2019). Parasitología médica (Quinta edición ed.). Мексика. ISBN 978-1-4562-6784-1. OCLC 1117384861.
- ^ Ан SJ, Ryoo NK, Woo SJ (июль 2014 г.). «Глазной токсокароз: клиника, диагностика, лечение и профилактика». Аллергия в Азиатско-Тихоокеанском регионе. 4 (3): 134–41. Дои:10.5415 / apallergy.2014.4.3.134. ЧВК 4116038. PMID 25097848.
- ^ Ли Р.М., Мур Л. Б., Боттацци М. Е., Хотез П. Джей (август 2014 г.). «Токсокароз в Северной Америке: систематический обзор». PLOS забытые тропические болезни. 8 (8): e3116. Дои:10.1371 / journal.pntd.0003116. ЧВК 4148222. PMID 25166906.
- ^ а б c d Auweerter P (8 января 2008 г.). «Токсокароз». Центр информационных технологий в пунктах обслуживания: Руководство ABX. Джона Хопкинса.
- ^ Иддавела Р.Д., Раджапаксе Р.П., Перера Н.А., Агацума Т. (март 2007 г.). «Характеристика видоспецифического экскреторно-секреторного антигена Toxocara canis (TcES-57) и разработка двойного сэндвич-ELISA для диагностики висцеральной мигрирующей личинки». Корейский журнал паразитологии. 45 (1): 19–26. Дои:10.3347 / kjp.2007.45.1.19. ЧВК 2526337. PMID 17374974.
- ^ а б Hotez PJ (июнь 2008 г.). Брукер С (ред.). «Забытые инфекции бедности в Соединенных Штатах Америки». PLOS забытые тропические болезни. 2 (6): e256. Дои:10.1371 / journal.pntd.0000256. ЧВК 2430531. PMID 18575621.
- ^ Ли М.В., Линь Р.К., Штаб-квартира Сун, Ву XY, Чжу XQ (май 2008 г.). «Полные митохондриальные геномы трех видов токсокар, имеющих значение для здоровья человека и животных». BMC Genomics. 9: 224. Дои:10.1186/1471-2164-9-224. ЧВК 2396643. PMID 18482460.
- ^ Вернер Дж. К., Росс Р. Д., Грин В. Р., Уоттс Дж. К. (апрель 1999 г.). «Витрэктомия Pars plana и субретинальная хирургия при токсокарозе глаза». Архив офтальмологии. 117 (4): 532–4. Дои:10.1001 / archopht.117.4.532. PMID 10206586.
- ^ «Токсокароз». Паразиты. Центры по контролю и профилактике заболеваний, 10 января 2013 г. «CDC - Токсокароз - Лечение». 2 мая 2017. В архиве из оригинала 6 сентября 2017 г.. Получено 17 сентября 2017.. 22 апреля 2014 г.
- ^ а б c Луна Дж., Цицерон С.Э., Рато Дж., Кватрокки Дж., Марин Б., Бруно Е. и др. (Июль 2018). Флери А (ред.). «Обновленные доказательства связи между токсокарозом и эпилепсией: систематический обзор и метаанализ». PLOS забытые тропические болезни. 12 (7): e0006665. Дои:10.1371 / journal.pntd.0006665. ЧВК 6070292. PMID 30028858.
- ^ Пембертон Н. "Собачья грязь, отвращение и британская пропаганда здоровья 1970-х - боеприпасы разума". blogs.kent.ac.uk.
- ^ Боумен Д.Д., Хендрикс С.М., Линдси Д.С., Барр С.К. (2002). Клиническая паразитология кошек (Первое изд.). Эймс, Айова: Государственный университет Айовы. п. 275. ISBN 978-0-8138-0333-3. В архиве из оригинала 26 апреля 2018 г.
внешняя ссылка
- Информационная страница CDC на токсокароз.
- Круглые черви: кошки и котята из библиотеки здоровья домашних животных
- Круглые черви: собаки и щенки из библиотеки здоровья домашних животных
- Despommier D (апрель 2003 г.). «Токсокароз: клинические аспекты, эпидемиология, медицинская экология, молекулярные аспекты». Обзоры клинической микробиологии. 16 (2): 265–72. Дои:10.1128 / CMR.16.2.265-272.2003. ЧВК 153144. PMID 12692098.
- Рекомендации CAPC Аскариды
| Классификация | |
|---|---|
| Внешние ресурсы |