WikiDer > CTP-синтетаза - Википедия
CTP-синтаза является фермент участвует в биосинтез пиримидина что преобразует UTP и ОСАГО.[1][2]
Механизм реакции
CTP (цитидинтрифосфат) синтетаза катализирует последний коммитируемый этап биосинтеза пиримидиновых нуклеотидов:[3]
АТФ + УТФ + глутамин → АДФ + Фя + CTP + глутамат
Это фермент, ограничивающий скорость синтеза нуклеотидов цитозина как из de novo и пути спасения уридина.[4]
Реакция протекает путем АТФ-зависимого фосфорилирования UTP по 4-углеродному атому, в результате чего 4-углеродный электрофильный и уязвимы к реакции с аммиаком.[5] Источником аминогруппы в CTP является глутамин, который гидролизуется в домене глутамин амидотрансферазы с образованием аммиака. Затем он направляется через внутреннюю часть фермента в домен синтетазы.[6][7] Здесь аммиак реагирует с промежуточным 4-фосфорил UTP.[8]
Изоферменты
Два изоферменты с активностью CTP-синтазы существуют у человека, кодируются следующими генами:
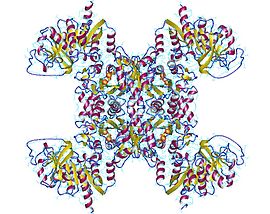
Структура
Активная CTP-синтаза существует как гомотетрамерный фермент. При низких концентрациях фермента и в отсутствие АТФ и УТФ CTP-синтаза существует в виде неактивного мономера. По мере увеличения концентрации фермента он сначала полимеризуется в димер (такой как форма, показанная слева), а в присутствии АТФ и УТФ образует тетрамер.[5][9]
Фермент содержит два основных домена, ответственных за активность аминотрансферазы и синтазы соответственно. Домены амидотрансферазы расположены вдали от границ раздела тетрамеров и на них не влияет олигомерное состояние. Сайт связывания АТФ и сайт связывания CTP в домене синтазы расположены на границе тетрамера. Именно по этой причине для тетрамеризации необходимы АТФ и УТФ.[10]
Регулирование
CTP-синтаза точно регулируется внутриклеточными концентрациями CTP и UTP, и как hCTPS1, так и hCTPS2, как было замечено, максимально активны при физиологических концентрациях ATP, GTP и глутамина.[11]
Было показано, что активность изофермента CTPS1 человека ингибируется фосфорилированием.[12] Одним из основных примеров этого является фосфорилирование остатка Ser-571 киназой 3 гликогенсинтазы (GSK3) в ответ на условия низкого содержания сыворотки.[13] Кроме того, было замечено, что Ser568 фосфорилируется казеинкиназой 1, ингибируя активность CTP-синтазы.[11]
ОСАГО также подлежит различным формам аллостерическая регуляция. GTP действует как аллостерический активатор, который сильно способствует гидролизу глутамина, но также ингибирует глутамин-зависимое образование CTP при высоких концентрациях.[14] Это помогает сбалансировать относительное количество пурин и пиримидин нуклеотиды. Продукт реакции CTP также служит аллостерическим ингибитором. Сайт связывания трифосфата перекрывается с сайтом связывания UTP, но нуклеозидный фрагмент CTP связывается в альтернативном кармане, противоположном сайту связывания для UTP.[15]
Было показано, что уровни CTP-синтазы зависят от уровней фактора транскрипции. Мой с. В свою очередь, активность CTP-синтазы необходима для фенотипов, связанных с Myc.[16]
В глутамин аналог ДОН также считается необратимым ингибитором и используется как противораковое средство.[17]
Нити
Сообщалось, что CTP-синтаза образует филаменты у нескольких различных организмов. К ним относятся бактерии (C. crescentus),[18] дрожжи (С. cerevisiae),[19] плодовые мошки (D. melanogaster)[20] и человеческие клетки.[21] Эти нитевидные структуры были названы цитоплазматическими стержнями и кольцами,[22] cytoophidia (от греческого «цито», что означает клетка, и «офидиум», что означает змея, из-за морфологии структур) или просто волокна CTP-синтазы. Было показано, что филаментация подавляет или усиливает активность CTP-синтазы в зависимости от вида.[23][24][25][26][27] В Дрозофила, только одна из изоформ CTP-синтазы образует филамент.[28] С момента открытия этого нового способа регуляции фермента в CTP-синтазе было показано, что множество других ферментов демонстрируют аналогичные характеристики, что позволяет предположить, что это важная и хорошо законсервированная стратегия ферментативной регуляции.[29] CTP-синтаза остается модельным ферментом для изучения образования филаментов.
Клиническое значение
Повышенная активность CTP-синтазы широко наблюдалась в опухолях человека и грызунов.[30]
Было замечено, что мутации в CTP-синтазе придают устойчивость к цитотоксическим препаратам, таким как цитозин арабинозид (ara-C) в Яичник китайского хомячка (CHO) клеточная модель лейкемии, хотя такие мутации не были обнаружены у людей с устойчивостью к ara-C.[31]
Смотрите также
Рекомендации
- ^ Либерман I (октябрь 1956 г.). «Ферментативное аминирование трифосфата уридина в трифосфат цитидина». Журнал биологической химии. 222 (2): 765–75. PMID 13367044.
- ^ Long CW, Левицки А., Кошланд Д.Е. (январь 1970 г.). «Субъединичная структура и субъединичные взаимодействия цитидинтрифосфатсинтетазы». Журнал биологической химии. 245 (1): 80–7. PMID 5411547.
- ^ Кошланд Д.Е., Левицки А. (1974). «CTP-синтетаза и родственные ферменты». В Boyer PD (ред.). Ферменты (3-е изд.). Нью-Йорк: Academic Press. С. 539–59. ISBN 978-0-12-122710-4.
- ^ ван Куйленбург А.Б., Майнсма Р., Врекен П., Уотерхэм Х.Р., ван Геннип А.Х. (2000). «Изоформы CTP синтетазы человека». Достижения экспериментальной медицины и биологии. 486: 257–61. Дои:10.1007/0-306-46843-3_50. ISBN 978-0-306-46515-4. PMID 11783495.
- ^ а б фон дер Зааль В., Андерсон П.М., Виллафранка Дж. Дж. (декабрь 1985 г.). «Механистические исследования цитидин-5'-трифосфатсинтетазы Escherichia coli. Обнаружение промежуточного продукта с помощью экспериментов по позиционному обмену изотопов». Журнал биологической химии. 260 (28): 14993–7. PMID 2933396.
- ^ Левицки А., Кошланд Д.Е. (август 1971 г.). «Цитидинтрифосфатсинтетаза. Ковалентные промежуточные соединения и механизмы действия». Биохимия. 10 (18): 3365–71. Дои:10.1021 / bi00794a008. PMID 4940761.
- ^ Эндриззи Дж.А., Ким Х., Андерсон П.М., Болдуин EP (июнь 2004 г.). «Кристаллическая структура цитидинтрифосфатсинтетазы Escherichia coli, нуклеотид-регулируемого слитого белка глутамин амидотрансфераза / АТФ-зависимая амидолигаза и гомолога мишеней противораковых и противопаразитарных лекарственных средств». Биохимия. 43 (21): 6447–63. Дои:10.1021 / bi0496945. ЧВК 2891762. PMID 15157079.
- ^ Льюис Д.А., Виллафранка Дж. Дж. (Октябрь 1989 г.). «Исследование механизма CTP синтетазы с использованием методов быстрого тушения и разделения изотопов». Биохимия. 28 (21): 8454–9. Дои:10.1021 / bi00447a027. PMID 2532543.
- ^ Андерсон PM (июнь 1983 г.). «CTP-синтетаза из Escherichia coli: улучшенная процедура очистки и характеристика эффектов гистерезиса и концентрации ферментов на кинетические свойства». Биохимия. 22 (13): 3285–92. Дои:10.1021 / bi00282a038. PMID 6349684.
- ^ Лауритсен И., Виллемоэс М., Йенсен К.Ф., Йоханссон Э., Харрис П. (февраль 2011 г.). «Структура димерной формы ЦТФ-синтазы Sulfolobus solfataricus». Acta Crystallographica Раздел F. 67 (Pt 2): 201–8. Дои:10.1107 / S1744309110052334. ЧВК 3034608. PMID 21301086.
- ^ а б Кассель К.М., Au DR, Хиггинс М.Дж., Хайнс М., Грейвс Л.М. (октябрь 2010 г.). «Регулирование цитидинтрифосфатсинтетазы 2 человека путем фосфорилирования». Журнал биологической химии. 285 (44): 33727–36. Дои:10.1074 / jbc.M110.178566. ЧВК 2962471. PMID 20739275.
- ^ Карман GM, Kersting MC (февраль 2004 г.). «Синтез фосфолипидов в дрожжах: регулирование фосфорилированием». Биохимия и клеточная биология. 82 (1): 62–70. Дои:10.1139 / o03-064. PMID 15052328.
- ^ Хиггинс MJ, Graves PR, Graves LM (октябрь 2007 г.). «Регулирование цитидинтрифосфатсинтетазы 1 человека с помощью киназы 3 гликогенсинтазы». Журнал биологической химии. 282 (40): 29493–503. Дои:10.1074 / jbc.M703948200. PMID 17681942.
- ^ Ланн Ф.А., Макдоннелл Дж. Э., Беарн С.Л. (январь 2008 г.). «Структурные требования для активации CTP-синтазы Escherichia coli аллостерическим эффекторным GTP строги, но требования к ингибированию слабые». Журнал биологической химии. 283 (4): 2010–20. Дои:10.1074 / jbc.M707803200. PMID 18003612.
- ^ Эндриззи Дж.А., Ким Х., Андерсон П.М., Болдуин EP (октябрь 2005 г.). «Механизмы регуляции обратной связи с продуктом и лекарственной устойчивости цитидинтрифосфатсинтетаз из структуры комплекса, ингибируемого ЦТФ». Биохимия. 44 (41): 13491–9. Дои:10.1021 / bi051282o. ЧВК 2891682. PMID 16216072.
- ^ Огхи Г. Н., Грайс С. Дж., Лю Дж. Л. (февраль 2016 г.). «Взаимодействие между Myc и CTP-синтазой у дрозофилы». PLOS Genetics. 12 (2): e1005867. Дои:10.1371 / journal.pgen.1005867. ЧВК 4759343. PMID 26889675.
- ^ Ахлувалия Г.С., Грем Дж.Л., Хао З., Куни Д.А. (1990). «Метаболизм и действие противораковых средств-аналогов аминокислот». Фармакология и терапия. 46 (2): 243–71. Дои:10.1016 / 0163-7258 (90) 90094-I. PMID 2108451.
- ^ Ингерсон-Махар М., Бригель А., Вернер Дж., Дженсен Дж. Дж., Gitai Z (август 2010 г.). «Метаболический фермент CTP-синтаза образует филаменты цитоскелета». Природа клеточной биологии. 12 (8): 739–46. Дои:10.1038 / ncb2087. ЧВК 3210567. PMID 20639870.
- ^ Нори С., Сато Б.К., Бройер Р.М., Вильгельм Дж. Э. (август 2010 г.). «Идентификация новых филамент-образующих белков у Saccharomyces cerevisiae и Drosophila melanogaster». Журнал клеточной биологии. 190 (4): 541–51. Дои:10.1083 / jcb.201003001. ЧВК 2928026. PMID 20713603.
- ^ Лю Дж. Л. (май 2010 г.). «Внутриклеточная компартментация CTP-синтазы у дрозофилы». Журнал генетики и геномики = И Чуань Сюэ Бао. 37 (5): 281–96. Дои:10.1016 / S1673-8527 (09) 60046-1. PMID 20513629.
- ^ Chen K, Zhang J, Tastan ÖY, Deussen ZA, Siswick MY, Liu JL (сентябрь 2011 г.). «Аналоги глутамина способствуют сборке цитоофидия в клетках человека и дрозофилы». Журнал генетики и геномики = И Чуань Сюэ Бао. 38 (9): 391–402. Дои:10.1016 / j.jgg.2011.08.004. PMID 21930098.
- ^ Каркамо В.С., Сато М., Касахара Х., Терада Н., Хамазаки Т., Чан Дж.Й., Яо Б., Тамайо С., Ковини Дж., Фон Мюлен К.А., Чан Е.К. (2011). «Индукция цитоплазматических палочек и кольцевых структур путем ингибирования пути синтеза CTP и GTP в клетках млекопитающих». PLOS ONE. 6 (12): e29690. Дои:10.1371 / journal.pone.0029690. ЧВК 3248424. PMID 22220215.
- ^ Линч Е.М., Хикс Д.Р., Шеперд М., Эндриззи Дж. А., Мейкер А., Хансен Дж. М., Барри Р. М., Гитай З., Болдуин Е. П., Коллман Дж. М. (июнь 2017 г.). «Структура филаментов CTP-синтазы человека показывает конформацию активного фермента». Структурная и молекулярная биология природы. 24 (6): 507–514. Дои:10.1038 / nsmb.3407. ЧВК 5472220. PMID 28459447.
- ^ Барри RM, Bitbol AF, Lorestani A, Charles EJ, Habrian CH, Hansen JM, Li HJ, Baldwin EP, Wingreen NS, Kollman JM, Gitai Z (июль 2014 г.). «Крупномасштабное образование филаментов подавляет активность CTP-синтетазы». eLife. 3: e03638. Дои:10.7554 / eLife.03638. ЧВК 4126345. PMID 25030911.
- ^ Огхей Г.Н., Грайс С.Дж., Шен К.Дж., Сюй Й., Чанг К.С., Аззам Дж., Ван П.Й., Фриман-Миллс Л., Пай Л.М., Сунг Л.Й., Ян Дж., Лю Д.Л. (октябрь 2014 г.). «Синтез нуклеотидов регулируется образованием цитоофидия в процессе развития нервной системы и адаптивного метаболизма». Биология Открыть. 3 (11): 1045–56. Дои:10.1242 / bio.201410165. ЧВК 4232762. PMID 25326513.
- ^ Нори С., Монфорт Е., Шиау А. К., Вильгельм Дж. Э. (август 2014 г.). «Общий регуляторный контроль активности фермента CTP-синтазы и образования филаментов». Молекулярная биология клетки. 25 (15): 2282–90. Дои:10.1091 / mbc.E14-04-0912. ЧВК 4116302. PMID 24920825.
- ^ Барри Р.М., Gitai Z (декабрь 2011 г.). «Самособирающиеся ферменты и происхождение цитоскелета». Текущее мнение в микробиологии. 14 (6): 704–11. Дои:10.1016 / j.mib.2011.09.015. ЧВК 3234109. PMID 22014508.
- ^ Аззам Дж., Лю Дж. Л. (февраль 2013 г.). «Только одна изоформа CTP-синтазы Drosophila melanogaster образует цитоофидий». PLOS Genetics. 9 (2): e1003256. Дои:10.1371 / journal.pgen.1003256. ЧВК 3573105. PMID 23459760.
- ^ Огхи Г. Н., Лю Дж. Л. (2015). «Метаболическая регуляция посредством ферментативной филаментации». Критические обзоры в биохимии и молекулярной биологии. 51 (4): 282–93. Дои:10.3109/10409238.2016.1172555. ЧВК 4915340. PMID 27098510.
- ^ Кизаки Х., Уильямс Дж. С., Моррис Х. П., Вебер Дж. (Ноябрь 1980 г.). «Повышенная активность цитидин-5'-трифосфатсинтетазы в опухолях крыс и человека». Исследования рака. 40 (11): 3921–7. PMID 7471043.
- ^ Уилан Дж., Смит Т., Феар Дж., Рохатинер А., Листер А., Меут М. (февраль 1994 г.). «Устойчивость к цитозинарабинозиду при остром лейкозе: значение мутаций в CTP-синтетазе». Лейкемия. 8 (2): 264–5. PMID 8309250.
дальнейшее чтение
внешняя ссылка
- CTP + синтетаза в Национальной медицинской библиотеке США Рубрики медицинской тематики (MeSH)