WikiDer > Открытие и разработка ингибиторов NS5A
Неструктурный белок 5А (NS5A) ингибиторы являются противовирусными агентами прямого действия (DAA), которые нацелены на вирусные белки, и их развитие стало кульминацией более глубокого понимания вирусный жизненный цикл в сочетании с достижениями в технологии открытия лекарств.[1][2] Однако их механизм действия сложен и до конца не изучен.[2] Ингибиторы NS5A были в центре внимания, когда они появились как часть первого лечебного средства для лечения вирус гепатита С (ВГС) в 2014 г.[3] Благоприятные характеристики были внесены в результате различных структурных изменений, и структурное сходство между клинически одобренными ингибиторами NS5A очевидно.[4][5] Несмотря на недавнее внедрение множества новых противовирусных препаратов, сопротивление по-прежнему вызывает беспокойство, и поэтому эти ингибиторы всегда используются в сочетание с другими препаратами.[6][7]
Вирус гепатита с
ВГС - это одноцепочечный РНК-вирус с положительным смыслом это было продемонстрировано в гепатоциты как людей, так и шимпанзе. Один полипротеин HCV транслируется, а затем расщепляется клеточными и вирусными протеазы на три структурные белки (ядро, E1 и E2) и семь неструктурные белки (стр. 7, NS2, NS3, NS4A, NS4B, NS5A и NS5B).[8][9]
ВГС является одной из ведущих причин болезнь печени во всем мире. Он передается через кровь и чаще всего передается при использовании инфицированных игл.[10] Пациенты, страдающие хронической инфекцией ВГС, подвергаются значительному риску цирроз и гепатоцеллюлярная карцинома, которые являются основными причинами смерти инфицированных.[11][12]
Вирус существует уже более тысячелетия, и его можно разделить на шесть известных генотипы, каждый из которых содержит множество подтипов. Седьмой остается не охарактеризованным. Контрактный генотип определяет, какие конкретные методы лечения являются жизнеспособными.[13]
Рецептор NS5A
Основная структура и химические свойства
NS5A - это большой гидрофильный фосфопротеин это важно для жизненного цикла ВГС и обнаруживается в ассоциации с индуцированными вирусом мембранными везикулами, называемыми мембранной сеткой.[14][15] NS5A - это белок, богатый пролином состоит примерно из 447 аминокислоты, который разделен на три домена.[16][17] Эти домены связаны двумя последовательностями низкой сложности, которые либо серин или же пролин-богатые.[18] Домен I - это цинк-связывающий домен и исследования рентгеновской кристаллографии показали альтернативные димерные конформации домена I NS5A.[19][20][21] Домены II и III неструктурированы, как показывают исследования ЯМР.[16][22] Домену I предшествует N-концевой амфипатический спираль что позволяет белку связываться с эндоплазматический ретикулум-производные мембраны.[22][23][24] Хотя рентгеноструктурные исследования выявили димерные конформации домена NS5A 1, недавние исследования структурных характеристик растворов показали, что белки NS5A образуют структуры более высокого порядка с помощью димерных субъединиц домена 1 NS5A. [25] Более того, общая структурная модель NS5A подчеркивает вариабельность внутренних конформаций доменов D2 и D3 между генотипами HCV.[26] Таким образом, до сих пор ведутся дискуссии о том, какая конформация NS5A является функциональной и на которую нацелены ингибиторы NS5A.
NS5A в основном существует в двух различных фосфорилированный формы, гипофосфорилированная и гиперфосфорилированный формы, но точная функция фосфорилирования не была определена.[17][18][27]
Функция
Белок NS5A играет важную роль в репликация вирусной РНК, сборка вирусов и сложные взаимодействия с клеточными функциями.[2][17] Белок участвует в модуляции защиты хозяина, апоптоз, то клеточный цикл, и стрессоустойчивые пути.[27] Однако его функция и полная структура еще предстоит выяснить.[16]
NS5A, по-видимому, является ключевым в запуске образования мембранной сети в отсутствие др. Сходных неструктурных белков.[15] NS5A может влиять на многие белки в клетке-хозяине, например фосфатидилинозитол-4-киназа IIIα (PI4KIIIα), а киназа требуется для репликации HCV. Эта киназа участвует в биосинтез из фосфатидилинозитол 4-фосфат (PI4P) путем взаимодействия с NS5A, который стимулирует его активность и, по-видимому, улучшает целостность перепончатой сети.[15][28][29]
Недавно центральная роль NS5A в распространении вирусов сделала его мишенью для разработка лекарств. В результате были внедрены новые противовирусные препараты для лечения ВГС.[2]
Механизм действия
Ингибиторы NS5A были разработаны для нацеливания на белок NS5A. Эти ингибиторы привели к значительному снижению уровня РНК HCV в крови и поэтому могут рассматриваться как мощные противовирусные препараты. Считается, что их механизм действия разнообразен, но точный механизм до конца не изучен.[2][30] Большинство исследований предполагает, что ингибиторы NS5A действуют на двух основных стадиях жизненного цикла ВГС; репликация геномной РНК и сборка вирионов. Другие исследования предлагают изменение факторов клетки-хозяина как возможный третий механизм.[2][15][31]

В структуре ингибиторов NS5A характерны димерные симметрия. Это говорит о том, что ингибиторы NS5A действуют на димеры NS5A.[32] Ряд модельных исследований показал, что даклатасвир, который является ингибитором NS5A, связывается только с димером NS5A «спина к спине», и это связывание должно быть симметричным. Другие исследования моделирования показали, что связывание с другими конформациями NS5A возможно, а также асимметричный привязка.[30] Исследования показали, что мишенью даклатасвира, скорее всего, является домен I NS5A.[31] Несмотря на то, что механизм до конца не изучен, было продемонстрировано, что ингибиторы подавлять Гиперфосфорилирование NS5A, приводящее к подавлению репликации HCV и его процессинга полипротеинов, а также приводящее к необычному расположению белка.[31][33] До сих пор считалось, что для этого ингибирования требуется только домен I NS5A, но не домены II и III.[33] Однако недавние исследования показали, что оба домена I и II имеют отношение к этому нарушению репликации РНК.[34]
Ингибиторы NS5A, по-видимому, также нарушают образование новых комплексов репликазы, что приводит к постепенному замедлению синтеза вирусной РНК. Воздействие на ранее образованные комплексы еще предстоит продемонстрировать.[34][35]
Имеющиеся данные свидетельствуют о том, что ингибиторы NS5A изменяют расположение NS5A внутри клетки. Это может вызвать ненормальную сборку, что приведет к появлению уродливых вирусов.[2] Некоторые исследования показали, что ингибирование сборки вируса играет более важную роль в снижении РНК, чем снижение репликации вируса.[35][36]
Исследования показали, что ингибиторы NS5A блокируют образование мембранной сети, которая защищает вирусную геном и содержит основные сайты для репликации и сборки вирусов.[15][31][37] Считается, что этот механизм не зависит от репликации РНК, но, по-видимому, на него влияют ингибиторы NS5A, блокирующие образование комплекса PI4KIIIα-NS5A, необходимого для синтеза PI4P, что приводит к снижению целостности мембранной сети и, следовательно, к снижению РНК HCV. репликация.[15][28][38]
История
В последние годы исследования ВГС достигли больших успехов благодаря открытию и клинической разработке множества новых лекарств от ВГС. К таким лекарствам относятся ПППД, в состав которых входят ингибиторы NS5A.[39]Было обнаружено, что ингибиторы NS5A особенно эффективны при лечении HCV, когда они использовались в сочетании с другими ингибиторами протеазы, такими как ингибиторы NS5B (например, софосбувир), пегилированные интерфероны (например. пегинтерферон альфа-2а) и рибонуклеиновые аналоги (например, рибавирин).[40][41][42] Постоянно существующий риск вирусного напряжения развивающийся сопротивление был основным фактором, почему они используются в комбинации с одним или несколькими дополнительными лекарствами.[43]
Побочные эффекты, а также обширные и сложные схемы приема лекарств с сопутствующими низкими показателями соблюдения режима лечения были препятствием для разработки противовирусных препаратов. Комбинация ингибиторов NS5A и NS5B дала положительные результаты в этом отношении.[44]
Открытие и разработка лекарств
Открытие

Открытие ингибиторов NS5A имело место в контексте стремления к лечению HCV. NS5A является одним из семи неструктурных белков, которые образуют комплекс с вирусной РНК в инфицированных клетках, чтобы инициировать репликацию HCV.[45] Исследования HCV позволили получить несколько ПППД, включая ингибиторы NS3A, NS4A и NS5B, а также ингибиторы NS5A.[46]
Разработка
Разработка противовирусных препаратов, способных вмешиваться в белки, ответственные за репликацию вирусов, была тесно связана с достижениями в методах создания эффективных культура клеток системы, необходимые для экран для них.[46]
В 1999 году произошел прорыв, когда консенсусный геном полной длины клонированный из РНК ВГС реплицируется на высоком уровне, когда трансфицированный в гепатому человека клеточная линия.[47] С тех пор этот метод был усовершенствован за счет использования адаптивных мутаций в культуре клеток, которые усиливают репликацию РНК.[48]
В результате скрининга был получен ряд ингибиторов NS5A, которые были включены в лечение ВГС. Первым в этом новом классе препаратов стал даклатасвир, получивший FDA утверждение в 2015 году.[49] С тех пор были одобрены и другие препараты, в том числе ледипасвир, которые вместе с софосбувиром входят в состав препарата против ВГС Харвони.[50][51]
Хотя ингибиторы NS5A доказали свою эффективность в качестве противовирусных препаратов, их следует использовать вместе с дополнительными противовирусными препаратами из-за того, как быстро они приводят к развитию устойчивые мутации когда предоставляется как единый агент.[52] Это сформировало фокус разработки ингибитора NS5A, из которого асимметричные варианты метаболизировать в аналоги с дополнительными профилями устойчивости, среди других открытий.[53]
Связь структура-деятельность
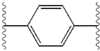
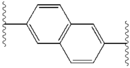
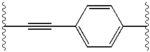
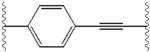
Структурное сходство между ингибиторами очевидно.[4] Придатки центрального ядра обычно симметричны и имеют имидазол-пролиновая структура.[5] Естественный L-конфигурация пролина производные оказался критически важным для торможения, поскольку неестественный D-конфигурация была резко более слабая активность. В потенция ингибиторов соответственно была чувствительна к изменению амин укупорочный элемент. Эти наблюдения предполагают, что аминная область молекулы играет важную роль в тормозной активности.[54]
Благоприятные характеристики ингибитора NS5A включают высокую эффективность и длительную плазменную активность. период полураспада для достижения дозировки один раз в день. Было обнаружено, что слегка асимметричные придатки, как у ледипасвира, имеют отличительные преимущества для оптимизации эффективности ингибитора и фармакокинетика.[50] Структура центрального ядра изменяет расстояние и проекцию придатков, а также положение липофильность в центральном ядре, что заметно влияет на ингибирующую активность. Структуры со слитыми центральными кольцами последовательно демонстрируют большую ингибирующую активность, тогда как менее липофильные центральные ядра обеспечивают более слабую активность.[4] Симметричные бис-имидазольные структуры, такие как даклатасвир, теряют эффективность при флуорен является заменен для биарил группа. Эта замена также порождает серьезные проблемы со стабильностью.[50][55] Однако липофильный соединитель меньшего размера, такой как дифторметилен, генерирует наиболее мощный ингибитор в асимметричной структуре. Кроме того, он обеспечивает улучшенный биодоступность и более благоприятный период полувыведения из плазмы. Также наблюдается заметное повышение потенции, когда фенил заменяется на нафтил как центральное ядро. Это увеличение значительно выше в асимметричной структуре, чем в симметричной.[50][54] В асимметричных структурах разница в эффективности между фенил-алкин ингибиторы демонстрируют важность положения о липофильности. Алкин, расположенный в центре, который является менее липофильным соединителем, чем фенил, улучшает потенцию.[4][5][50]
| Структура | Мероприятия | |
|---|---|---|
| Икс | IC50 (нМ) | Тормозная активность |
| >44 | Никто | |
| >44 | Никто | |
| 11 | Очень слаб | |
| 1.7 | Слабый | |
| 0.50 | Умеренный | |
| 3.7 | Слабый | |
| 0.11 | Умеренный | |
| 0.20 | Умеренный | |
| Структура | Мероприятия | |
|---|---|---|
| Икс | IC50 (нМ) | Тормозная активность |
| >44 | Никто | |
| 0.071 | Умеренный | |
| 2.5 | Слабый | |
| 0.38 | Умеренный | |
| 0.20 | Умеренный | |
| 0.17 | Умеренный | |
| 0.040 | Сильный | |
| Структура | Мероприятия | |
|---|---|---|
| Икс | IC50 (нМ) | Тормозная активность |
| CH2 | 0.094 | Сильный |
| CO | 0.30 | Умеренный |
| C (CH3)2 | 1.2 | Слабый |
Сопротивление
Возможная резистентность ВГС к препаратам ПППД вызывает беспокойство.[6] Среди ВГС квазивиды Существуют уже существующие варианты, способные придать устойчивость к ингибиторам NS5A без какого-либо предшествующего воздействия этих препаратов. Как правило, воспроизведение этих вариантов происходит только в незначительных количествах, что делает их необнаружимыми с помощью современных методов. С другой стороны, можно избирательно выращивать иммунные варианты в присутствии ингибиторов NS5A.[2] Устойчивость к ВГС характеризуется определенной закономерностью бегства. Этот паттерн часто связан с аминокислотными заменами, которые придают вирусу устойчивую лекарственную устойчивость без ухудшения приспособленности вируса.[2][56] Было установлено, что ингибиторы NS5A обладают относительно низким порогом устойчивости, и было показано, что варианты, которые связаны с устойчивостью к NS5A, сохраняются у пациентов до шести месяцев после прекращения лечения.[57] Следовательно, комбинированная терапия дает более высокую эффективность и более короткие периоды лечения.[7]
Будущие исследования и новые поколения ингибиторов NS5A
В ближайшие годы разработчики DAA столкнутся с предсказуемыми проблемами. Терапевтические пробелы для людей, страдающих такими осложнениями, как хроническая болезнь почек и цирроз необходимо будет устранить. Более короткие методы лечения с более легкими побочными эффектами позволят добиться большей приверженности, и нависает вездесущий призрак лекарственной устойчивости. Высокоадаптивный ВГС превратился в ряд различных геномов, которые все нуждаются в адекватном лечении, предпочтительно с использованием пангенотипических схем.[58]
Для некоторых из этих проблем уже есть возможные решения. Ингибитор протеазы ABT-493 и ингибитор NS5A следующего поколения ABT-530 считаются активными против всех генотипов HCV, включая трудно поддающийся лечению генотип 3.[42][58] In vitro ABT-530 продемонстрировал эффективность в отношении вариантов, связанных с устойчивостью, которые невосприимчивы к первым поколениям ингибиторов NS5A, включая ледипасвир, даклатасвир и омбитасвир.[42] Потому что это комбинация лекарств обладает дополнительным качеством очистки от печени, он обещает, что пациенты, страдающие хроническим заболеванием почек и гепатитом С, в ближайшем будущем смогут получить безопасное лечение, не основанное на софосбувире.[58]
По крайней мере, три комбинации препаратов для лечения ВГС находятся в стадии разработки, которые будут одобрены в 2016-2017 годах: Софосбувир в сочетании с Велпатасвир, ABT-493 в сочетании с ABT-530, и гразопревир в комбинации с Эльбасвир, из которых велпатасвир, ABT-530 и элбасвир являются ингибиторами NS5A.[7]
Смотрите также
Рекомендации
- ^ Gogela, Neliswa A .; Lin, Ming V .; Wisocky, Jessica L .; Чанг, Раймонд Т. (12 марта 2015 г.). «Улучшение нашего понимания современных методов лечения вируса гепатита С (ВГС)». Текущие отчеты о ВИЧ / СПИДе. 12 (1): 68–78. Дои:10.1007 / s11904-014-0243-7. ЧВК 4373591. PMID 25761432.
- ^ а б c d е ж грамм час я Павлоцкий, Жан-Мишель (август 2013 г.). «Ингибиторы NS5A в лечении гепатита С». Журнал гепатологии. 59 (2): 375–382. Дои:10.1016 / j.jhep.2013.03.030. PMID 23567084.
- ^ Делай, Альберт; Миттал, Яш; Лиапакис, ЭннМэри; Коэн, Элизабет; Чау, Хонг; Бертуччо, Клаудиа; Сапир, Дана; Райт, Джессика; Эггерс, Кэрол; Дрозд, Кристина; Чиарлеглио, Мария; Дэн, Яньхун; Lim, Joseph K .; Джавери, Рави (27 августа 2015 г.). «Разрешение на использование препарата Софосбувир / Ледипасвир (Харвони) для лечения хронической инфекции ВГС в реальной когорте: новый барьер в каскаде лечения ВГС». PLOS ONE. 10 (8): e0135645. Дои:10.1371 / journal.pone.0135645. ЧВК 4552165. PMID 26312999.
- ^ а б c d е ж грамм час Тонг, Линг; Ю, Вэньшэн; Coburn, Craig A .; Meinke, Peter T .; Nair, Anilkumar G .; Дуайер, Майкл П .; Чен, Лэй; Селютин Олег; Розенблюм, Стюарт Б .; Цзян, Юэхэн; Феллс, Джеймс; Ху, Бин; Чжун, Бин; Soll, Ричард М .; Лю, Ронг; Агравал, Sony; Ся, Эллен; Чжай, Инь; Конг, Ронг; Ингравалло, Пол; Номейр, Амин; Асанте-Аппиа, Эрнест; Козловский, Джозеф А. (июль 2016 г.). «Альтернативная основная разработка вокруг класса тетрациклических индолов ингибиторов NS5A HCV». Письма по биоорганической и медицинской химии. 26 (20): 5132–5137. Дои:10.1016 / j.bmcl.2016.07.057. PMID 27634194.
- ^ а б c Lemm, J. A .; Leet, J. E .; О'Бойл, Д. Р .; Romine, J. L .; Хуанг, X. S .; Schroeder, D. R .; Alberts, J .; Cantone, J. L .; Sun, J.-H .; Nower, P.T .; Martin, S.W .; Серрано-Ву, М. Х .; Мэнвелл, Н. А .; Снайдер, Л. Б .; Гао, М. (16 мая 2011 г.). «Открытие мощных ингибиторов NS5A вируса гепатита С с димерными структурами». Противомикробные препараты и химиотерапия. 55 (8): 3795–3802. Дои:10.1128 / AAC.00146-11. ЧВК 3147613. PMID 21576451.
- ^ а б Fridell, R.A .; Qiu, D .; Wang, C .; Валера, Л .; Гао, М. (28 июня 2010 г.). "Анализ устойчивости к ингибитору NS5A вируса гепатита C BMS-790052 в репликонной системе in vitro". Противомикробные препараты и химиотерапия. 54 (9): 3641–3650. Дои:10.1128 / AAC.00556-10. ЧВК 2935007. PMID 20585111.
- ^ а б c Ассела, Тарик; Бойер, Натали; Саадун, Давид; Мартино-Пенью, Мишель; Марселлин, Патрик (январь 2016 г.). «Противовирусные препараты прямого действия для лечения инфекции, вызванной вирусом гепатита С: оптимизация текущего лечения без IFN и перспективы на будущее». Liver International. 36: 47–57. Дои:10.1111 / liv.13027. PMID 26725897.
- ^ Холлидей, Джон; Кленерман, Пол; Барнс, Элеонора (9 января 2014 г.). «Вакцинация от вируса гепатита С: приближаться к уклончивой цели». Экспертный обзор вакцин. 10 (5): 659–672. Дои:10.1586 / erv.11.55. ЧВК 3112461. PMID 21604986.
- ^ Гракуи, А; Wychowski, C; Lin, C; Feinstone, S M; Райс, С. М. (1 марта 1993 г.). «Экспрессия и идентификация продуктов расщепления полипротеинов вируса гепатита С». Журнал вирусологии. 67 (3): 1385–1395. Дои:10.1128 / JVI.67.3.1385-1395.1993. ISSN 0022-538X. ЧВК 237508. PMID 7679746.
- ^ Чан, Джулиана (май 2014 г.). "Гепатит С". Болезнь месяца. 60 (5): 201–212. Дои:10.1016 / j.disamonth.2014.04.002. PMID 24863270.
- ^ Сефф, Леонард Б. (ноябрь 2002 г.). «Естественная история хронического гепатита С». Гепатология. 36 (5): s35 – s46. Дои:10.1053 / jhep.2002.36806. PMID 12407575.
- ^ Лян, Т. Джейк; Рехерманн, Барбара; Seeff, Леонард Б .; Хуфнэгл, Джей Х. (15 февраля 2000 г.). «Патогенез, естествознание, лечение и профилактика гепатита С». Анналы внутренней медицины. 132 (4): 296–305. Дои:10.7326/0003-4819-132-4-200002150-00008. PMID 10681285.
- ^ Pybus, O.G .; Barnes, E .; Taggart, R .; Lemey, P .; Марков, П. В .; Расачак, Б .; Syhavong, B .; Phetsouvanah, R .; Sheridan, I .; Humphreys, I.S .; Lu, L .; Newton, P.N .; Кленерман, П. (29 октября 2008 г.). «Генетическая история вируса гепатита С в Восточной Азии». Журнал вирусологии. 83 (2): 1071–1082. Дои:10.1128 / JVI.01501-08. ЧВК 2612398. PMID 18971279.
- ^ Tellinghuisen, T. L .; Foss, K. L .; Treadaway, J.C .; Райс, К. М. (21 ноября 2007 г.). «Идентификация остатков, необходимых для репликации РНК в доменах II и III белка NS5A вируса гепатита С». Журнал вирусологии. 82 (3): 1073–1083. Дои:10.1128 / JVI.00328-07. ЧВК 2224455. PMID 18032500.
- ^ а б c d е ж Регеллин, В .; Donnici, L .; Fenu, S .; Берно, В .; Calabrese, V .; Pagani, M .; Abrignani, S .; Peri, F .; De Francesco, R .; Неддерманн, П. (15 сентября 2014 г.). «Ингибиторы NS5A нарушают образование комплекса NS5A-фосфатидилинозитол-4-киназы III и вызывают снижение уровней фосфатидилинозитол-4-фосфата и холестерина в мембранах, связанных с вирусом гепатита С». Противомикробные препараты и химиотерапия. 58 (12): 7128–7140. Дои:10.1128 / AAC.03293-14. ЧВК 4249536. PMID 25224012.
- ^ а б c Ямасаки, Лилиан Х.Т .; Аркури, Хелен А; Жардим, Ана Каролина Дж.; Биттар, Синтия; де Карвалью-Мелло, Изабель Мария В.Г. Рахал, Паула (2012). «Новые идеи относительно структуры / функции HCV-NS5A и индикации генотипических различий». Журнал вирусологии. 9 (1): 14. Дои:10.1186 / 1743-422X-9-14. ЧВК 3271958. PMID 22239820.
- ^ а б c Masaki, T .; Matsunaga, S .; Takahashi, H .; Накашима, К .; Kimura, Y .; Ито, М .; Matsuda, M .; Мураяма, А .; Като, Т .; Hirano, H .; Endo, Y .; Lemon, S.M .; Wakita, T .; Sawasaki, T .; Сузуки, Т. (23 апреля 2014 г.). «Участие гиперфосфорилирования NS5A вируса гепатита С, опосредованного казеинкиназой I- в производстве инфекционных вирусов». Журнал вирусологии. 88 (13): 7541–7555. Дои:10.1128 / JVI.03170-13. ЧВК 4054430. PMID 24760886.
- ^ а б Ross-Thriepland, D .; Харрис, М. (20 ноября 2013 г.). "Взгляд на сложность и функциональность фосфорилирования NS5A вируса гепатита С". Журнал вирусологии. 88 (3): 1421–1432. Дои:10.1128 / JVI.03017-13. ЧВК 3911623. PMID 24257600.
- ^ Райс, Чарльз М .; Маркотриджано, Джозеф; Теллингхейсен, Тимоти Л. (май 2005 г.). «Структура цинк-связывающего домена важнейшего компонента репликазы вируса гепатита С». Природа. 435 (7040): 374–379. Дои:10.1038 / природа03580. ISSN 1476-4687. ЧВК 1440517. PMID 15902263.
- ^ Cronin, Ciarán N .; Уэллс, Питер А .; Хики, Майкл Дж .; Бродский, Олег; С любовью, Роберт А. (2009-05-01). «Кристаллическая структура новой димерной формы белка домена I NS5A вируса гепатита С». Журнал вирусологии. 83 (9): 4395–4403. Дои:10.1128 / JVI.02352-08. ISSN 1098-5514. ЧВК 2668466. PMID 19244328.
- ^ Ламберт, Себастьян М .; Лэнгли, Дэвид Р .; Гарнетт, Джеймс А .; Энджелл, Ричард; Хеджеторн, Кэти; Мэнвелл, Николас А .; Мэтьюз, Стив Дж. (01.06.2014). «Кристаллическая структура домена 1 NS5A генотипа 1a раскрывает новые ключи к разгадке механизма действия димерных ингибиторов HCV». Белковая наука. 23 (6): 723–734. Дои:10.1002 / pro.2456. ISSN 1469-896X. ЧВК 4093949. PMID 24639329.
- ^ а б Foster, T. L .; Беляева, Т .; Стоунхаус, Н. Дж.; Пирсон, А. Р .; Харрис, М. (30 июня 2010 г.). «Все три домена неструктурного белка NS5A вируса гепатита С способствуют связыванию РНК». Журнал вирусологии. 84 (18): 9267–9277. Дои:10.1128 / JVI.00616-10. ЧВК 2937630. PMID 20592076.
- ^ Fridell, R.A .; Qiu, D .; Валера, Л .; Wang, C .; Rose, R.E .; Гао, М. (18 мая 2011 г.). «Отличительные функции NS5A в репликации РНК вируса гепатита C, обнаруженные в исследованиях с ингибитором NS5A BMS-790052». Журнал вирусологии. 85 (14): 7312–7320. Дои:10.1128 / JVI.00253-11. ЧВК 3126594. PMID 21593143.
- ^ а б Ашер, Дэвид Б .; Виленс, Джером; Неро, Трейси Л .; Даути, Лариса; Мортон, Крейг Дж .; Паркер, Майкл В. (23 апреля 2014 г.). «Мощные ингибиторы гепатита С напрямую связываются с NS5A и снижают его сродство к РНК». Научные отчеты. 4: 4765. Дои:10.1038 / srep04765. ЧВК 3996483. PMID 24755925.
- ^ Белдар, Серап; Манимекалай, Малати Сони Субраманиан; Чо, Нам-Джун; Пэк, Кванхи; Грюбер, Герхард; Юн, Хо Суп (2018). «Самоассоциация и конформационные вариации домена 1 NS5A вируса гепатита С». Журнал общей вирусологии. 99 (2): 194–208. Дои:10.1099 / jgv.0.001000. PMID 29300159.
- ^ Бадилло, Орели; Receveur-Brechot, Véronique; Сарразен, Стефан; Кантрелль, Франсуа-Ксавье; Делольм, Фредерик; Фогерон, Мари-Лор; Молл, Дженнифер; Монтсеррет, Роланд; Бокманн, Аня (07.06.2017). «Общая структурная модель белка NS5A из вируса гепатита С и модуляция с помощью мутаций, придающих устойчивость к репликации вируса циклоспорину А». Биохимия. 56 (24): 3029–3048. Дои:10.1021 / acs.biochem.7b00212. PMID 28535337.
- ^ а б Сюн, Вэй; Ян, Цзе; Ван, Минчжэнь; Ван, Хайлун; Рао, Чжипэн; Чжун, Ченг; Синь, Сю; Мо, Линь; Ю, Шуцзюань; Шен, Чао; Чжэн, Цунги; Даймонд, М.С. (15 июля 2015 г.). «Винексин β взаимодействует с NS5A вируса гепатита С, модулируя его гиперфосфорилирование для регулирования распространения вируса». Журнал вирусологии. 89 (14): 7385–7400. Дои:10.1128 / JVI.00567-15. ЧВК 4473562. PMID 25972535.
- ^ а б Рейсс, Саймон; Ребхан, Илка; Бэкс, Пердита; Ромеро-Брей, Инес; Эрфле, Хольгер; Матула Петр; Кадерали, Ларс; Поениш, Марион; Бланкенбург, Хаген; Хиет, Мари-Софи; Longerich, Томас; Диль, Сара; Рамирес, Фидель; Балла, Тамас; Рор, Карл; Кауль, Артур; Бюлер, Сандра; Пепперкок, Райнер; Ленгауэр, Томас; Альбрехт, Марио; Эйлс, Роланд; Ширмахер, Питер; Ломанн, Фолькер; Bartenschlager, Ральф (январь 2011 г.). «Привлечение и активация липид киназы вирусом гепатита C NS5A имеет важное значение для целостности компартмента репликации мембраны». Клеточный хозяин и микроб. 9 (1): 32–45. Дои:10.1016 / j.chom.2010.12.002. ЧВК 3433060. PMID 21238945.
- ^ Lim, Y.-S .; Хван, С. Б. (5 февраля 2011 г.). «Белок NS5A вируса гепатита С взаимодействует с фосфатидилинозитол-4-киназой типа III и регулирует распространение вируса». Журнал биологической химии. 286 (13): 11290–11298. Дои:10.1074 / jbc.M110.194472. ЧВК 3064185. PMID 21297162.
- ^ а б Ахмед, Мараван; Пал, Абхишек; Хоутон, Майкл; Баракат, Халед (3 августа 2016 г.). «Комплексный вычислительный анализ способов связывания ингибиторов NS5A вируса гепатита С: вопрос симметрии». Инфекционные болезни ACS. 2 (11): 872–881. Дои:10.1021 / acsinfecdis.6b00113. PMID 27933783.
- ^ а б c d Иссур, Мохешварнатх; Гётте, Маттиас (6 ноября 2014 г.). «Паттерны устойчивости, связанные с ингибиторами NS5A вируса гепатита С, дают ограниченное представление о связывании лекарств». Вирусы. 6 (11): 4227–4241. Дои:10.3390 / v6114227. ЧВК 4246218. PMID 25384189.
- ^ Ламберт, Себастьян М .; Лэнгли, Дэвид Р .; Гарнетт, Джеймс А .; Энджелл, Ричард; Хеджеторн, Кэти; Мэнвелл, Николас А .; Мэтьюз, Стив Дж. (Июнь 2014 г.). «Кристаллическая структура домена 1 NS5A генотипа 1a раскрывает новые ключи к разгадке механизма действия димерных ингибиторов HCV». Белковая наука. 23 (6): 723–734. Дои:10.1002 / pro.2456. ЧВК 4093949. PMID 24639329.
- ^ а б Qiu, D .; Lemm, J. A .; О'Бойл, Д. Р .; Sun, J.-H .; Nower, P.T .; Nguyen, V .; Hamann, L.G .; Снайдер, Л. Б .; Деон, Д. Х .; Ruediger, E .; Мэнвелл, Н. А .; Белема, М .; Gao, M .; Фриделл, Р. А. (27 июля 2011 г.). «Влияние ингибиторов NS5A на фосфорилирование NS5A, процессинг полипротеина и локализацию». Журнал общей вирусологии. 92 (11): 2502–2511. Дои:10.1099 / vir.0.034801-0. PMID 21795470.
- ^ а б Белема, Маконен; Лопес, Омар Д .; Бендер, Джон А .; Romine, Джеффри Л .; Сен-Лоран, Дени Р .; Лэнгли, Дэвид Р .; Lemm, Julie A .; О’Бойл, Дональд Р .; Сунь, Цзинь-Хуа; Ван, Чуньфу; Фриделл, Роберт А.; Мэнвелл, Николас А. (13 марта 2014 г.). «Открытие и разработка ингибиторов комплекса репликации NS5A вируса гепатита С». Журнал медицинской химии. 57 (5): 1643–1672. Дои:10.1021 / jm401793m. PMID 24621191.
- ^ а б Guedj, J .; Dahari, H .; Rong, L .; Sansone, N.D .; Nettles, R.E .; Cotler, S.J .; Layden, T. J .; Упричард, С.L .; Перельсон, А.С. (19 февраля 2013 г.). «Моделирование показывает, что ингибитор NS5A даклатасвир имеет два механизма действия и дает более короткую оценку периода полужизни вируса гепатита С».. Труды Национальной академии наук. 110 (10): 3991–3996. Дои:10.1073 / pnas.1203110110. ЧВК 3593898. PMID 23431163.
- ^ МакГиверн, Дэвид Р .; Масаки, Такахиро; Уиллифорд, Сара; Ингравалло, Пол; Фэн, Цзунди; Ласер, Фредерик; Асанте-Аппиа, Эрнест; Неддерманн, Петра; Де Франческо, Рафаэле; Хау, Анита Ю.; Лимон, Стэнли М. (август 2014 г.). «Кинетические анализы выявляют сильную и раннюю блокаду сборки вируса гепатита С ингибиторами NS5A». Гастроэнтерология. 147 (2): 453–462.e7. Дои:10.1053 / j.gastro.2014.04.021. ЧВК 4107048. PMID 24768676.
- ^ Neufeldt, Christopher J .; Джойс, Майкл А .; Ван Бюрен, Николас; Левин, Авиад; Киркегор, Карла; Гейл-младший, Майкл; Tyrrell, D. Lorne J .; Возняк, Ричард В .; Кун, Ричард Дж. (10 февраля 2016 г.). «Мембранная сеть, вызванная вирусом гепатита С, и связанная с ней ядерная транспортная техника ограничивают доступ рецепторов распознавания образов к сайтам репликации вирусов». Патогены PLOS. 12 (2): e1005428. Дои:10.1371 / journal.ppat.1005428. ЧВК 4749181. PMID 26863439.
- ^ Бергер, Карола; Ромеро-Брей, Инес; Радуйкович, Даниела; Терро, Рафаэль; Заяс, Маргарита; Пол, Дэвид; Харак, Кристиан; Хоппе, Симона; Гао, Мин; Пенин, Франсуа; Ломанн, Фолькер; Bartenschlager, Ральф (ноябрь 2014 г.). «Даклатасвир-подобные ингибиторы NS5A блокируют ранний биогенез фабрик репликации мембран, индуцированных вирусом гепатита С, независимо от репликации РНК». Гастроэнтерология. 147 (5): 1094–1105.e25. Дои:10.1053 / j.gastro.2014.07.019. PMID 25046163.
- ^ а б Чжан, Синцюань (январь 2016 г.). «Прямые анти-HCV агенты». Акта Фармацевтика Синица B. 6 (1): 26–31. Дои:10.1016 / j.apsb.2015.09.008. ЧВК 4724659. PMID 26904396.
- ^ Fung, A .; Jin, Z .; Дяткина, Н .; Wang, G .; Бейгельман, Л .; Деваль, Дж. (14 апреля 2014 г.). «Эффективность включения и обрыва цепи определяет ингибирующую способность 2'-модифицированных аналогов нуклеотидов против полимеразы вируса гепатита С». Противомикробные препараты и химиотерапия. 58 (7): 3636–3645. Дои:10.1128 / AAC.02666-14. ЧВК 4068585. PMID 24733478.
- ^ Брудер Коста, Юлиана; Дюфе-Дюшен, Таня; Лерой, Винсент; Бертуччи, Инга; Бувье-Алиас, Магали; Пуже, Ноэль; Бревот-Латтон, Офели; Бурльер, Марк; Зулим, Фабьен; Plumas, Джоэл; Аспорд, Кэролайн; Chemin, Isabelle A (27 июня 2016 г.). «Пегилированный интерферон α-2a запускает функциональность NK-клеток и специфические Т-клеточные ответы у пациентов с хронической инфекцией HBV без сероконверсии HBsAg». PLOS ONE. 11 (6): e0158297. Дои:10.1371 / journal.pone.0158297. ЧВК 4922676. PMID 27348813.
- ^ а б c Пурдад, Фред; Лэндис, Чарльз С .; Асатрян, Армен; Джексон, Дэниел Ф .; Нг, Тереза I .; Фу, Бо; Линь, Чжи-Вэй; Яо, Бетти; Корт, Йенс (август 2016 г.). «Высокая противовирусная активность ингибитора NS5A ABT-530 с паритапревиром / ритонавиром и рибавирином против инфекции вируса гепатита С генотипа 3». Liver International. 36 (8): 1125–1132. Дои:10.1111 / liv.13067. ЧВК 5067610. PMID 26778412.
- ^ Гаудиери, Сильвана; Раух, Андри; Пфафферотт, Катя; Барнс, Элеонора; Ченг, Венди; МакКоган, Джефф; Шакель, Ник; Джеффри, Гэри П .; Моллисон, Линдси; Бейкер, Росс; Феррер, Хансьякоб; Günthard, Huldrych F .; Фрейтас, Элизабет; Хамфрис, Исла; Кленерман, Пол; Маллал, Саймон; Джеймс, Ян; Робертс, Стюарт; Нолан, Дэвид; Лукас, Микаэла (апрель 2009 г.). «Устойчивость к лекарствам вируса гепатита С и иммунная адаптация: актуальность для новой противовирусной терапии». Гепатология. 49 (4): 1069–1082. Дои:10.1002 / hep.22773. PMID 19263475.
- ^ Арчер, Мелисса; Стейнворт, Карин; Одерда, Гэри. «ОБНОВЛЕНИЕ: Новые комбинированные агенты против гепатита С» (PDF). Департамент здравоохранения штата Юта. Архивировано из оригинал (PDF) 27 декабря 2016 г.. Получено 8 сентября 2016.
- ^ Блайт, К. Дж. (8 декабря 2000 г.). «Эффективное начало репликации РНК HCV в клеточной культуре». Наука. 290 (5498): 1972–1974. Дои:10.1126 / наука.290.5498.1972. PMID 11110665.
- ^ а б Conte, Immacolata; Джулиано, Клаудио; Эрколани, Катерина; Наржес, Франк; Кох, Уве; Роули, Майкл; Альтамура, Серджио; Франческо, Раффаэле Де; Неддерманн, Петра; Мильаччо, Джованни; Стэнсфилд, Ян (март 2009 г.). «Синтез и SAR пиперазинил-N-фенилбензамидов как ингибиторов репликации РНК вируса гепатита С в культуре клеток». Письма по биоорганической и медицинской химии. 19 (6): 1779–1783. Дои:10.1016 / j.bmcl.2009.01.066. PMID 19216075.
- ^ Ломанн, В. (2 июля 1999 г.). «Репликация субгеномных РНК вируса гепатита С в клеточной линии гепатомы». Наука. 285 (5424): 110–113. Дои:10.1126 / science.285.5424.110. PMID 10390360.
- ^ Lohmann, V .; Hoffmann, S .; Herian, U .; Пенин, Ф .; Бартеншлагер, Р. (1 марта 2003 г.). «Вирусные и клеточные детерминанты репликации РНК вируса гепатита С в клеточной культуре». Журнал вирусологии. 77 (5): 3007–3019. Дои:10.1128 / JVI.77.5.3007-3019.2003. ЧВК 149776. PMID 12584326.
- ^ «FDA одобрило новое лечение хронического гепатита С генотипа 3». FDA. 27 июля 2015 г.. Получено 29 сентября 2016.
- ^ а б c d е ж грамм час Link, John O .; Тейлор, Джеймс Дж .; Сюй, Ляньхун; Митчелл, Майкл; Го, Хунъянь; Лю, Хунтао; Като, Дэррил; Киршберг, Торстен; Сунь, Цзяньюй; Сквайрс, Нил; Пэрриш, Джей; Келлер, Терри; Ян, Чжэн-Ю; Ян, Крис; Матлес, Майк; Ван, Юйцзинь; Ван, Келли; Ченг, Гофэн; Тиан, Ян; Могалиан, Эрик; Мондоу, Эльза; Корнпропст, Мелани; Перри, Джейсон; Десаи, Манодж К. (13 марта 2014 г.). «Открытие ледипасвира (GS-5885): мощного перорального ингибитора NS5A один раз в день для лечения вирусной инфекции гепатита С». Журнал медицинской химии. 57 (5): 2033–2046. Дои:10,1021 / jm401499g. PMID 24320933.
- ^ Китинг, Джиллиан М. (3 апреля 2015 г.). «Ледипасвир / софосбувир: обзор его использования при хроническом гепатите С». Наркотики. 75 (6): 675–685. Дои:10.1007 / s40265-015-0381-2. PMID 25837989. S2CID 31943736.
- ^ Накамото, Синго (2014). «Ингибиторы NS5A вируса гепатита С и мутации лекарственной устойчивости». Всемирный журнал гастроэнтерологии. 20 (11): 2902–12. Дои:10.3748 / wjg.v20.i11.2902. ЧВК 3961994. PMID 24659881.
- ^ Букле, Себастьян; Тао, Сиджи; Амблард, Франк; Стэнтон, Ричард А .; Крапива, Джеймс Х .; Ли, Чэнвэй; Макбрайер, Тамара Р .; Уитакер, Тони; Coats, Стивен Дж .; Схинаци, Раймонд Ф. (сентябрь 2015 г.). «Разработка, синтез и оценка новых молекул против HCV, которые доставляют внутри клетки три сильнодействующих ингибитора NS5A». Письма по биоорганической и медицинской химии. 25 (17): 3711–3715. Дои:10.1016 / j.bmcl.2015.06.031. ЧВК 4538959. PMID 26099532.
- ^ а б Romine, Джеффри Л .; Сен-Лоран, Дени Р .; Leet, John E .; Мартин, Скотт В .; Серрано-Ву, Майкл Х .; Ян, Фукан; Гао, Мин; О’Бойл, Дональд Р. Lemm, Julie A .; Сунь, Цзинь-Хуа; Nower, Питер Т .; Хуан, Сяохуа (Стелла); Deshpande, Milind S .; Мэнвелл, Николас А .; Снайдер, Лоуренс Б. (10 марта 2011 г.). «Ингибиторы NS5A HCV: от иминотиазолидинонов до симметричных стильбенов». Письма о медицинской химии ACS. 2 (3): 224–229. Дои:10,1021 / мл 1002647. ЧВК 4017990. PMID 24900306.
- ^ Ши, Цзюньсин; Чжоу, Лунху; Амблард, Франк; Бобек, Дрю Р .; Чжан, Хунванг; Лю, Пэн; Бондада, Лаванья; Макбрайер, Тамара Р .; Тарниш, Филип М .; Уитакер, Тони; Coats, Стивен Дж .; Схинаци, Раймонд Ф. (май 2012 г.). «Синтез и биологическая оценка новых сильнодействующих и селективных ингибиторов NS5A HCV». Письма по биоорганической и медицинской химии. 22 (10): 3488–3491. Дои:10.1016 / j.bmcl.2012.03.089. PMID 22507961.
- ^ Страхотин, Кристина Симона; Бабич, Михаил (2012). «Вариабельность гепатита С, паттерны резистентности и влияние на терапию». Достижения вирусологии. 2012: 267483. Дои:10.1155/2012/267483. ЧВК 3407602. PMID 22851970.
- ^ Оуэнс, Кристофер М .; Brasher, Bradley B .; Полемеропулос, Алекс; Rhodin, Майкл Х. Дж .; Макаллистер, Николь; Вонг, Келли А .; Джонс, Кристофер Т .; Цзян, Лицзюань; Лин, Кай; Или, Ят Сунь (октябрь 2016 г.). «Профиль доклинической и клинической резистентности EDP-239, нового ингибитора NS5A вируса гепатита С». Противомикробные препараты и химиотерапия. 60 (10): 6216–6226. Дои:10.1128 / AAC.00815-16. ЧВК 5038316. PMID 27503644.
- ^ а б c Feld, Jordan J .; Фостер, Грэм Р. (октябрь 2016 г.). «Противовирусные препараты прямого действия второго поколения - ожидаем ли мы серьезных улучшений?». Журнал гепатологии. 65 (1): S130 – S142. Дои:10.1016 / j.jhep.2016.07.007. PMID 27641983.