WikiDer > Открытие и разработка антагонистов TRPV1
Облегчение хронической боли остается признанной неудовлетворенной медицинской потребностью. Следовательно, поиск новых анальгетиков интенсивно изучается фармацевтической промышленностью. Рецептор TRPV1 - это ионный канал, который участвует в опосредовании многих типов боли и поэтому изучен наиболее широко. Первый конкурентный антагонист, капсазепин, был впервые описан в 1990 году, с тех пор разработка новых антагонистов TRPV1 прошла долгий путь. Эти усилия привели к идентификации нескольких антагонистов TRPV1, которые вошли в клинические испытания в качестве анальгетиков. Если эти новые химические соединения облегчат симптомы хронической боли, тогда этот класс соединений может предложить один из первых новых механизмов лечения боли за многие годы.[1][2]
История
Капсаицин, активный ингредиент в Перец чили был впервые изолирован более века назад. В 1919 году точная химическая структура капсаицин был определен, и полный синтез соединения был достигнут десятилетием позже. Капсаицин использовался как обезболивающее в течение десятилетий, но терапевтический потенциал капсаицина был впервые признан еще в 1850 году.[3] Эффекты острый химический, капсаицин, опосредуется через лигандный ионный канал TRPV1. Эти знания подготовили почву для дальнейших исследований функции TRPV1. рецептор доклинические исследования показали его важность при многих заболеваниях человека.[1][4] Это первые агенты, действующие по этому механизму, которые вошли в клинику для оценки их использования как возможных анальгетиков и, следовательно, важных мишеней для разработка лекарств. Еще предстоит сделать много открытий, как с точки зрения диапазона потенциальных терапевтических применений, так и в плане обезболивания для TRPV1. антагонисты и только в последнее десятилетие появилось полное понимание молекулярного механизма. В ближайшие годы станет яснее, смогут ли антагонисты TRPV1 реализовать свой потенциал.[1][5][6]
Ваниллоидный рецептор 1 (рецептор VR1 / TRPV1)
В ваниллоидный рецептор (TRPV1) - один из шести субчленов, входящих в канал транзиторного рецепторного потенциала (ГТО) суперсемейство. TRPV1 был первым обнаруженным членом млекопитающих и является неизбирательным катионный канал проницаемый для кальций. Рецептор состоит из четырех идентичных субъединиц, каждая с шестью трансмембранными сегментами, S1-S6, с водной порой между пятым и шестым сегментами. Эта область образует проводящую пору канала и содержит N- и C-концы на цитозольный сторона клеточная мембрана.[7]Капсаицин и RTX, вызывают жгучую боль, активируя неизбирательный катионный канал, экспрессируемый на окончаниях чувствительных нервов. Когда капсаицин В доклинических исследованиях было обнаружено, что он оказывает обезболивающее, большое внимание уделялось исследованиям рецептора / канала, с которым капсаицин связывается и активируется.[8][9] Помимо активации капсаицином, TRPV1 также реагирует на широкий спектр экзогенных и эндогенных химических лигандов, а также на физические стимулы, такие как нагрев выше 42 ° C и изменение более разнообразных активаторов, таких как протоны (кислота, pH <6). TRPV1 также подлежит регулированию путем изменения мембранный потенциал считается, что эта внутренняя зависимость от напряжения лежит в основе ворота механизм этого неселективного катионного канала, который приводит к притоку ионов натрия и кальция. Важно отметить, что TRPV1 активность также регулируется множеством внутриклеточных сигнальных каскадов, таких как G-белок передача сигналов сопряженных рецепторов, которые участвуют в ответах на альгогенные агенты, медиаторы воспаления и повреждение.[1]
Механизм действия
TRPV1 в первую очередь выражается на малых миелинизированный и немиелинизированные среднего размера, сенсорные нейроны в дорсальный корешок и тройничные ганглии, где сенсорные нейроны сгруппированы. Рецепторы TRPV1 также обнаруживаются в мышцах, суставах, мочевом пузыре и почках. Функциональная активность TRPV1 была продемонстрирована в центральной нервной системе в спинной мозг и определенные участки мозга, включая гипоталамус, мозжечок, голубое пятно, периакведуктальный серый и кора. Активация TRPV1 вызывает приток ионов кальция и натрия, который, в свою очередь, запускает каскад событий, которые приводят к образованию мембраны. деполяризация, возбуждение нейронов и передача нервных импульсов. TRPV1 фосфорилаты в ответ на несколько болеутоляющих агенты, что приводит к более низкому порогу активации канала. Некоторые вещества, такие как брадикинин, фактор роста нервов и протоны сообщалось, что он сенсибилизирует рецептор TRPV1. Активация TRPV1 приводит к высвобождению про-ноцицептивный пептиды, которая уменьшается при лечении антагонистами TRPV1. Как правило, большинство антагонистов каналов связываются в области пор, взаимодействуя с остатками из всех четырех мономеры из тетрамерный канал.[2][10][11]
Привязка
Лиганды рецептора TRPV1, по-видимому, действуют из внутриклеточный сторона. Это необычное свойство TRPV1, где лиганды большинства других лиганд-управляемых каналов связываются из внеклеточный Космос. Капсаицин очень липофильный и может легко проходить через плазматическую мембрану. Общепринято, что капсаицин действует на рецептор TRPV1 и связывается с ним с внутриклеточной стороны до активации. Критическими сайтами связывания капсаицина являются Arg 114 и Glu 761 на N- и C-концах рецептора, соответственно. Поскольку эти две аминокислоты заряжены и расположены в цитозольной части рецептора TRPV1, эти две области, вероятно, участвуют в гидрофильном взаимодействии TRPV1 с ваниллоиды такие как капсаицин и RTX. В дополнение к этим сайтам на N- и C-концах TRPV1, область внутриклеточного линкера, расположенная в трансмембранном домене, называемая «областью TM3», как было показано, является критической для гидрофобного взаимодействия с ваниллоидами. Считается, что область TM3 необходима для связывания с ваниллоидами. Он окружен гидрофобной средой из-за его размещения в плазматическая мембрана. Теперь он признан важным звеном гидрофобного взаимодействия с капсаицином. Сайты связывания Arg 114 и Glu 761 и область TM3 в TRPV1 вместе составляют карман связывания с ваниллоидами.[10][2]
Дизайн лекарств
Агонисты
Капсаицин (рис. 2), ваниллоид природного происхождения, является наиболее известным агонистом TRPV1. Резинифератоксин (RTX) - еще один встречающийся в природе ваниллоид, который проявляет агонистическую активность TRPV1. Он более эффективен, чем капсаицин, и в настоящее время разрабатывается как средство, снижающее чувствительность сенсорных нейронов.[7] Первоначально, агонисты были основным направлением разработки лиганда TRPV1 из-за обезболивающего эффекта, возникающего в результате десенсибилизация рецептора. Однако из-за первоначального сжигающего эффекта всех природных агонистов ваниллоидных рецепторов, включая капсаицин, терапия становится сложной и, возможно, неэффективной. Попытки сделать синтетический агонисты с хорошим разделением возбуждающего и обезболивающего эффектов не принесли успеха. Чтобы избежать этих стойких побочных эффектов агонистов TRPV1, особое внимание было уделено конкурентным антагонистам как новым обезболивающим препаратам.[9]
Антагонисты
Были предприняты активные усилия по разработке как конкурентный и неконкурентоспособный TRPV1 антагонисты. Антагонисты, связывающиеся с агонистом сайт привязки, и заблокировать канал в закрытом непроводящем состоянии - конкурентные антагонисты. Напротив, антагонисты, которые взаимодействуют с дополнительными сайтами связывания в структуре рецептора, предотвращая открытие рецептора агонистом или блокируя его водные поры, являются неконкурентными антагонистами. Неконкурентные антагонисты, действующие как блокаторы открытых каналов, терапевтически привлекательны, потому что они распознают чрезмерно активированные каналы TRPV1, что может снизить вероятность нежелательных побочных эффектов.[7]
Фармакофор
В фармакофор Модель антагонистов TRPV1 состоит из трех основных характеристик: акцептора водородной связи, донора водородной связи и кольцевой особенности. Кроме того, антагонисты TRPV1 были наложенный таким образом, чтобы они могли уместиться в объеме поры TRPV1. Когда рассматривается модель гомологии, соответствующие сайты взаимодействия обнаруживаются в поре рецептора. Предполагается, что акцептор водородной связи на лиганде взаимодействует с Tyr 667 (спираль S6) на рецепторе в качестве донора водородной связи, а донор водородной связи на лиганде, как предполагается, взаимодействует с Tyr 667 на противоположной стороне. мономер из тетрамер на рецепторе в качестве акцептора водородной связи. Предполагается, что кольцевой элемент фармакофоров вписывается в гидрофобное пространство, образованное ароматические кольца из четырех остатков Tyr 667 четырех мономеров. В соответствии с решающей ролью Tyr 667 в взаимодействие с ключевыми элементами фармакофора антагониста TPRV1, сайт-направленный мутагенез Исследования показали, что замена этого тирозина на аланин в рецепторе TRPV1 крысы отменяет функциональную активность TRPV1. Липофильный конец антагониста различается по характеру и объему и взаимодействует с нижним концом трансмембранного спирали S5 и S6. Поскольку внутриклеточные концы этих спиралей проходят за мембрану, они могут быть гибкими и могут быть частью процесса открытия и закрытия канала. Комбинированное использование модели фармакофоров, собранных из высокооптимизированных антагонистов TRPV1, с моделью гомологии белка улучшило понимание наблюдаемых взаимосвязей структура-активность многих серий текущих антагонистов TRPV1 и должно быть полезным для открытия новых классов антагонистов.[2]
Структура отношения деятельности
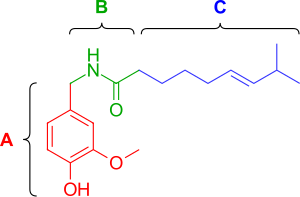
Капсаицин (рис.2) имеет три функциональных области: ароматическую область А, где оптимальна исходная гомованиллильная (3-метокси 4-гидроксибензильная) группа, область В, известную как сложный эфир или же амид линкер и алифатическая С-область, где липофильный октаниловый фрагмент связан с наивысшей эффективностью. Гомованиллильный мотив и области амидных связей содержат диполярные группы, которые участвуют во взаимодействиях водородных связей.[12]
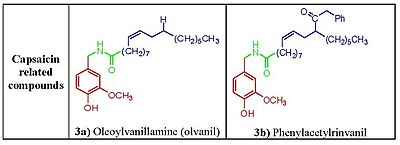
Фенол гидроксид и амид части кажутся жизненно важными для индукции реакции на капсаицин. Удаление фенольной гидроксидной или амидной связи в аналогах капсаицина приводит к снижению эффективности. Фрагменты гидроксида фенола и амида в капсаицине имеют общие потенциальные взаимодействия множественных водородных связей с рецептором TRPV1. Капсаициноиды и капсиноиды характеризуются насыщенным кислородом ароматическим фрагментом, связанным через амидный (капсаициноид) или сложноэфирный (капсиноиды) линкер с липофильной ацильной группой. В ванилил и карбонил линкер содержит полярные группы, способные образовывать водородные связи, необходимые для активности, тогда как липофильный фрагмент взаимодействует с соответствующей щелью сайта связывания ваниллоида на TRPV1. Замена среднего разветвленного жирная кислота капсаицина с более длинными жирными кислотами разрушает активность,[13] но наличие ненасыщенности восстанавливает и усиливает активность, например, олеоильванилламин (Ольванил) (рис. 3a), в анализах активации TRPV1 в 10 раз более эффективен, чем капсаицин.[14]
1,3-ди (арилалкил) тиомочевины
Капсазепин (рис. 4а), первый конкурентный антагонист ваниллоида,[15][10] сообщает Новартис группа, была направлена на оценку влияния конформационных ограничений на липофильную C-область капсаицина. В капсазепине амидная связь капсаицина заменена на тиомочевина фрагмент и пропилиденовый линкер между ароматическим ваниллил-2-углеродным А кольцом и амидным азотом В-линкера заставляет ароматическое кольцо образовывать ортогональный ориентация относительно тиомочевинной связи.[16] Это ограничение долгое время считалось отличительной чертой ваниллоидного антагонизма.[17] Капсазепин конкурирует за сайт связывания капсаицина на TRPV1, однако из-за низкой метаболической стабильности и плохих фармакокинетических свойств соединение не достигло клиническая разработка.[18] Позже было замечено, что эта привязь не была критичной для активности, поскольку были разработаны мощные антагонисты, свободные от этой структурной особенности, с 1,3-ди (арилалкил) тиомочевины становится одним из наиболее многообещающих антагонистов TRPV1 неваниллоидного класса, демонстрирующим превосходный терапевтический потенциал в регуляции боли. В этих соединениях замена гваяцил фрагмент капсаициноидов с 3-фтор-4-сульфониламидной группой, как обнаружено, критически важный для восстановления активности. Это привело к созданию фрагмента C-области, имитируемого на RTX, привело к соединению, показанному на фиг. 4b, которое показало превосходную анальгетическую активность у мышей.[19][20] Альтернативная оптимизация липофильной C-области привела к JYL1421 (рис. 4c), еще один многообещающий клинический кандидат.[21]
Ди (арилалкил) - и арил (арилакил) мочевины
Несколько аналогов капсаицина типа мочевины были разработаны ацилирование гомованиллиламина и родственных аминов с различными 4- (α-пиридил) пиперидин-1-ацилхлоридами. Присутствие полярной аминогруппы в гидрофобной C-области капсациноидов имеет решающее значение для эффективности пары и гидрофильность, имитируя аналогичные наблюдения, которые привели к открытию фенилацетилринванил (рис. 3б) из олванила (рис. 3а). Фенилацетилринванил - самый мощный капсаициноид, о котором сообщалось на сегодняшний день, он примерно в 500 раз более мощный, чем капсаицин.[22] Несколько других мочевин оказались чрезвычайно активными антагонистами TRPV1. По сравнению с капсазепином пиперазинилмочевина (рис. 5a и 5b) показали более высокий профиль селективности по отношению к широкому спектру ферменты и каналы[23] тогда как родственный очень мощный и специфический антагонист TRPV1 A-425619 (рис. 5c) может уменьшить боль, связанную с воспалением и повреждением тканей у крыс.[24] Дальнейшие исследования привели к появлению множества низкомолекулярных антагонистов TRPV1, включая мочевину. SB-705498 (рис. 5d), SB-452533 (рис. 5e) [16,17] и АБТ-102(рис. 5f), соединения, которые прошли клинические испытания.[25]
Циннамиды
N-Арилциннамиды превратились в мощный и важный класс антагонистов TRPV1, соединение SB-366791(рис. 6а) демонстрирует конкурентную и специфическую активность в отношении рецепторов TRPV1 человека и крысы, общий профиль селективности рецептора намного лучше, чем у капсазепина.[26][27]В этой серии соединений АМГ-9810 (рис. 6b) продемонстрировали высокую активность антагонистов, что свидетельствует о хорошей пероральной биодоступности у крыс и многообещающей фармакокинетический профиль, свидетельствующий о клинической эффективности.[28] Еще один мощный блокатор из этой группы - AMG0347(рис. 6c), который, как было показано в послеоперационном испытании боли, способен уменьшать вызванную капсаицином тепловую и механическую гипералгезию и блокировать центральные рецепторы TRPV1.[29]
Карбоксамиды
Несколько антагонистов TRPV1 карбоксамид типа были обнаружены. Они конструктивно довольно гетерогенный, как показано на примере сравнения никотинамид производная SB-782443 (рис. 7a), тиазолилкарбоксамид (рис. 7b) и тетрагидропиридилкарбоксамид (рис. 7c).[30] SB-782443 (рис. 7a) продемонстрировал превосходную эффективность в отношении TRPV1 человека, морской свинки и крысы, благоприятный in vitro профиль метаболизма и фармакокинетики лекарств, а также замечательный in vivo активность в модели воспалительной боли.[31][32] На основе их in vitro профиля, несколько соединений этого класса допущены к доклинической разработке.[30]
Прочие производные
У неклассических антагонистов отсутствуют группы мочевины, тиомочевины или амида, типичные для классических лигандов TRPV1. Были обнаружены два основных структурных типа неклассических антагонистов. Во-первых, это имидазол производные. Исходя из структуры свинца 4,6-дизамещенного бензимидазола, ряд 4,5-биарилимидазолов способен блокировать как капсаицин, так и индуцированный кислотой приток кальция в TRPV1-экспрессирующие клетки яичника китайского хомячка. Имидазол (рис. 8а) был идентифицирован как очень мощный и пероральный биодоступный TRPV1.[33] Другой класс - диариловые эфиры и амины. Соединения из хиназолин ряды можно рассматривать как конформационно ограниченные аналоги биариламидного ряда. По деятельности 5-изохинолин оказался наиболее активным среди 5-изохинолина и расположился в порядке его расположения в порядке 5-изохинолина> 8-хинолин > 8-хиназолин> 8-изохинолин ≥ циннолин> фталазин> хиноксалин> 5-хинолин[34] например AMG517 (рис. 8b), хотя в нем отсутствует какой-либо узнаваемый карбонильный мотив, он по-прежнему эффективно блокирует капсаицин, протон и тепловую активацию TRPV1. in vitro и показывает хороший профиль переносимости.[35] Также клинические кандидаты из Янссен, Эбботт и Merck фармацевтические препараты (фиг. 8c), имеющие 5-аминоизохинолиновую группу в качестве общего признака, что позволяет предположить, что существует ключевое взаимодействие этой группы в рецепторном сайте для активности антагониста TRPV1.[34]
Текущее состояние
В ноябре 2009 года FDA одобрило Qutenza (капсаицин, 8% местный пластырь) для лечения постгерпетическая невралгия.[36]
Клинические испытания
По состоянию на конец 2009 года доступная публичная информация свидетельствует о том, что довольно многие из них проходят клинические испытания. Несколько биотехнологических и фармацевтических компаний разрабатывают лиганды TRPV1, и, по-видимому, упор делается как на агонисты, так и на антагонисты. Хотя агонисты, похоже, находятся дальше в клинической разработке.[1]
Агонисты
NeurogesX успешно завершила три клинических исследования фазы III Qutenza (NGX-4010), которые соответствовали основным критериям исследования. Qutenza - это синтетический транс-капсаицин, и доставка лекарств осуществляется с помощью системы аппликации пластыря быстрой доставки.[37] NeurogesX планирует запустить Qutenza в США в первой половине ноября 2010 года.[38]Еще одна биотехнологическая компания Anesiva завершила две фазы III испытаний Adlea (ALGRX 4975), капсаицин для инъекций. Адлея перспективна как обезболивающее[39] и оба испытания показали, что профиль безопасности Adlea в отношении побочных эффектов, заживления ран и сенсорной функции ран был аналогичен плацебо на протяжении всего исследования.[40]
Антагонисты
По крайней мере, семь перорально активных антагонистов TRPV1 находятся в стадии клинической разработки, а еще несколько находятся в стадии доклинической разработки. Лиганд GRC-6211, к Эли Лилли и компания-Гленмарк является наиболее продвинутым и в настоящее время проходит клинические испытания фазы IIb. GlaxoSmithKline, Merck-Нейроген, Amgen и АстраЗенека все разрабатывают антагонист TRPV1, и все они разрабатывают вещества, успешно прошедшие фазу испытаний I.[1]
Смотрите также
- Ваниллоидный рецептор TRPV
- Подтип 1 ваниллоидного рецептора TRPV1
- Канал транзиторного рецепторного потенциала
- Капсаицин
- Капсазепин
- Дегидроэпиандростерон
- Резинифератоксин
Рекомендации
- ^ а б c d е ж Гунторп MJ, Чиж Б.А. (январь 2009 г.). «Клиническая разработка антагонистов TRPV1: нацеливание на ключевую точку болевого пути». Открытие наркотиков сегодня. 14 (1–2): 56–67. Дои:10.1016 / j.drudis.2008.11.005. PMID 19063991.
- ^ а б c d Kym PR, Kort ME, Hutchins CW (август 2009 г.). «Обезболивающий потенциал антагонистов TRPV1». Биохимическая фармакология. 78 (3): 211–6. Дои:10.1016 / j.bcp.2009.02.014. PMID 19481638.
- ^ Салласи А., Блумберг П.М. (июнь 1999 г.). «Ваниллоидные (капсаициновые) рецепторы и механизмы». Фармакологические обзоры. 51 (2): 159–212. PMID 10353985.
- ^ Immke DC, Gavva NR (октябрь 2006 г.). «Рецептор TRPV1 и ноцицепция». Семинары по клеточной биологии и биологии развития. 17 (5): 582–91. Дои:10.1016 / j.semcdb.2006.09.004. PMID 17196854.
- ^ Рами Х, Гунторп М (2004). «Терапевтический потенциал антагонистов TRPV1 (VR1): ожидаются клинические ответы». Открытие лекарств сегодня: терапевтические стратегии. 1: 97–104. Дои:10.1016 / j.ddstr.2004.08.020.
- ^ Wong GY, Gavva NR (апрель 2009 г.). «Терапевтический потенциал агонистов и антагонистов ваниллоидного рецептора TRPV1 в качестве анальгетиков: последние достижения и неудачи». Обзоры исследований мозга. 60 (1): 267–77. Дои:10.1016 / j.brainresrev.2008.12.006. PMID 19150372. S2CID 9951052.
- ^ а б c Messeguer A, Planells-Cases R, Ferrer-Montiel A (январь 2006 г.). «Физиология и фармакология ваниллоидного рецептора». Современная нейрофармакология. 4 (1): 1–15. Дои:10.2174/157015906775202995. ЧВК 2430674. PMID 18615132.
- ^ Wong GY, Gavva NR (апрель 2009 г.). «Терапевтический потенциал агонистов и антагонистов ваниллоидного рецептора TRPV1 в качестве анальгетиков: последние достижения и неудачи». Обзоры исследований мозга. 60 (1): 267–77. Дои:10.1016 / j.brainresrev.2008.12.006. PMID 19150372. S2CID 9951052.
- ^ а б Гомцян А., Байбурт Е.К., Шмидт Р.Г., Чжэн Г.З., Пернер Р.Дж., Дидоменико С., Кениг Дж.Р., Тернер С., Джинкерсон Т., Дризин И., Ханник С.М., Макри Б.С., Макдональд Х.А., Оноре П., Висмер К.Т., Марш К.С., Веттер Дж. , Стюарт К.Д., Оие Т., Джарвис М.Ф., Сурови С.С., Фалтинек С.Р., Ли СН (февраль 2005 г.). «Новые временные антагонисты рецептора ваниллоидного рецептора 1 для лечения боли: взаимосвязь структура-активность мочевины с хинолином, изохинолином, хиназолином, фталазином, хиноксалином и циннолиновыми фрагментами». Журнал медицинской химии. 48 (3): 744–52. Дои:10.1021 / jm0492958. PMID 15689158.
- ^ а б c Suh YG, Oh U (2005). «Активация и активаторы TRPV1 и их фармацевтическое значение». Текущий фармацевтический дизайн. 11 (21): 2687–98. Дои:10.2174/1381612054546789. PMID 16101449.
- ^ Гунторп MJ, Szallasi A (2008). «Периферические рецепторы TRPV1 как мишени для разработки лекарств: новые молекулы и механизмы». Текущий фармацевтический дизайн. 14 (1): 32–41. Дои:10.2174/138161208783330754. PMID 18220816.
- ^ Пирс Л.В., Петухов П.А., Сабо Т., Кедей Н., Бизик Ф., Козиковски А.П., Блумберг П.М. (август 2004 г.). «Эводиамин действует как агонист ваниллоидного рецептора TRPV1». Органическая и биомолекулярная химия. 2 (16): 2281–6. Дои:10.1039 / b404506h. PMID 15305207.
- ^ Морита А., Ивасаки Ю., Кобата К., Иида Т., Хигаши Т., Ода К., Сузуки А., Нарукава М., Сасакума С., Йокогоши Н., Ядзава С., Томинага М., Ватанабэ Т. (ноябрь 2006 г.). «Липофильность капсаициноидов и капсиноидов влияет на процесс множественной активации TRPV1 крысы». Науки о жизни. 79 (24): 2303–10. Дои:10.1016 / j.lfs.2006.07.024. PMID 16950406.
- ^ Вринс Дж., Аппендино G, Нилиус Б. (июнь 2009 г.). «Фармакология ваниллоидных переходных катионных каналов рецепторов». Молекулярная фармакология. 75 (6): 1262–79. Дои:10.1124 / моль 109.055624. PMID 19297520. S2CID 52863171.
- ^ Suh YG, Lee YS, Min KH, Park OH, Kim JK, Seung HS, Seo SY, Lee BY, Nam YH, Lee KO, Kim HD, Park HG, Lee J, Oh U, Lim JO, Кан Су, Kil MJ , Ку Джи, Шин С.С., Джу Й., Ким Дж. К., Чон Й. С., Ким С. И., Пак Й. Х. (сентябрь 2005 г.). «Новые сильнодействующие антагонисты переходного канала потенциального рецептора, член 1 подсемейства ваниллоидов: взаимосвязь структура-активность 1,3-диарилалкилтиомочевин, обладающих новыми ваниллоидными эквивалентами». Журнал медицинской химии. 48 (18): 5823–36. Дои:10.1021 / jm0502790. PMID 16134949.
- ^ Салласи A, Приложение G (май 2004 г.). «Антагонисты ваниллоидных рецепторов TRPV1 как следующее поколение обезболивающих. Ставим ли мы телегу впереди лошади?». Журнал медицинской химии. 47 (11): 2717–23. Дои:10.1021 / jm030560j. PMID 15139748.
- ^ Томинага М., Катерина М.Дж., Мальмберг А.Б., Розен Т.А., Гилберт Х., Скиннер К., Рауманн Б.Е., Басбаум А.И., Джулиус Д. (сентябрь 1998 г.). «Клонированный рецептор капсаицина объединяет множество болеутоляющих стимулов». Нейрон. 21 (3): 531–43. Дои:10.1016 / S0896-6273 (00) 80564-4. PMID 9768840. S2CID 2054891.
- ^ Уокер К.М., Урбан Л., Медхерст С.Дж., Патель С., Панесар М., Фокс А.Дж., Макинтайр П. (январь 2003 г.). «Антагонист VR1 капсазепин обращает вспять механическую гипералгезию на моделях воспалительной и невропатической боли». Журнал фармакологии и экспериментальной терапии. 304 (1): 56–62. Дои:10.1124 / jpet.102.042010. PMID 12490575. S2CID 14847633.
- ^ Lee J, Lee J, Kang M, Shin M, Kim JM, Kang SU, Lim JO, Choi HK, Suh YG, Park HG, Oh U, Kim HD, Park YH, Ha HJ, Kim YH, Toth A, Wang Y , Тран Р., Пирс Л. В., Лундберг Д. Д., Блумберг П. М. (июль 2003 г.). «Аналоги N- (3-ацилокси-2-бензилпропил) -N '- [4- (метилсульфониламино) бензил] тиомочевины: новые сильнодействующие антагонисты с высоким сродством и частичные антагонисты ваниллоидного рецептора». Журнал медицинской химии. 46 (14): 3116–26. Дои:10.1021 / jm030089u. PMID 12825950.
- ^ Ли Дж, Кан Су, Кил MJ, Шин М, Лим Джо, Чой ХК, Джин МК, Ким Си, Ким Се, Ли Й.С., Мин К.Х., Ким ЙХ, Ха ХД, Тран Р, Велтер Джей Ди, Ван И, Сабо Т. , Пирс Л. В., Лундберг Д. Д., Тот А., Павлюковец В. А., Морган М. А., Блумберг П. М. (сентябрь 2005 г.). «Анализ взаимосвязей структура-активность для« A-области »N- (4-трет-бутилбензил) -N '- [4- (метилсульфониламино) бензил] тиомочевинных аналогов как антагонистов TRPV1». Письма по биоорганической и медицинской химии. 15 (18): 4136–42. Дои:10.1016 / j.bmcl.2005.06.009. PMID 16005215.
- ^ Ван И, Сабо Т., Велтер Дж. Д., Тот А., Тран Р., Ли Дж., Кан Су, Су Ю. Г., Блумберг П. М., Ли Дж. (Октябрь 2002 г.). «Высокоаффинные антагонисты ваниллоидного рецептора». Молекулярная фармакология. 62 (4): 947–56. Дои:10,1124 / моль 62.4.947. PMID 12237342.
- ^ Аппендино G, Де Петрочеллис Л., Тревизани М., Минаси А., Даддарио Н., Мориелло А.С., Газзиери Д., Лигрести А., Кампи Б., Фонтана Дж., Пинна С., Джеппетти П., Ди Марцо В. (февраль 2005 г.). «Разработка первого сверхмощного« капсаициноидного »агониста на транзиторных рецепторных потенциальных каналах ваниллоидного типа 1 (TRPV1) и его терапевтический потенциал». Журнал фармакологии и экспериментальной терапии. 312 (2): 561–70. Дои:10.1124 / jpet.104.074864. PMID 15356216. S2CID 816699.
- ^ Pomonis JD, Harrison JE, Mark L, Bristol DR, Valenzano KJ, Walker K (июль 2003 г.). «N- (4-трет-бутилфенил) -4- (3-холорфиридин-2-ил) тетрагидропиразин -1 (2H) -карбоксамид (BCTC), новый эффективный пероральный антагонист ваниллоидного рецептора 1 с анальгетическими свойствами: II. vivo характеристика в моделях воспалительной и невропатической боли на крысах ». Журнал фармакологии и экспериментальной терапии. 306 (1): 387–93. Дои:10.1124 / jpet.102.046268. PMID 12721336. S2CID 11111018.
- ^ McDonald HA, Neelands TR, Kort M, Han P, Vos MH, Faltynek CR, Moreland RB, Puttfarcken PS (октябрь 2008 г.). «Характеристика A-425619 на нативных рецепторах TRPV1: сравнение ганглиев задних корешков и ганглиев тройничного нерва». Европейский журнал фармакологии. 596 (1–3): 62–9. Дои:10.1016 / j.ejphar.2008.07.063. PMID 18755179.
- ^ Сурови К.С., Ниландс Т.Р., Бьянки Б.Р., МакГараути С., Эль Коуэн Р., Хан П., Чу К.Л., Макдональд Ха, Вос М., Нифоратос В., Байбурт Е.К., Гомцян А., Ли СН, Оноре П., Салливан Дж. П., Джарвис М.Ф., Фалтинек CR (сентябрь 2008 г.). «(R) - (5-трет-бутил-2,3-дигидро-1H-инден-1-ил) -3- (1H-индазол-4-ил) мочевина (ABT-102) блокирует полимодальную активацию переходных процессов. рецепторный потенциал ваниллоидных рецепторов 1 in vitro и вызванная теплом активация нейронов спинного рога in vivo ». Журнал фармакологии и экспериментальной терапии. 326 (3): 879–88. Дои:10.1124 / jpet.108.138511. PMID 18515644. S2CID 2042292.
- ^ Gunthorpe MJ, Rami HK, Jerman JC, Smart D, Gill CH, Soffin EM, Luis Hannan S, Lappin SC, Egerton J, Smith GD, Worby A, Howett L, Owen D, Nasir S, Davies CH, Thompson M, Wyman PA, Randall AD, Davis JB (январь 2004 г.). «Идентификация и характеристика SB-366791, мощного и селективного антагониста ваниллоидных рецепторов (VR1 / TRPV1)». Нейрофармакология. 46 (1): 133–49. Дои:10.1016 / S0028-3908 (03) 00305-8. PMID 14654105. S2CID 21048603.
- ^ Патвардхан AM, Джеске Н.А., Прайс Т.Дж., Гампер Н., Акопян А.Н., Харгривз К.М. (июль 2006 г.). «Каннабиноид WIN 55,212-2 ингибирует временный рецепторный потенциал ваниллоида 1 (TRPV1) и вызывает периферическую антигипералгезию через кальциневрин». Труды Национальной академии наук Соединенных Штатов Америки. 103 (30): 11393–8. Bibcode:2006ПНАС..10311393П. Дои:10.1073 / pnas.0603861103. ЧВК 1544096. PMID 16849427.
- ^ Доэрти Е.М., Фотч К., Бо Й., Чакрабарти П.П., Чен Н., Гавва Н., Хан Н., Келли М.Г., Кинкейд Дж., Клионски Л., Лю К., Огнянов В.И., Тамир Р., Ван Х, Чжу Дж., Норман М. Х., Тринор Дж. (Январь 2005 г.). «Открытие сильнодействующих орально доступных антагонистов ваниллоидного рецептора-1. Взаимосвязь структура-активность N-арилциннамидов». Журнал медицинской химии. 48 (1): 71–90. Дои:10.1021 / jm049485i. PMID 15634002.
- ^ Ву С., Гавва Н.Р., Бреннан Т.Дж. (июнь 2008 г.). «Влияние AMG0347, антагониста рецептора типа V1 временного рецепторного потенциала, и морфина на болевое поведение после подошвенного разреза». Анестезиология. 108 (6): 1100–8. Дои:10.1097 / ALN.0b013e31817302b3. PMID 18497612.
- ^ а б Westaway SM, Brown SL, Conway E, Heightman TD, Johnson CN, Lapsley K, Macdonald GJ, MacPherson DT, Mitchell DJ, Myatt JW, Seal JT, Stanway SJ, Stemp G, Thompson M, Celestini P, Colombo A, Consonni A , Gagliardi S, Riccaboni M, Ronzoni S, Briggs MA, Matthews KL, Stevens AJ, Bolton VJ, Boyfield I, Jarvie EM, Stratton SC, Sanger GJ (декабрь 2008 г.). «Открытие биарилкарбоксамидов как новых низкомолекулярных агонистов рецептора мотилина». Письма по биоорганической и медицинской химии. 18 (24): 6429–36. Дои:10.1016 / j.bmcl.2008.10.072. PMID 19006669.
- ^ Westaway SM, Chung YK, Davis JB, Holland V, Jerman JC, Medhurst SJ, Rami HK, Stemp G, Stevens AJ, Thompson M, Winborn KY, Wright J (сентябрь 2006 г.). «N-Тетрагидрохинолинил, N-хинолинил и N-изохинолинилбиарилкарбоксамиды в качестве антагонистов TRPV1». Письма по биоорганической и медицинской химии. 16 (17): 4533–6. Дои:10.1016 / j.bmcl.2006.06.026. PMID 16806913.
- ^ Браун Б.С., Кедди Р., Чжэн Г.З., Шмидт Р.Г., Кениг Дж.Р., Макдональд Н.А., Бьянки Б.Р., Оноре П., Джарвис М.Ф., Сурови С.С., Полаковски Д.С., Марш К.С., Фалтинек К.Р., Ли СН (сентябрь 2008 г.). «Тетрагидропиридин-4-карбоксамиды как новые мощные временные антагонисты ваниллоида 1 (TRPV1) рецепторного потенциала». Биоорганическая и медицинская химия. 16 (18): 8516–25. Дои:10.1016 / j.bmc.2008.08.005. PMID 18722778.
- ^ Гор В.К., Ма В.В., Тамир Р., Гавва Н.Р., Тринор Дж.Дж., Норман М.Х. (ноябрь 2007 г.). «Исследования взаимосвязи структура-активность (SAR) замещенных аналогов имидазола как антагонистов TRPV1». Письма по биоорганической и медицинской химии. 17 (21): 5825–30. Дои:10.1016 / j.bmcl.2007.08.044. PMID 17851073.
- ^ а б Blum CA, Zheng X, Brielmann H, Hodgetts KJ, Bakthavatchalam R, Chandrasekhar J, Krause JE, Cortright D, Matson D, Crandall M, Ngo CK, Fung L, Day M, Kershaw M, De Lombaert S, Chenard BL (август 2008 г.). «Аминохиназолины как антагонисты TRPV1: модуляция свойств, подобных лекарству, посредством исследования замены в 2-м положении». Письма по биоорганической и медицинской химии. 18 (16): 4573–7. Дои:10.1016 / j.bmcl.2008.07.036. PMID 18662872.
- ^ Гавва Н.Р., Бэннон А.В., Ховланд Д.Н., Лехто С.Г., Клионски Л., Сурапанени С., Иммке, округ Колумбия, Хенли С., Арик Л., Бак А., Дэвис Дж., Эрнст Н., Хевер Дж., Куанг Р., Ши Л., Тамир Р., Ван Дж. , Ван В., Заджич Дж., Чжу Д., Норман М. Х., Луис Дж. К., Магал Е., Тринор Дж. Дж. (Октябрь 2007 г.). «Повторное введение антагонистов ваниллоидного рецептора TRPV1 ослабляет гипертермию, вызванную блокадой TRPV1». Журнал фармакологии и экспериментальной терапии. 323 (1): 128–37. Дои:10.1124 / jpet.107.125674. PMID 17652633. S2CID 8085707.
- ^ https://www.fda.gov/NewsEvents/Newsroom/PressAnnouncements/ucm191003.htm
- ^ "http://www.neurogesex.com". Архивировано из оригинал на 2009-08-30. Получено 2009-10-20. Внешняя ссылка в
| название =(помощь) - ^ http://www.bio-medicine.org
- ^ СПИД, Т. (2009). «Капсаицин: риски и преимущества». Фарм США. 7: 20.
- ^ http://www.anesiva.com В архиве 6 марта 2009 г. Wayback Machine