WikiDer > Разработка и открытие лекарств СИОЗС
Селективные ингибиторы обратного захвата серотонина, или же ингибитор обратного захвата серотонина (СИОЗС), являются классом химические соединения которые способствовали значительному прогрессу как антидепрессанты где они произвели революцию в лечении депрессия и другие психические расстройства. СИОЗС терапевтически полезны при лечении паническое расстройство (PD), пост-травматическое стрессовое растройство (ПТСР), социальное тревожное расстройство (также известная как социальная фобия), обсессивно-компульсивное расстройство (ОКР), предменструальное дисфорическое расстройство (PMDD) и анорексия. Существуют также клинические доказательства эффективности СИОЗС в лечении негативных симптомов шизофрения и их способность предотвращать сердечно-сосудистые заболевания.[1]
СИОЗС в первую очередь подавляют переносчик серотонина (SERT) в головном мозге и имеют незначительное влияние на переносчик дофамина (DAT) и переносчик норэпинефрина (СЕТЬ). Запрещение привязки нейротрансмиттер, серотонин (5-HT), к SERT приводит к увеличению концентрации 5-HT в синаптическая щель приводит к усилению связывания 5-HT с постсинаптические рецепторы что приводит к улучшению симптомов депрессии.[2]
Сегодня СИОЗС доминируют на рынке антидепрессантов.[1] и рекомендованы Национальный институт здоровья и клинического совершенства (NICE) в качестве лечения депрессии первой линии, потому что обычно у них меньше побочные эффекты чем другие типы антидепрессантов с такой же эффективностью.[3]
История развития
До открытия препаратов СИОЗС лечение расстройства настроения были относительно ограниченными. Однако сейчас есть десятки антидепрессанты на рынке для лечения депрессии.[4] Ингибиторы моноаминоксидазы (MAOI) и трициклические антидепрессанты (ТЦА) были первыми лекарствами, разработанными для лечения депрессии, появившимися еще в начале 1950-х годов. Из-за нежелательного профиля нежелательных эффектов и высокого потенциала токсичность, из-за их неизбирательного фармакологический эффекты, строгие полки были для приема лекарств, что ограничивало их применение.[4][5] Из-за этого исследователи искали другие альтернативы с аналогичной эффективностью, но с меньшим количеством побочных эффектов, например препараты, которые не вызывали нарушений сердечной проводимости при передозировке или имели тенденцию вызывать припадки,[6] что привело к открытию препаратов СИОЗС. СИОЗС являются наиболее значительным классом антидепрессантов, представленных на рынке в последние годы, и сделали одно из важнейших медицинских открытий последних нескольких десятилетий. СИОЗС были первыми лекарствами, которые, вне всяких сомнений, установили патофизиологический роль 5-HT при аффективных заболеваниях и в широком спектре тревожные расстройства. Точно так же они были первыми, кто подтвердил ингибирование нейромедиатора. повторное поглощение как важный терапевтический принцип.[1][7]
СИОЗС - это первый рационально разработанный класс психотропные препараты. Стратегия, лежащая в основе рациональный дизайн лекарств заключается в разработке нового препарата, способного воздействовать на определенные биологическая мишеньили, в данном случае, особый нервный участок действия (насосы поглощения, рецепторы), при этом пытаясь избежать воздействия на другие участки действия. Целью такой разработки является создание фармакологические агенты которые более эффективны, безопасны и лучше переносятся, чем старые лекарства.[8] Первоначальный успех был достигнут, когда медицинские химики начали поиск идеального СИОЗС с химический синтез из цимелидин (Рисунок 1) от антигистаминный препарат препарат, средство, медикамент бромфенирамин,[7] которые демонстрировали селективное ингибирование повторного захвата 5-HT с минимальным ингибированием норэпинефрин (NE) повторное поглощение. Что наиболее важно, у зимелидина не было такого профиля побочных эффектов, как у ТЦА, и поэтому он стал шаблоном для SSRI второго поколения.[5] Цимелидин был первым поступившим в продажу СИОЗС, но в нескольких случаях Синдром Гийена-Барре были связаны с использованием этого препарата, что привело к его изъятию с рынка в 1983 году. Впоследствии было обнаружено и продано несколько нетрициклических СИОЗС. Флуоксетин, который был FDA одобрен в 1987 году и обычно считается первым из имеющихся на рынке СИОЗС, проложивший путь для следующего поколения СИОЗС и считающийся своего рода прототипом.[5] Появление на рынке флуоксетина считается чудодейственным препаратом для лечения депрессии, поскольку у него меньше побочных эффектов, более простые стратегии дозирования и больший запас безопасности при использовании передозировки были потреблены, и поэтому у него была лучшая приверженность по сравнению с более старыми антидепрессантами (ТЦА и ИМАО).[5][9] С тех пор количество препаратов в классе СИОЗС увеличилось, и сейчас их шесть (флуоксетин, пароксетин, циталопрам, эсциталопрам, сертралин и флувоксамин),[4][8] как показано в Таблица 1.
Таблица 1 Препараты СИОЗС используются для лечения депрессии.
| Флуоксетин | Сертралин | Пароксетин | Флувоксамин | Циталопрам | Эсциталопрам | |
|---|---|---|---|---|---|---|
| Фармацевтические формы | Капсулы, растворимые или диспергируемые таблетки, раствор для приема внутрь | Таблетки, концентрат для перорального применения | Таблетки, суспензия для перорального применения | Таблетки, раствор для приема внутрь, капсулы | Таблетки, раствор для приема внутрь | Таблетки, раствор для приема внутрь |
| Имя бренда | Флуоксетин, Фонтекс, Серомекс, Прозак, Депекс, Серонил, Флутоп, Флуктин | Сертраль, Сертралин, Золофт, Люстрал, Асентра, Треслин | Паксетин, Сероксат, Паксил, Пароксат, Аропакс, Дероксат | Luvox | Оропрам, Циталопрам, Ципрамил, Целекса, Ципрам, Цитокс, Сепрам | Эзопрам, Эсциталопрам, Ципралекс, Лексапро, Сероплекс |
| Дата утверждения FDA | 29 декабря 1987 г.[8] | 30 декабря 1991 г.[8] | 29 декабря 1992 г.[8] | 5 декабря 1994 г. | 17 июля 1998 г.[8] | 14 августа 2002 г.[8] |
Механизм действия
Точный механизм антидепрессивной активности СИОЗС остается несколько неопределенным, но ряд биохимический установлены функции, связанные с лечением СИОЗС.[10] СИОЗС в первую очередь подавляют SERT в головном мозге и незначительно влияют на DAT и NET. СИОЗС также обладают меньшим сродством к α1, α2, H1 и мускариновый рецепторов, которые могут объяснить различия в побочных эффектах между ТЦА и СИОЗС.[5]
Хотя СИОЗС быстро попадают в мозг после приема, и их влияние на повторное поглощение 5-HT можно измерить мгновенно, для их получения требуется около 2–4 недель. терапевтические эффекты.[11] СИОЗС обладают очень высоким селективным сродством к SERT и сразу после введения ингибируют SERT.[12][13] Ингибирование SERT связано с антидепрессивной активностью СИОЗС. 70-80% ингибирование SERT обычно необходимо для того, чтобы вызвать антидепрессивный эффект, и более высокая доза не вызывает более сильного антидепрессивного эффекта для средних пациентов. Однако более высокая доза увеличивает частоту и тяжесть побочных эффектов, связанных с чрезмерным ингибированием обратного захвата 5-HT.[5]
СИОЗС предотвращают связывание 5-HT с SERT[5] который предотвращает всасывание 5-HT обратно в конечную точку пресинапса, где он метаболизируется моноаминоксидаза или хранится в секреторные пузырьки.[12] В результате концентрация 5-HT увеличивается в соматодендритной области 5-HT нейрона, но не так сильно в области терминал аксона площадь (продемонстрировано в фигура 2). Это увеличение концентрации 5-HT вызывает десенсибилизация соматодендритного 5-HT1А ауторецепторы. Когда эти 5-HT1А ауторецепторы были подавленный, они больше не будут ограничивать импульсный поток нейрона 5-HT. Включается импульсный поток, и в результате 5-HT высвобождается на терминале аксона. Однако это увеличение 5-HT происходит не быстро по сравнению с увеличением 5-HT в соматодендретической области 5-HT нейрона. Эта задержка вызвана временем, которое требуется 5-HT для подавления 5-HT.1А ауторецепторы и включают нейроимпульсный поток 5-HT нейрона. Эта задержка может объяснить причину, по которой антидепрессанты не сразу влияют на депрессию. Это также может быть причиной того, что антидепрессивные механизмы могут быть связаны с увеличивающимся потоком нейроимпульсов от 5-HT нейронов, когда концентрация 5-HT увеличивается на конце аксона, прежде чем СИОЗС начинают работать должным образом. Когда СИОЗС (1) ингибируют насос обратного захвата, (2) повышают соматодендритный 5-HT, (3) десенсибилизируют соматодендритный 5-HT1А ауторецепторы, (4) включили импульсный поток и (5) увеличили высвобождение 5-HT с конца аксона, последним шагом могла бы быть десенсибилизация постсинаптических 5-HT рецепторов. Эта десенсибилизация может быть причиной уменьшения побочных эффектов СИОЗС, поскольку толерантность развивается.[13]
Побочные эффекты
Хотя СИОЗС обычно хорошо переносятся и имеют многочисленные преимущества перед другими антидепрессантами, они не лишены побочных эффектов. Побочные эффекты СИОЗС обычно предсказуемы, исходя из их фармакологии, и зависят от дозы. К таким побочным эффектам относятся дисфункция желудочно-кишечного тракта (тошнота, понос, дискомфорт в эпигастрии), влияние на Центральная нервная система (ЦНС) (беспокойство, усталость, тремор), холинолитик последствия (сухость во рту, помутнение зрения, сонливость, затрудненное мочеиспускание) и сексуальная дисфункция (аноргазмия или же задержка эякуляции). Иногда симптомы сексуальной дисфункции сохраняются после прекращения приема СИОЗС.[14][15][16]Побочные эффекты СИОЗС обычно легкие и временные и вызывают больше дискомфорта, чем серьезную угрозу с точки зрения системной токсичности. Таким образом, профиль побочного действия СИОЗС может дать определенные терапевтические преимущества в управление депрессией.[17]
Фармакология
СИОЗС хорошо всасываются в желудочно-кишечном тракте и достигают пикового уровня в плазме в течение 1-8 часов.[18][19] Во время абсорбции СИОЗС связываются с белками и широко распределяются по всему телу, включая мозг, в то время как они являются липофильными.[20] Метаболизм и выведение происходит в основном в печени.[19] и большинство СИОЗС продуцируют фармакологически активные метаболиты,[21] как показано в таблица 3 среди других фармакологических свойств СИОЗС.
Таблица 3 Сравнительная фармакология СИОЗС
| Препарат, средство, медикамент | тМаксимум (час) | Биодоступность (%) | VD (Л / кг) | Связывание с белками (%) | т1/2 | Метаболизм | Активные метаболиты[22] | Экскреция |
|---|---|---|---|---|---|---|---|---|
| Флуоксетин | 6–8[23] | 60–80[23] | 20–45[23] | 94.5[23] | Острый прием, 1–3 дня. Хронический прием, 4–6 дней. Норфлуоксетин, острое и хроническое введение, 4–16 дней[23][24] | Обширное прохождение через печень в основном за счет CYP2D6 путем десметилирования. Нелинейный фармакокинетический профиль[9][23][25] | Норфлуоксетин | В основном (60%) моча[25] |
| Сертралин | 4.5–8.4[26] | Абсолютная биодоступность у людей не определена.[27] | 20[27] | 98[26] | 25–26 часов[24][26] | Обширное прохождение через печень в первую очередь за счет CYP2B6[26][28] | Десметил-сертралин (ограниченная активность) | Фекалии и моча в равном количестве[28] |
| Пароксетин | 6–10[29] | 30–60 | 3.1–28[29] | 93–95[29] | 21–24 часов[24][29] | Обширное прохождение через печень в первую очередь за счет CYP2D6. Нелинейный фармакокинетический профиль[9][29] | Нет клинически важных метаболитов | Моча (64%) и фекалии (36%) (с желчью)[30] |
| Флувоксамин | 3–8 | 50 | 25 | 77–80 | 15,6 часов | Печень CYP1A2 и CYP3A4 | Нет клинически важных метаболитов | В основном моча |
| Циталопрам | 2–4[31] | 80[31] | 12[31] | 50[22] | 35 часов[24][31] | Печень CYP3A4 и CYP2C19 в основном через N-деметилирование[31] | Десметил-циталопрам | 12–23% в неизмененном виде в моче и 10% в кале[31] |
| Эсциталопрам | 4–5[32] | 80[32] | 12[32] | 56[22] | 27–32 часов[24][32] | Печень CYP3A4 и CYP2C19 в основном через N-деметилирование[32] | (S) -деметилциталопрам. Не имеет клинического значения | 8–10% (эсциталопрама и (S) -деметилциталопрам (S-DCT)) в моче[32] |
тМаксимум = Время достижения пикового уровня в плазме после перорального приема; VD = Объем распределения; т1/2 = Период полувыведения
Структурные и механические различия между СИОЗС
Признано, что как позиция, так и тип замены на ароматный фрагменты соединений SSRI важны для более высокой специфичности к SERT. Галоген заместители на ароматическом кольце, как обнаружено, в значительной степени ответственны за специфичность СИОЗС к SERT, но все СИОЗС имеют в определенных положениях атомы галогена (Таблица 2). Однако для белка SERT структурная основа его специфичности в отношении SSRI плохо изучена. Исследования показали, что все галогены SSRI связываются с одним и тем же галогенсвязывающим карманом (HBP) в белке SERT, и мутация в этом HBP в SERT резко снижает сродство транспортеров к SSRI.[33]
Как упоминалось ранее, SSRI довольно разнородны в том смысле, что они также связываются с гомологичными NET и DAT, хотя и с гораздо более низким сродством, чем с их основной целью SERT. Селективность SSRI для SERT действительно интересна, когда только одного или двух заместителей различных функциональных групп достаточно для преобразования SSRI в ингибитор обратного захвата норадреналина (NRI) с более высоким сродством к NE.[33] Все антидепрессанты SSRI имеют одинаковый механизм действия и, по крайней мере, в 10 раз более избирательны в отношении ингибирования обратного захвата 5-HT, чем для ингибирования обратного захвата NE. Однако, несмотря на общий механизм действия, СИОЗС различаются по своей эффективности и селективности в ингибировании обратного захвата 5-HT, и многие из них оказывают важное влияние на другие переносчики и рецепторы. СИОЗС структурно разнообразны с явными вариациями в их фармакодинамический и фармакокинетический профилей, что приводит к различиям между ними в их полужизни, клиническая активность, побочные эффекты и лекарственные взаимодействия, что объясняет различия в их эффективности и переносимости среди пациентов.[1][8] Однако все СИОЗС клинически одинаковы, когда дело доходит до их эффективности с течением времени.[5]
Таблица 2 Сравнение химических свойств препаратов СИОЗС
| Препарат, средство, медикамент | ИЮПАК-имя | Классификация | Галоген | Специфика |
|---|---|---|---|---|
Флуоксетин 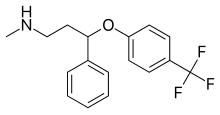 | Метил (3-фенил-3- [4- (трифторметил) фенокси] пропил) амин[23] | Флуоксетин относится к фенилпропиламинам. Они содержат фенилпропиламиновый фрагмент, который состоит из фенильной группы, замещенной у третьего атома углерода пропан-1-амином.[23] | 3F | Наименее селективный ингибитор СИОЗС. Также подавляет обратный захват NE и DA. Также влияет 5-HT2C рецепторы, CYP2D6 и CYP3A4.[8] |
Флувоксамин  | (E) - (2-аминоэтокси) ({5-метокси-1- [4- (трифторметил) фенил] пентилиден}) амин[34] | 3F | ||
Сертралин  | (1S,4S) -4- (3,4-дихлорфенил) -N-метил-1,2,3,4-тетрагидронафталин-1-амин[26] | Сертралин относится к таметралинам. Они содержат фрагмент таметралина, который состоит из тетрагидронафталина, связанного с фенильной группой с образованием N-метил-4-фенил-1,2,3,4-тетрагидронафталин-1-аминный скелет.[26] | 2Cl | Второй по эффективности ингибитор СИОЗС. Также влияет на повторный захват DA и NE.[8] |
Пароксетин  | (3S,4р)-3-[(2ЧАС-1,3-Бензодиоксол-5-илокси) метил] -4- (4-фторфенил) пиперидин[29] | Пароксетин относится к фенилпиперидинам. Они содержат фенилпиперидиновый скелет, который состоит из пиперидина, связанного с фенильной группой.[29] | F | Самый мощный блокатор обратного захвата 5-HT. Это самый мощный блокатор мускариновых рецепторов среди СИОЗС. Также влияет гистамин H1 рецепторы, синтазы оксида азота (БДУ) и CYP2D6.[8] |
Циталопрам  | 1- [3- (диметиламино) пропил] -1- (4-фторфенил) -1,3-дигидро-2-бензофуран-5-карбонитрил[31] | Циталопрам относится к бензофуранам, которые представляют собой органические соединения, содержащие бензольное кольцо, конденсированное с фураном.[31] | F | Второй по селективности ингибитор СИОЗС.[8] |
Эсциталопрам  | (1S) -1- [3- (диметиламино) пропил] -1- (4-фторфенил) -1,3-дигидро-2-бензофуран-5-карбонитрил[32] | Эсциталопрам является S-энантиомером циталопрама и, таким образом, принадлежит к тому же классу бензофуранов, к которому принадлежит циталопрам.[32] | F | Новейший и наиболее селективный ингибитор СИОЗС.[8] |
Взаимосвязь структура-деятельность (SAR)
Производные феноксифенилпропиламина
Соединения, содержащие мотив арилоксипропиламина в своей структуре, продемонстрированной в рисунок 3а, известны как ингибиторы обратного захвата моноаминов. Лекарства, содержащие этот привилегированный структурный мотив, где R1 и R2 находятся арилы или гетероарилы, предпочтительно фенил, обладают профилем селективности в отношении NET и SERT.[35] В то время как соединения, содержащие заместитель в 2'-положении ароксильного кольца структуры (рисунок 3b) проявляет селективность и высокое сродство к NET, и поэтому обычно ИОНИС, соединения, имеющие заместитель в 4'-положении, проявляют селективность и высокое сродство к SERT и поэтому обычно являются SSRI, например флуоксетин и пароксетин.[36]
Флуоксетин это рацемическая смесь из (р)- и (S) -флуоксетин, оба энантиомера которого способствуют его биологической активности.[37] Поскольку монозамещение в 4-пара-положении феноксигруппы (фигура 4) приводит к селективному ингибированию повторного захвата 5-HT, дизамещение, то есть 2,3- или 2,4-замена, следовательно, приводит к потере селективности SERT.[5] Флуоксетин имеет самый широкий спектр действия, поскольку он наименее селективен к SERT из всех СИОЗС. Флуоксетин также имеет 5-HT2C антагонистическая активность, когда он блокирует 5-HT активность 5-HT2C рецепторы, усиливающие высвобождение как NE, так и DA. 5-HT2C Антагонисты помогают не только терапевтическими эффектами флуоксетина, но и переносимостью препарата. Преимущество 5-HT2C антагонистом является то, что он оказывает стимулирующее действие, и многие пациенты испытали повышение энергии, концентрации и внимания, а также снижение утомляемости с самой первой дозы. Стимулирующая активность 5-HT2C Однако антагонист может быть недостатком для пациентов с возбуждением, бессонницей и тревогой. Другой особенностью флуоксетина является слабое ингибирование обратного захвата NE, которое может иметь клинический эффект в более высоких дозах. Флуоксетин также имеет длительный период полувыведения, что может уменьшить симптомы отмены, характерные для некоторых СИОЗС после резкого прекращения приема, но это также означает, что для выведения препарата и его активного метаболита после прекращения лечения флуоксетином требуется много времени.[13]
Пароксетин это ограниченный структурный аналог флуоксетина, где линейная фенилпропиламин группа флуоксетина была свернута в пиперидин звенеть (цифра 5). Комплекс имеет возможность четырех стереоизомеры потому что он содержит два хиральные центры, но один из них, (3S,4р) -изомер, продается как пароксетин. Исследования показали, что стереохимические факторы влияют на сродство молекулы к SERT, где замещение в 2-орто-положение любого ароматического кольца снижает сродство к SERT крысы в 10–100 раз, причем наибольшая потеря происходит в феноксильном кольце.[5]
Пароксетин является наиболее сильнодействующим из имеющихся препаратов СИОЗС, но он менее селективен в отношении SERT, чем флувоксамин и сертралин.[38] Пароксетин также имеет слабое ингибирование NET, что может способствовать его эффективности при депрессии, особенно в более высоких дозах. Как показано в Таблица 2Пароксетин также ингибирует фермент NOS, что может быть причиной его неблагоприятного воздействия на сексуальную дисфункцию, особенно у мужчин.[13] Пароксетин показывает самое высокое сродство к мускариновым рецепторам из всех СИОЗС, что приводит к слабой антихолинергической активности и, следовательно, к нежелательным побочным эффектам.[39]
Пока ученые пытались создать новый антидепрессант для ингибирования повторного поглощения NE, они случайно синтезированный два новых соединения, названные талопрам и талсупрам. Эти два соединения не поступали в продажу, несмотря на то, что они являются мощными СИОЗСН, поскольку в ходе клинических испытаний сообщалось о нескольких попытках самоубийства. С небольшими изменениями химической структуры талопрама (рисунок 6), включая единственную замену 6-циано (CN), ученые смогли превратить талопрам в мощный СИОЗС, называемый циталопрам. Но циталопрам также можно рассматривать как ограниченный аналог пароксетина.[5]
Циталопрам занимает второе место по селективности в отношении SERT, не влияет на повторный захват NE или DA и не имеет сродства с другими нейрорецепторами.[5] Циталопрам состоит из двух энантиомеров, (р)- и (S) -, которые являются зеркальным отображением друг друга (рисунок 7). Исследования показали, что почти вся деятельность сосредоточена в (S) -энантиомер и что (р) -циталопрам фактически противодействует действию (S) -энантиомер. Комбинация двух энантиомеров известна как рацемический циталопрам и обладает слабыми антигистаминными свойствами, которые находятся в (р) -энантиомер. Решением для улучшения свойств рацемического циталопрама является удаление нежелательных (р) -энантиомер. Полученный препарат более известен как эсциталопрам, но он состоит только из чистого активного (S) - (+) - изомер. Это изменение, по-видимому, устраняет антигистаминные свойства препарата. Удалив (р) -энантиомер, самая низкая доза эсциталопрама становится более эффективной и начинает действовать быстрее, чем сопоставимая доза циталопрама, где эсциталопрам в два раза активнее циталопрама и по крайней мере в 27 раз сильнее, чем (р) -энантиомер.[5] Таким образом, эсциталопрам является единственным препаратом СИОЗС, для которого чистое ингибирование SERT отвечает почти за все его фармакологические действия. Эсциталопрам - новейший и наиболее селективный ингибитор СИОЗС, и сегодня он считается наиболее переносимым СИОЗС.[5][13]
Производные аминотетралина
Таметралин, соединение, синтезированное в 1978 г. PfizerИсследования на животных показали, что он является мощным ингибитором обратного захвата NE и DA.[5] Позже было достигнуто неожиданно существенное усиление блокирующей активности захвата 5-HT путем добавления атомов хлора в C-3 и C-4 к структуре таметралина, что привело к (+) -транс-(1р,4S)-N-метил-4-фенил-1-аминотетралин, мощный, но неселективный блокатор захвата. Знак (+) -СНГ-(1S,4S) -изомер, один из четырех диастереомеров соединений, однако проявлял значительно более селективную и сильную ингибирующую активность в отношении захвата 5-HT по сравнению с тремя другими диастереомерами, где 4-фенильное кольцо способствует присоединению в сайтах захвата 5-HT. Соединению присвоено название сертралин (цифра 8).[5][40] Хотя сертралин структурно отличается от других СИОЗС, у него есть фениламинотетралин в его структуре, в которой ядро дифенилпропиламина было вынуждено в жесткое бициклический кольцевая система.[5]
Сертралин является вторым наиболее мощным ингибитором обратного захвата 5-HT, который имеет две очень интересные характеристики, которые его различают, а именно: (1) ингибирующее действие сертралина на DAT и NET и (2) связывание с сигма-1 (σ1) рецептор в ЦНС.[13] Ингибирование DAT и NET является спорным из-за гораздо более слабого ингибирования, которое оно имеет, по сравнению с ингибированием SERT. Сертралин имеет примерно в 60 раз более сильный потенциал ингибирования 5-HT, чем обратный захват NE или DA. Возможно, что требуется лишь умеренное ингибирование DAT и NET, чтобы вызвать повышение энергии, мотивации и концентрации, особенно при добавлении к другой активности, такой как ингибирование SERT.[13] Также было обнаружено, что сертралин обладает высоким сродством к?1 рецепторы. Роль σ1 сайт в фармакологическом действии сертралина может существовать, но значение сродства сертралина для σ1 рецепторы остаются неясными.[41]
Связывание СИОЗС с белком SERT
Молекулярные основы функции СИОЗС, включая их способ связывания и молекулярный механизм ингибирования обратного захвата 5-HT в SERT, полностью не изучены и являются предметом дискуссий. Такая информация очень важна для понимания основных аспектов действия лекарств, начиная от профиля селективности до терапевтической эффективности, и для разработки новых и улучшенных лекарств, нацеленных на SERT человека.[42]
Трехмерная (3D) структура SERT неизвестна и является основным препятствием для выяснения структурного механизма SERT человека. Сравнительная степень молекулярное моделирование были использованы в исследованиях для создания структурных моделей SERT человека в комплексе с его лигандом, но не дали хороших результатов из-за низкого филогенетического и функционального сходства между SERT человека и доступными матричными белками.[42] Однако известна трехмерная структура некоторых бактериальных гомологичных переносчиков, таких как переносчик лейцина (LeuT). Все человеческие SERT, NET и DAT являются членами семейства нейротрансмиттер: симпортер натрия (NSS). SERT содержит примерно 630 аминокислот, которые, по прогнозам, образуют 12 трансмембранные альфа-спирали (TM), которые связаны с внутри- и внеклеточными петлями (IL и EL).[33][43] LeuT, который также является членом семейства NSS, который функционирует как переносчик аминокислот,[33] кристаллизовался из Aquifex aeolicus Ямашита и др.,[44] и разделяет 20-25% идентичности в первичная структура с человеком переносчики нейротрансмиттеров. Следовательно Кристальная структура LeuT и его транспортный механизм оказались хорошей модельной системой для изучения белков NSS.[33] Хотя детальный транспортный механизм белков NSS полностью не изучен, ясно, что для того, чтобы транспорт произошел, должна иметь место перестройка больших белков.[43]
LeuT был совместно кристаллизованный с сертралином и (р)- и (S) -флуоксетин, где было обнаружено, что СИОЗС связываются как неконкурентные ингибиторы в сайте связывания преддверия (может рассматриваться как второй сайт связывания), который отделен от сайта связывания лекарственного средства цепями сайтов двух ароматических аминов. кислоты внеклеточных ворот транспортного белка.[33][43] Все галогены в химической структуре SSRI связываются с одним и тем же HBP в LeuT и взаимодействуют с аналогичными аминокислотами, но аминокислотная последовательность в HBP хорошо сохраняется между LeuT и SERT. Это предполагает, что в человеческом SERT SSRI также связываются как в одном положении, так и аналогичным образом, что является ключевой особенностью, делающей SSRI селективными для SERT. И наоборот, могут быть различия в их связывании, когда другая часть молекулы лекарства, вероятно, будет связываться с SERT по-другому, учитывая разнообразие в их структуре.[33] Локализация сайта вестибулярного связывания, как сайт первичного СИОЗС связывания в SERT является, однако спорной, так как некоторые исследования показали, что работа СИОЗСА в конкурсной основе путем связывания с препаратами связывания сайта, а не на второй сайт связывания.[43]
Связывание флуоксетина с белком LeuT
Оба энантиомера флуоксетина проявляют аналогичное сродство к SERT. Однако селективное соотношение NE: 5HT создает впечатление, что (S) -энантиомер в 100 раз более селективен в отношении ингибирования SERT, чем (р) -энантиомер. (р) - (+) - стереоизомер почти в 8 раз более мощный ингибитор SERT вместе с большей продолжительностью действия, чем (S) - (-) - изомер. (S) - (-) - метаболит норфлуоксетина в семь раз более мощный ингибитор транспортера 5-HT, чем (р) - (+) - метаболит, с коэффициентом селективности, почти эквивалентным (S) -флуоксетин.[5]
Оба энантиомера флуоксетина связываются с внеклеточным вестибулем на белке LeuT таким образом, что три атома фтора метилфеноксильного кольца связываются с HBP, который образуется Leu25, Gly26, Leu29, Arg30 и Tyr108. Галогены дополнительно делают Взаимодействие Ван-дер-Ваальса с Leu29 и Tyr108, где (S) -энантиомер дополнительно связывается с Phe253 и заставляет Ван-дер-Ваальс контактировать с ним среди ранее упомянутых аминокислот. Из-за (S) -энантиомеры, противоположные хиральности (р) -энантиомер, остальная часть молекулы обращена в HBP, где аминный хвост указывает в сторону внеклеточного пространства и взаимодействует с N-конца Leu400, Asp401 и Ala319 (аминокислоты, входящие в состав TM10). В этой форме LeuT-границы комплекс довольно жесткий. Метилфеноксильное кольцо вращается вокруг связи O5-C6 на 46 градусов для (р) -энантиомер и 16 градусов для (S) -энантиомер, но жесткость молекулярной структуры указывает на то, что лекарство сохраняет свою низкоэнергетическую конфигурацию при связывании со своим белком-мишенью.[33]
Связывание сертралина с белком LeuT
Серталин связывается с тем же внеклеточным вестибюлем в LeuT, что и флуоксетин, где два атома хлора на фенильном кольце связываются с HBP, образованным Leu25, Gly26, Leu29, Arg30, Tyr108, Ile111 и Phe253. Галогены дополнительно связывают Ван-дер-Ваальс с Leu29, Tyr108 и Phe253. Тетралин (тетрагидронафталин) на другом конце структуры сертралина находится в контакте с Leu400, Asp401 и Thr409 (которые являются частью TM10), а также молекула взаимодействует с Ala319 петли шпильки EL4 и Arg30 и Gin34 TM1. , где аминный хвост направлен в сторону цитоплазмы. Связанная молекула сертралина имеет дихлорфенильное кольцо, повернутое вокруг связи C4-C13 на 180 градусов по сравнению со свободным лекарственным средством.[33]
Связывание эсциталопрама с белком SERT человека
Андерсен и др. смогли создать модель (S) сайт связывания циталопрама в SERT человека путем комбинирования мутационного анализа и сравнительного моделирования, где они обнаружили, что Asn-177 и Phe-341 являются ключевыми детерминантами для (S) эффективность -циталопрам и ингибирование с высокой аффинностью[42] в дополнение к Tyr-95, Asp-98, Ile-172 и Ser438, описанным ранее, где три функциональные группы в структуре ингибиторов связываются с аминокислотами-переносчиками. (S) -циталопрам позиционируется как цианофталан-. Фторфенильные и метиламиноппильные фрагменты занимают три разных субпакета внутри кармана связывания SERT. Ile-172 и Phe-341, вероятно, не находятся в прямом контакте с молекулой лекарственного средства, но они очень важны для контроля выравнивания ингибитора.[42]
Что было после СИОЗС?
В нейтралитет этой статьи оспаривается. (Июнь 2016) (Узнайте, как и когда удалить этот шаблон сообщения) |
После открытия СИОЗС возрос интерес к новым антидепрессантам с более широким механизмом действия.[нужна цитата] Венлафаксин (Эффексор) был представлен в 1993 году как первый препарат в ИОНИИ (ингибитор обратного захвата серотонина-норадреналина) класс антидепрессантов. SNRIs отличаются от SSRI тем, что они блокируют повторный захват как 5-HT, так и NE.[45][46] Сегодня СИОЗС наряду с СИОЗС являются наиболее широко используемыми антидепрессантами.[47] В некоторых исследованиях СИОЗС продемонстрировали немного более высокую антидепрессивную эффективность, чем СИОЗС (частота ответа 63,6% против 59,3%).[48] До сих пор ведутся споры о том, являются ли СИОЗС более эффективными, чем СИОЗС.[49]
Смотрите также
- Серотонин
- Селективные ингибиторы обратного захвата серотонина
- Ингибиторы обратного захвата моноаминов
- Антидепрессант второго поколения
- Ингибиторы обратного захвата серотонина-норэпинефрина
Рекомендации
- ^ а б c d Spinks, D .; Спинкс, Г. (2002). Ингибирование обратного захвата серотонина: обновленная информация о текущих исследовательских стратегиях. Современная лекарственная химия. 9. С. 799–810. Дои:10.2174/0929867024606795. ISBN 9781608052042. PMID 11966445. Получено 24 октября 2014.
- ^ Шталь, Стивен М. (1998). «Механизм действия селективных ингибиторов обратного захвата серотонина: рецепторы и пути серотонина опосредуют терапевтические эффекты и побочные эффекты». Журнал аффективных расстройств. 51 (3): 215–235. Дои:10.1016 / S0165-0327 (98) 00221-3. PMID 10333979.
- ^ Национальный институт здоровья и клинического совершенства. «Депрессия у взрослых: лечение и лечение депрессии у взрослых». Национальный институт здоровья и клинического совершенства. Получено 30 октября 2014.
- ^ а б c Фицпатрик, Лаура (07.01.2010). «Краткая история антидепрессантов». Время. Получено 19 октября 2014.
- ^ а б c d е ж грамм час я j k л м п о п q р Lemke, Thomas L .; Уильямс, Дэвид А. (2008). Принципы медицинской химии Фуа (6-е изд.). Филадельфия: Липпинкотт Уильямс и Уилкинс. С. 568–600.
- ^ Фергюсон, Джеймс М. (2001). «Антидепрессанты СИОЗС: побочные эффекты и переносимость». Помощник по первичной медико-санитарной помощи журнала клинической психиатрии. 3 (1): 22–27. Дои:10.4088 / pcc.v03n0105. ЧВК 181155. PMID 15014625.
- ^ а б Карлссон, Арвид. «Открытие СИОЗС: веха в нейропсихофармакологии и рациональном дизайне лекарств» (PDF). landesbioscience.com. Laned Bioscience. Архивировано из оригинал (PDF) на 2014-10-20. Получено 20 октября 2014.
- ^ а б c d е ж грамм час я j k л м «Сравнение селективных ингибиторов обратного захвата серотонина (СИОЗС)». emedexpert.com. eMedExpert. Получено 19 октября 2014.
- ^ а б c Ciraulo, D.A .; Shader, R.I .; Гринблатт, Д.Дж. (2011). Клиническая фармакология и терапия антидепрессантов. Фармакотерапия депрессии, второе издание. С. 33–124. Дои:10.1007/978-1-60327-435-7_2. ISBN 978-1-60327-434-0.
- ^ Фишер Дж. И Ганеллин К. Р. (2010). Открытие лекарств на основе аналогов II. Джон Вили и сыновья. С. 269–270.CS1 maint: несколько имен: список авторов (связь)
- ^ Сарбадхикари, С. Н. (2005). Депрессия и деменция: прогресс в исследованиях мозга, клиническое применение и будущие тенденции. Nova Publishers. п. 195.
- ^ а б Шацберг, А. Ф., и Немерофф, К. Б. (2009). Американский психиатрический учебник психофармакологии.. Американский психиатрический паб. С. 353–355.CS1 maint: несколько имен: список авторов (связь)
- ^ а б c d е ж грамм Шталь, С. М. (2013). Основная психофармакология Шталя: нейробиологические основы и практическое применение. Пресса Кембриджского университета. С. 290–300.
- ^ Бахрик, Одри (2008). «Сохранение побочных эффектов сексуальной дисфункции после прекращения приема антидепрессантов: новые доказательства» (PDF). Журнал открытой психологии. 1: 42–50. Дои:10.2174/1874350100801010042. Архивировано из оригинал (PDF) 19 октября 2013 г.. Получено 30 января 2014.
- ^ Вальдингер, доктор медицины (2015). «Психиатрические расстройства и сексуальная дисфункция». Неврология половых заболеваний и заболеваний мочевого пузыря. Справочник по клинической неврологии / Под редакцией Давида Б. Водушека и Франсуа Боллера. Справочник по клинической неврологии. 130. С. 469–89. Дои:10.1016 / B978-0-444-63247-0.00027-4. ISBN 9780444632470. PMID 26003261.
- ^ http://pi.lilly.com/us/prozac.pdf Стр.14.
- ^ Дэвид Болдуин; Шелдон Прескорн (январь 1995 г.). «СИОЗС: преимущества, недостатки и отличия». Журнал психофармакологии. 9 (2 приложение): 163–178. Дои:10.1177/0269881195009002011. PMID 22297235. S2CID 21474009.
- ^ Zahajszky, J; Rosenbaum, J. F .; Толлефсон, Г. Д. (2009). Американский психиатрический издательский учебник психофармакологии (4-е изд.). Вашингтон, округ Колумбия: American Psychiatric Publishing, Inc., стр. 289.
- ^ а б Прескорн, С. Х. (1997). «Клинически значимая фармакология селективных ингибиторов обратного захвата серотонина - обзор с акцентом на фармакокинетику и влияние на окислительный метаболизм лекарств». Клиническая фармакокинетика.. 32 (Приложение 1): 1–21. Дои:10.2165/00003088-199700321-00003. PMID 9068931. S2CID 43164418.
- ^ Безчлибник-Батлер, Калина З .; Джеффрис, Дж Джоэл (2014). Клинический справочник психотропных препаратов (20-е изд.). Бостон: Издательство Hogrefe. С. 3–14. ISBN 978-1-61676-451-7. Получено 21 октября 2014.
- ^ Aboujaoude, E; Коран, Л. М. (2009). Американский психиатрический учебник по психофармакологии (4-е изд.). Вашингтон, округ Колумбия: American Psychiatric Publishing, Inc., стр. 353.
- ^ а б c Чирауло, Доминик А. (2006). Лекарственные взаимодействия в психиатрии (3-е изд.). Балтимор: Липпинкотт Уильямс и Уилкинс. п. 95. ISBN 9780781748179. Получено 29 октября 2014.
- ^ а б c d е ж грамм час «Флуоксетин». Drugbank.ca. DrugBank. Получено 19 октября 2014.
- ^ а б c d е Хиемке, Кристоф; Харттер, Себастьян (2000). «Фармакокинетика селективных ингибиторов обратного захвата серотонина». Фармакология и терапия. 85 (1): 11–28. Дои:10.1016 / S0163-7258 (99) 00048-0. PMID 10674711.
- ^ а б Европейское агентство по лекарственным средствам. «Краткое описание характеристик продукта» (PDF). Получено 29 октября 2014.
- ^ а б c d е ж «Сертралин». Drugbank.ca. DrugBank. Получено 19 октября 2014.
- ^ а б Сеть токсикологических данных. «Сетралин». Получено 29 октября 2014.
- ^ а б Европейское агентство по лекарственным средствам. «Краткое описание характеристик продукта» (PDF). Получено 29 октября 2014.
- ^ а б c d е ж грамм «Пароксетин». Drugbank.ca. DrugBank. Получено 19 октября 2014.
- ^ Электронный сборник лекарств (eMC). «Краткое описание характеристик продукта». Получено 29 октября 2014.
- ^ а б c d е ж грамм час «Циталопрам». Drugbank.ca. DrugBank. Получено 19 октября 2014.
- ^ а б c d е ж грамм час «Эсциталопрам». Drugbank.ca. DrugBank. Получено 19 октября 2014.
- ^ а б c d е ж грамм час я Чжоу, Чжэн; Чжэнь, Хуан; Карпович, Натан К .; Закон, Кристофер Дж .; Reith, Maarten E.A .; Ван, Да-Ненг (2009). «Антидепрессивная специфичность транспортера серотонина, предложенная тремя структурами LeuT-SSRI». Структурная и молекулярная биология природы. 16 (6): 652–657. Дои:10.1038 / nsmb.1602. ЧВК 2758934. PMID 19430461.
- ^ «Флувоксамин». Drugbank.ca. DrugBank. Получено 19 октября 2014.
- ^ Бут, Джон; и другие. (2005). «Открытие и взаимосвязь между структурой и активностью нового селективного норадреналина и двойных ингибиторов обратного захвата серотонина / норадреналина». Письма по биоорганической и медицинской химии. 15 (3): 699–703. Дои:10.1016 / j.bmcl.2004.11.025. PMID 15664840.
- ^ Mahaney, Paige E .; и другие. (2006). «Синтез и активность нового класса ингибиторов обратного захвата норэпинефрина и серотонина двойного действия: 3- (1H-индол-1-ил) -3-арилпропан-1-аминов». Биоорганическая и медицинская химия. 14 (24): 8455–8466. Дои:10.1016 / j.bmc.2006.08.039. PMID 16973367.
- ^ Оуэнс, Майкл Дж .; Knight, Дэвид Л .; Намерофф, Чарльз Б. (2001). "СИОЗС второго поколения: профиль связывания переносчика моноаминов человека эсциталопрама и R-флуоксетина". Биологическая психиатрия. 50 (5): 345–350. Дои:10.1016 / S0006-3223 (01) 01145-3. PMID 11543737. S2CID 11247427.
- ^ Мозаяни А. и Раймон Л. (2011). Справочник лекарственных взаимодействий: клиническое и судебно-медицинское руководство. Springer. п. 216.CS1 maint: несколько имен: список авторов (связь)
- ^ Fujishiro, J .; Иманиши, Т .; Onozawa, K .; Цусима, М. (2002). «Сравнение антихолинергических эффектов серотонинергических антидепрессантов, пароксетина, флувоксамина и кломипрамина». Европейский журнал фармакологии. 454 (2–3): 183–188. Дои:10.1016 / s0014-2999 (02) 02557-8. PMID 12421645.
- ^ Ко, Б. Кеннет; Вайсман, Альберт; Уэлч, Уиллард М .; Браун, Рональд Г. (1983). «Серталин, 1S, 4S-N-метил-4- (3,4-дихлорфенил) -1,2,3,4-тетрагидро-1-нафтиламин, новый ингибитор поглощения с селективностью в отношении серотонина» (PDF). Журнал фармакологии и экспериментальной терапии. 226 (3): 686–700. PMID 6310078. Архивировано из оригинал (PDF) 4 марта 2016 г.. Получено 22 октября 2014.
- ^ Гленда Маккуин; Лесли Борн; Меир Штайнер (2001). «Селективный ингибитор обратного захвата серотонина сертралин: его профиль и использование при психиатрических расстройствах». Обзоры препаратов для ЦНС. 7 (1): 1–24. Дои:10.1111 / j.1527-3458.2001.tb00188.x. ЧВК 6741657. PMID 11420570.
- ^ а б c d Андерсен, Дж .; Olsen, L .; Hansen, K.B .; Taboureau, O .; Jorgenssen, F.S .; Jorgenssen, A.M .; Bang-Andersen, B .; Egebjerg, J .; Stromgaard, K .; Кристенсен, А. (2010). «Мутационное картирование и моделирование сайта связывания для (S) -циталопрама в транспортере серотонина человека». Журнал биологической химии. 285 (3): 2051–2063. Дои:10.1074 / Jbc.M109.072587. ЧВК 2804362. PMID 19892699.
- ^ а б c d Gabrielsen, M .; Kurczab, R .; Ravna, A.W .; Куфарева, И .; Абагян, Р .; Chilmonczyk, Z .; Bojarski, A.J .; Силте, И. (2012). «Молекулярный механизм ингибирования переносчика серотонина выяснен с помощью нового гибкого протокола стыковки». Европейский журнал медицинской химии. 47 (1): 24–37. Дои:10.1016 / Я.Эймех.2011.09.056. ЧВК 3357065. PMID 22071255.
- ^ Ямасита, А .; Сингх, С.К .; Kawate, T .; Jin, Y .; Гуо, Э. (2005). «Кристаллическая структура бактериального гомолога Na + / Cl - зависимых переносчиков нейромедиаторов». Природа. 437 (7056): 215–223. Дои:10.1038 / природа03978. PMID 16041361. S2CID 4420334.
- ^ Гутьеррес, Массачусетс; Stimmel, GL; Айсо, JY (2003). «Венлафаксин: обновление 2003 года». Клиническая терапия. 25 (8): 2138–54. Дои:10.1016 / s0149-2918 (03) 80210-2. PMID 14512125.
- ^ Гонсалес Руэлас, Энрике; Диас-Мартинес, Алехандро; Мартинес Руис, Рене (1997). «Открытая оценка приемлемости, эффективности и переносимости венлафаксина в обычных условиях оказания медицинской помощи». Текущие терапевтические исследования. 58 (9): 609–630. Дои:10.1016 / S0011-393X (97) 80088-4.
- ^ «200 лучших брендовых препаратов по общему количеству рецептов 2009 г.» (PDF). SDI / Verispan, VONA, полный 2009 г.. www.drugtopics.com. Архивировано из оригинал (PDF) 15 декабря 2012 г.. Получено 6 апреля 2011.
- ^ Папакостас, G .; Thase, M .; Fava, M .; Nelson, J .; Шелтон, Р. (2007). «Являются ли антидепрессанты, сочетающие серотонинергический и норадренергический механизмы действия, более эффективными, чем селективные ингибиторы обратного захвата серотонина, при лечении большого депрессивного расстройства? Метаанализ исследований новых агентов». Биологическая психиатрия. 62 (11): 1217–1227. Дои:10.1016 / j.biopsych.2007.03.027. PMID 17588546. S2CID 45621773.
- ^ Thase, ME (2008). «Являются ли СИОЗС более эффективными, чем СИОЗС? Обзор текущего состояния противоречий». Бюллетень Psychopharmacol. 41 (2): 58–85. PMID 18668017.








