WikiDer > Мегабат
| Мегабат | |
|---|---|
 | |
| Колония маленькие красные летучие лисицы (Pteropus scapulatus) | |
| Научная классификация | |
| Королевство: | Animalia |
| Тип: | Хордовые |
| Учебный класс: | Млекопитающие |
| Заказ: | Рукокрылые |
| Надсемейство: | Pteropodoidea |
| Семья: | Pteropodidae серый, 1821 |
| Подсемейства | |
 | |
| Раздача мегабатов | |
| Синонимы | |
Pteropidae (Серый, 1821)[1] | |
Мегабатс составляют семья Pteropodidae из порядок Рукокрылые (летучие мыши). Их еще называют фруктовые летучие мыши, Летучие мыши Старого Света, или - особенно роды Acerodon и Птеропус—летучие лисы. Они единственные члены надсемейство Pteropodoidea, которое является одним из двух суперсемейств в подотряд Yinpterochiroptera. Внутреннее деление Pteropodidae изменилось с тех пор. подсемейства были впервые предложены в 1917 году. Из трех подсемейств в классификации 1917 года в настоящее время распознаются шесть, а также различные племена. По состоянию на 2018 год 197 разновидность мегабата были описаны.
Понимание эволюции мега-летучих мышей было определено в первую очередь генетическими данными, поскольку ископаемое Рекорд для этого семейства является наиболее фрагментированным из всех летучих мышей. Вероятно, они эволюционировали в Австралазия, с общим предком всех ныне живущих птероподидов, существовавшим примерно 31 миллион лет назад. Многие из их родословных, вероятно, произошли от Меланезия, затем со временем распространились в материковую Азию, Средиземноморье, и Африка. Сегодня они встречаются в тропических и субтропических районах Евразии, Африки и Океания.
Семейство мегабатов включает в себя самых крупных видов летучих мышей: особи некоторых видов весят до 1,45 кг (3,2 фунта) и имеют размах крыльев до 1,7 м (5,6 фута). Не все мега-летучие мыши крупногабаритные; почти треть всех видов весит менее 50 г (1,8 унции). Их можно отличить от других летучих мышей по их собачьим мордам, когтистым вторым пальцам и уменьшенным уропатагиум. Только представители одного рода, Notopteris, есть хвосты. У мегабатов есть несколько приспособлений к полету, в том числе быстрое потребление кислорода, способность выдерживать частота пульса более 700 ударов в минуту и большие объемы легких.
Большинство мегабатов ночной образ жизни или же сумеречный, хотя некоторые виды активны в дневное время. В период бездействия они устраиваются на ночлег на деревьях или в пещерах. Члены некоторых видов обитают в одиночестве, в то время как другие образуют колонии до миллиона особей. В период активности употребляют полет путешествовать по пищевым ресурсам. За некоторыми исключениями они не могут эхолоцироватьвместо этого полагаясь на острое зрение и обоняние, чтобы ориентироваться и находить пищу. Большинство видов в первую очередь плодоядный и несколько нектароядный. Другие менее распространенные пищевые ресурсы включают листья, пыльцу, веточки и кору.
Они медленно достигают половой зрелости и имеют низкую репродуктивную способность. Большинство видов рожают по одному потомству после беременности продолжительностью от четырех до шести месяцев. Такой низкий уровень воспроизводства означает, что после потери популяции их численность медленно восстанавливается. Четверть всех видов указаны как под угрозой, в основном из-за разрушение среды обитания и охота. Мегабаты являются популярным источником пищи в некоторых районах, что приводит к сокращению численности населения и вымиранию. Они также интересны тем, кто занимается общественный здоровье как они есть естественные водоемы нескольких вирусов, которые могут поражать человека.
Таксономия и эволюция
Таксономическая история
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Внутренние отношения африканских Pteropodidae, основанные на совокупных доказательствах митохондриальный и ядерный ДНК. По одному виду Pteropodinae, Nyctimeninae и Cynopterinae, которые не встречаются в Африке, были включены как аутгруппы.[2] |
Семейство Pteropodidae было впервые описано в 1821 году британским зоологом. Джон Эдвард Грей. Он назвал семейство Pteropidae (в честь рода Птеропус) и поместил его в ныне несуществующий отряд Fructivorae.[3] Fructivorae содержали еще одно семейство, ныне несуществующие Cephalotidae, содержащие один род, Цефалоты[3] (теперь признано синонимом Добсоня).[4] Правописание Грея, возможно, было основано на неправильном понимании суффикса "Птеропус".[5] "Птеропус" происходит от Древнегреческий "птерон"что означает" крыло "и"poús"значение" стопы ".[6] Греческое слово поус из Птеропус происходит от основного слова под-; поэтому латинизация Птеропус правильно приводит к префиксу "Птероподы".[7]:230 Французский биолог Шарль Люсьен Бонапарт был первым, кто использовал исправленное написание Pteropodidae в 1838 году.[7]:230
В 1875 г. ирландский зоолог Джордж Эдвард Добсон первым разделил отряд рукокрылых (летучих мышей) на два подзаказы: Megachiroptera (иногда обозначается как Macrochiroptera) и Микрохироптеры, которые обычно сокращенно обозначают мегабаты и микробаты.[8] Добсон выбрал эти имена, чтобы указать на различия в размерах тела этих двух групп, при этом многие летучие мыши, питающиеся фруктами, были крупнее летучих мышей, питающихся насекомыми. Pteropodidae были единственной семьей, которую он включил в Megachiroptera.[5][8]
Исследование, проведенное в 2001 году, показало, что дихотомия гигантских летучих мышей и микрокрылых неточно отражает их эволюционные отношения. Вместо Megachiroptera и Microchiroptera авторы исследования предложили новые подотряды. Yinpterochiroptera и Янгочироптеры.[9] Впоследствии эта классификационная схема проверялась несколько раз и по-прежнему широко поддерживается по состоянию на 2019 год.[10][11][12][13] С 2005 года этот подотряд также называют «Pteropodiformes».[7]:520–521 Yinpterochiroptera содержала виды, ранее входившие в состав Megachiroptera (все Pteropodidae), а также несколько семейств, ранее входивших в состав Microchiroptera: Megadermatidae, Ринолофиды, Nycteridae, Craseonycteridae, и Ринопоматиды.[9] Два надсемейства включают Yinpterochiroptera: Rhinolophoidea - содержащие вышеупомянутые семейства, ранее относившиеся к Microchiroptera, - и Pteropodoidea, которые содержат только Pteropodidae.[14]
В 1917 г. датский маммолог Кнуд Андерсен разделила Pteropodidae на три подсемейства: Macroglossinae, Pteropinae (исправлено на Pteropodinae) и Harpyionycterinae.[15]:496 Исследование 1995 года показало, что Macroglossinae, как было определено ранее, содержащие роды Eonycteris, Notopteris, Макроглосс, Syconycteris, Мелониктерис, и Megaloglossus, был парафилетический, что означает, что подсемейство не объединяет всех потомков общего предка.[16]:214 Последующие публикации рассматривают Macroglossini как племя внутри Pteropodinae, которое содержит только Макроглосс и Syconycteris.[17][18] Eonycteris и Мелониктерис входят в состав других племен Pteropodinae,[2][18] Megaloglossus был помещен в трибу Myonycterini подсемейства Rousettinae, а Notopteris неопределенного размещения.[18]
Другие подсемейства и трибы внутри Pteropodidae также претерпели изменения после публикации Андерсена 1917 года.[18] В 1997 г. птероподиды были разделены на шесть подсемейств и девять племен в зависимости от их вида. морфология, или физические характеристики.[18] Генетическое исследование 2011 года пришло к выводу, что некоторые из этих подсемейств были парафилетическими, и поэтому они неточно отображали взаимоотношения между видами мегабатонов. Поддержку получили три подсемейства, предложенных в 1997 г. на основании морфологии: Cynopterinae, Harpyionycterinae и Nyctimeninae. Остальные три клады восстановленные в этом исследовании состояли из Macroglossini, Epomophorinae + Rousettini и Pteropodini + Мелониктерис.[18] Генетическое исследование 2016 года, сосредоточенное только на африканских птероподидах (Harpyionycterinae, Rousettinae и Epomophorinae), также бросило вызов классификации 1997 года. Все виды, ранее входившие в Epomophorinae, были перемещены в Rousettinae, которая была разделена на дополнительные трибы. Род Эйдолон, ранее принадлежавший к трибе Rousettini of Rousettinae, был перемещен в собственное подсемейство, Eidolinae.[2]
В 1984 году было предложено дополнительное подсемейство птероподид, Propottininae, представляющее один вымерший вид, описанный по ископаемому, обнаруженному в Африке, Propotto leakeyi.[19] В 2018 году окаменелости были повторно исследованы и были определены как лемур.[20] По состоянию на 2018 год было описано 197 видов мегабата,[21] около трети из них - летучие лисицы этого рода Птеропус.[22]
Эволюционная история
Летопись окаменелостей и время расхождения
Летопись окаменелостей птероподидных летучих мышей является наиболее неполной из всех семей летучих мышей. Несколько факторов могут объяснить, почему было обнаружено так мало окаменелостей птероподид: тропические регионы, где могли быть найдены их окаменелости, не представлены в выборке по сравнению с Европой и Северной Америкой; условия для окаменелости в тропиках плохие, что может привести к меньшему количеству окаменелостей в целом; и окаменелости могли быть созданы, но они могли быть уничтожены последующей геологической деятельностью.[23] Подсчитано, что более 98% ископаемых останков птероподид отсутствуют.[24] Даже без окаменелостей возраст и время расхождения семьи все же можно оценить с помощью вычислительная филогенетика. Pteropodidae отделились от надсемейства Ринолофоидеи (который включает все другие семейства подотряда Yinpterochiroptera) примерно 58 млн лет назад (миллион лет назад).[24] Предок группа короны Pteropodidae или все живые виды жили примерно 31 млн лет назад.[25]
Биогеография
Семейство Pteropodidae, вероятно, произошло от Австралазия на основе биогеографические реконструкции.[2] Другие биогеографические исследования показали, что Меланезийский Острова, в том числе Новая Гвинея, являются вероятным кандидатом на происхождение большинства подсемейств мегабатонов, за исключением Cynopterinae;[18] циноптерины, вероятно, произошли на Sunda Shelf на основе результатов взвешенного анализа предков шести ядерных и митохондриальных генов.[25] Из этих регионов птероподиды колонизировали другие районы, включая континентальную Азию и Африку. Megabats достигли Африки как минимум в четырех различных событиях. Четыре предлагаемых события представлены (1) Скотониктерис, (2) Rousettus, (3) Scotonycterini и (4) «эндемичная африканская клада», в которую входят Stenonycterini, Plerotini, Myonycterini и Epomophorini, согласно исследованию 2016 года. Неизвестно, когда мегабаты достигли Африки, но несколько племен (Scotonycterini, Stenonycterini, Plerotini, Myonycterini и Epomophorini) присутствовали на Поздний миоцен. Как мегабаты достигли Африки, также неизвестно. Было высказано предположение, что они могли прибыть через Средний Восток до того, как он стал более засушливым в конце миоцена. И наоборот, они могли попасть на континент через Гомфотерий сухопутный мост, который соединил Африку и Аравийский полуостров к Евразия. Род Птеропус (летучие лисицы), которых нет на материковой части Африки, предполагается, что они распространились из Меланезии через прыжки по островам через Индийский океан;[26] это менее вероятно для других родов мегаполисов, которые имеют меньшие размеры тела и, следовательно, более ограниченные возможности полета.[2]
Эхолокация
Мегабаты - единственное семейство летучих мышей, не способное к гортанный эхолокация. Неясно, был ли общий предок всех летучих мышей способен к эхолокации, и, таким образом, эхолокация была потеряна в линии передачи мегабат, или несколько линий летучих мышей независимо развили способность к эхолокации (надсемейство Ринолофоидеи и подотряд Янгочироптеры). Этот неизвестный элемент эволюции летучих мышей был назван «большой проблемой в биологии».[27] Исследование летучих мышей 2017 года онтогенез (эмбриональное развитие) обнаружили доказательства того, что эмбрионы мегаползина сначала имеют большие, развитые улитка похожи на эхолокационных микробов, хотя при рождении у них небольшая улитка, как у неэхолокационных млекопитающих. Эти данные подтверждают, что эхолокация гортани развивалась у летучих мышей один раз, а у птероподидов была потеряна, а не развивалась дважды независимо.[28] Мегабаты в роде Rousettus способны к примитивной эхолокации, щелкая языком.[29] Некоторые виды - пещера нектар летучая мышь (Eonycteris spelaea), малая коротконосая летучая мышь (Циноптер брахиотис), а длинноязычная летучая мышь (Macroglossus sobrinus) - было показано, что они создают щелчки, похожие на эхолокацию летучих мышей с помощью своих крыльев.[30]
И эхолокация, и полет энергетически затратные процессы.[31] Эхолокационные летучие мыши сочетают производство звука с механизмами, задействованными для полета, что позволяет им снизить дополнительную энергетическую нагрузку на эхолокацию. Вместо того, чтобы нагнетать воздушный поток для производства звука, летучие мыши с эхолокацией в гортани, вероятно, используют силу мускулов своих крыльев, чтобы сжимать воздух, сокращая энергетические затраты за счет синхронизации взмахов крыльев и эхолокации.[32] Утрата эхолокации (или, наоборот, отсутствие ее эволюции) может быть связана с разобщением полета и эхолокации у мегабатов.[33] Больший средний размер тела у мегабатов по сравнению с эхолокационными летучими мышами[34] предполагает, что больший размер тела нарушает связь между полетом и эхолокацией и делает эхолокацию слишком дорогостоящей для сохранения у мегабатов.[33]
Список родов




Семейство Pteropodidae делится на шесть подсемейства в лице 46 роды:[2][18]
Семья Pteropodidae
- подсемейство Cynopterinae[18]
- род Aethalops - карликовые летучие мыши
- род Алиониктерис
- род Balionycteris
- род Хиронакс
- род Циноптер - летучие мыши с мордой собаки или летучие мыши с коротким носом
- род Дьякоптер - фруктовые летучие мыши даяк
- род Haplonycteris
- род Латиденс
- род Megaerops
- род Отоптеропус
- род Penthetor
- род Птенохирус - мускусные фруктовые летучие мыши
- род Sphaerias
- род Тооптер
- подсемейство Eidolinae[2]
- род Эйдолон - летучие мыши соломенного цвета
- подсемейство Harpiyonycterinae[2]
- род Апротелес
- род Boneia
- род Добсоня - фруктовые летучие мыши с голой спиной
- род Harpyionycteris
- подсемейство Nyctimeninae[18]
- род Nyctimene - фруктовые летучие мыши-трубочки
- род Paranyctimene
- подсемейство Pteropodinae
- род Мелониктерис[18]
- племя Птероподини[18]
- род Acerodon
- род Птералопекс
- род Птеропус - летучие лисицы
- род Стилоктений
- подсемейство Rousettinae
- племя Eonycterini[2]
- род Eonycteris - летучие мыши на рассвете
- племя Эпомофорини[2][18]
- род Эпомофор - летучие мыши с эполетами
- род Epomops - летучие мыши с погонами
- род Hypsignathus
- род Микроптеропус - летучие мыши карликовые погоны
- род Nanonycteris
- племя Myonycterini[2]
- род Megaloglossus
- род Myonycteris - маленькие летучие мыши в ошейнике
- племя Plerotini[2]
- род Plerotes
- племя Рузеттини[2]
- род Rousettus - рулетка с фруктовыми летучими мышами
- племя Скотониктерини[2]
- род Casinycteris
- род Скотониктерис
- племя Stenonycterini[2]
- род Стенониктерис
- племя Eonycterini[2]
- Incertae sedis
- род Notopteris - длиннохвостые летучие мыши[18]
- род Миримири[18]
- род Неоптерикс[18]
- род Десмалопекс[18]
- род †Turkanycteris[35]
- племя Макроглоссини[18]
- род Макроглосс - летучие мыши с длинными языками
- род Syconycteris - цветущие летучие мыши
Описание
Внешность

Мегабаты называются так из-за их большего веса и размера; самый большой, самый большая летучая лисица (Pteropus neohibernicus) весит до 1,6 кг (3,5 фунта);[36] некоторые члены Acerodon и Птеропус имеют размах крыльев до 1,7 м (5,6 футов).[37]: Несмотря на то, что размер тела был определяющей характеристикой, которую Добсон использовал для разделения микрокрылых летучих мышей и мегабатов, не все виды мегаполисов крупнее микрокрылых; то пятнистая летучая мышь (Balionycteris maculata), мегабат, весит всего 14,2 г (0,50 унции).[34] Летучие лисицы Птеропус и Acerodon часто считаются образцами всей семьи по размеру тела. На самом деле, эти роды являются выбросами, что создает неправильное представление об истинных размерах большинства видов гигантских летучих мышей.[5] В обзоре 2004 года говорится, что 28% видов гигантских крысят весят менее 50 г (1,8 унции).[34]
Мегабатов по внешнему виду можно отличить от микрокрылых по их собачьим мордам, по наличию когтей на втором пальце (см. Мегабат # Посткрания) и их простыми ушами.[38] Простой внешний вид уха частично объясняется отсутствием Tragi (выступающие лоскуты хряща перед ушным проходом), которые встречаются у многих видов микрокрылых летучих мышей. Мегабат из рода Nyctimene менее собачьи, с более короткими мордами и трубчатыми ноздрями.[39] Исследование, проведенное в 2011 году среди 167 видов гигантских крыланов, показало, что, хотя у большинства (63%) мех однородного цвета, в этом семействе наблюдаются и другие узоры. К ним относятся затенение у четырех процентов видов, повязка на шее или накидка у пяти процентов видов, полосы у десяти процентов видов и пятна у девятнадцати процентов видов.[40]
В отличие от микробатов, у мегабатов значительно сокращается уропатагиум, которая представляет собой пространство летательной перепонки, проходящей между задними конечностями.[41] Кроме того, хвост отсутствует или сильно уменьшен,[39] за исключением Notopteris виды, имеющие длинный хвост.[42] Большинство крыльев мегабата вставляются сбоку (прикрепляются к корпусу прямо по бокам). В Добсоня крылья прикрепляются ближе к позвоночнику, что дает им общее название летучих мышей с голой или голой спиной.[41]
Скелет
Череп и зубной ряд

Мегабаты имеют большие орбиты, которые граничат с развитыми посторбитальные процессы сзади. Иногда посторбитальные отростки объединяются, образуя заглазничная перемычка. В морда проста на вид и не сильно видоизменена, как у летучих мышей других семейств.[43] Длина морды у разных родов разная. В предчелюстная кость хорошо развита и обычно бесплатна,[4] это означает, что он не сливается с верхняя челюсть; вместо этого он соединяется с верхней челюстью через связки, что делает его подвижным.[44][45] На предчелюстной кости всегда отсутствует небная ветвь.[4] У видов с более длинной мордой череп обычно дугообразный. У родов с более короткими лицами (Penthetor, Nyctimene, Добсоня, и Myonycteris) череп практически не изгибается.[46]
Количество зубов варьируется у разных видов мухоматов; общее количество для различных видов колеблется от 24 до 34. Все мегабаты имеют по два или четыре верхних и нижних резцы, с исключением Фруктовая летучая мышь Балмера (Aproteles bulmerae), у которого полностью отсутствуют резцы,[47] и Фруктовая летучая мышь с воротником из Сан-Томе (Myonycteris brachycephala), имеющая два верхних и три нижних резца.[48] Это делает его единственным видом млекопитающих с асимметричным зубная формула.[48]
У всех видов есть два верхних и нижних клыки. Количество премоляры переменная, с четырьмя или шестью верхними и нижними премолярами. коренные зубы всегда присутствуют, а это означает, что у всех мегабатов есть как минимум четыре моляра. Остальные моляры могут присутствовать, присутствовать, но уменьшаться или отсутствовать.[47] Моляры и премоляры Megabat упрощены, с уменьшением куспиды и гребни, приводящие к более плоской Корона.[49]
Как и большинство млекопитающих, мега-летучие мыши дифиодонт, что означает, что у молодых есть набор молочные зубы (молочные зубы), которые выпадают и заменяются постоянными зубами. У большинства видов имеется 20 молочных зубов. Как это характерно для млекопитающих,[50] молочный набор не включает моляры.[49]
Посткрания
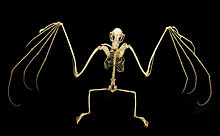
В лопатки (лопатки) мега-крылатых были описаны как самые примитивные из всех семейств рукокрылых.[49] Плечо в целом простой конструкции, но имеет некоторые специальные особенности. Примитивная вставка подъязычная мышца от ключица (от ключицы) к лопатке сбоку смещенный (больше в сторону тела) - особенность также видел в Phyllostomidae. Плечо также имеет хорошо развитую систему мышечных проскальзываний (узкие группы мышц, которые увеличивают более крупные мышцы), которые закрепляют сухожилие мышцы occipitopollicalis (мышца у летучих мышей, которая проходит от основания шеи до основания большого пальца).[41] к коже.[39]
А у микробатов когти только на большие пальцы из передних конечностей у большинства мегакомбатов также есть когтистый второй палец;[49] Только Eonycteris, Добсоня, Notopteris, и Неоптерикс отсутствует второй коготь.[51] Первая цифра самая короткая, а третья цифра самая длинная. Вторая цифра не может сгибание.[49] Большие пальцы рук мегабатов длиннее передних конечностей, чем у микрокрылых.[41]
Задние конечности мегабатов имеют те же скелетные компоненты, что и люди. Большинство видов мегабатонов имеют дополнительную структуру, называемую калькар, шпора хряща, возникающая из пяточная кость.[52] Некоторые авторы поочередно называют эту структуру уропатагиальной шпорой, чтобы отличить ее от лопаток микробов, которые имеют другую структуру. Структура существует для стабилизации уропатагиума, позволяя летучим мышам регулировать выпуклость мембраны во время полета. Мегабаты без кальца или шпора включают: Notopteris, Syconycteris, и Harpyionycteris.[53] Вся нога повернута в бедре по сравнению с нормальным положением млекопитающего, что означает, что колени обращены к сзади. Все пять пальцев стопы сгибаются в направлении сагиттальная плоскостьбез пальцев, способных сгибаться в противоположном направлении, как в лапах сидящих птиц.[52]
Внутренние системы
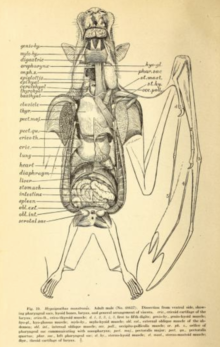
Полет очень затратный с точки зрения энергии, требует нескольких адаптаций к сердечно-сосудистая система. Во время полета летучие мыши могут поднимать потребление кислорода в двадцать и более раз на длительные периоды; спортсмены-люди могут добиться увеличения в двадцать раз максимум за несколько минут.[54] Исследование 1994 г. соломенная летучая мышь (Eidolon helvum) и летучая мышь с головой молотка (Hypsignathus monstrosus) нашел среднее коэффициент дыхательного обмена (произведенный углекислый газ: использованный кислород) приблизительно 0,78. Среди этих двух видов седая летучая лисица (Pteropus poliocephalus) и Египетская летучая мышь (Rousettus aegyptiacus), максимальная частота сердечных сокращений в полете варьировалась от 476 ударов в минуту (седая летучая лисица) до 728 ударов в минуту (египетская летучая мышь). Максимальное количество вдохов в минуту варьировалось от 163 (седая летучая лисица) до 316 (летучая мышь соломенного цвета).[55] Кроме того, мегабаты имеют исключительно большие объем легких относительно их размеров. В то время как наземные млекопитающие, такие как землеройки иметь объем легких 0,03 см3 на грамм массы тела (0,05 дюйма3 на унцию массы тела), такие виды, как Летучая мышь с эполетом Уолберга (Epomophorus wahlbergi) имеют объем легких в 4,3 раза больше на 0,13 см3 на грамм (0,22 дюйма3 за унцию).[54]
У мегабатов пищеварительная система работает быстро, время прохождения через кишечник составляет полчаса или меньше.[39] Пищеварительная система устроена так: травоядный диета иногда ограничивается мягкими фруктами или нектаром.[56] Длина пищеварительной системы у травоядных короче (а также короче, чем у травоядных). насекомоядный microchiropterans),[56] поскольку волокнистое содержимое в основном отделяется под действием неба, языка и зубов, а затем выбрасывается.[56] У многих мегабатов живот U-образной формы. Нет четкой разницы между тонкой и толстой кишкой или четкого начала прямая кишка. У них очень высокая плотность кишечного микроворсинки, что создает большую поверхность для поглощения питательных веществ.[57]
Биология и экология
Размер генома
Как и все летучие мыши, мегабаты гораздо меньше геномы чем у других млекопитающих. Исследование, проведенное в 2009 году с участием 43 видов гигантских летучих мышей, показало, что их геномы варьируются от 1,86 пикограмм (пг, 978 мегабайт на пг) у соломенных летучих мышей до 2,51 пг у плодовых летучих мышей. Летучая лисица Лайла (Pteropus lylei). Все значения были намного ниже, чем в среднем у млекопитающих 3,5 пг. У мегабатов геномы даже меньше, чем у микробов, со средним весом 2,20 пг по сравнению с 2,58 пг. Было высказано предположение, что это различие могло быть связано с тем фактом, что происхождение мегабата пережило исчезновение СТРОКА 1-тип длинный вкрапленный ядерный элемент. LINE1 составляет 15–20% генома человека и считается наиболее распространенным ядерным элементом с длинными вкраплениями среди млекопитающих.[58]
Чувства
Взгляд

За очень редкими исключениями, мегабаты не эхолоцировать, и поэтому полагайтесь на зрение и запах для навигации.[59] У них большие глаза расположены в передней части головы.[60] Они больше, чем у общего предка всех летучих мышей, и одно исследование показало тенденцию к увеличению размера глаз у птероподидов. Исследование, в ходе которого изучали глаза 18 видов крупных крыланов, показало, что летучая мышь обыкновенная (Syconycteris australis) имели самые маленькие глаза диаметром 5,03 мм (0,198 дюйма), в то время как самые большие глаза были у большая летучая лисица (Pteropus vampyrus) диаметром 12,34 мм (0,486 дюйма).[61] Ирисы Megabat обычно коричневые, но могут быть красными или оранжевыми, как в Десмалопекс, Миримири, Птералопекс, и немного Птеропус.[62]
На высоких уровнях яркости мегабат Острота зрения беднее, чем у людей; при низкой яркости лучше.[60] Одно исследование, в котором изучались глаза некоторых Rousettus, Эпомофор, Эйдолон, и Птеропус видов определили, что первые три рода обладают Tapetum lucidum, светоотражающая структура в глазах, которая улучшает зрение при слабом освещении, а Птеропус видов нет.[59] Все изученные виды имели сетчатка с обоими стержневые клетки и конические клетки, но только Птеропус виды имели S-конусы, которые обнаруживают самые короткие длины волн света; потому что спектральная настройка опсины не было заметно, неясно, были ли S-конусы Птеропус виды обнаруживают синий или ультрафиолетовый свет. Птеропус летучие мыши двухцветный, обладающие двумя видами колбочек. Остальные три рода без S-колбочек являются монохромный, не видит цвета. У всех родов была очень высокая плотность палочек, что привело к высокой чувствительности к свету, что соответствует их ночной активности. В Птеропус и Rousettus, измеренная плотность стержневых ячеек составляла 350 000–800 000 на квадратный миллиметр, что равнялось или превышало другие значения ночной или сумеречный животные, такие как домовая мышь, Домашняя кошка, и домашний кролик.[59]
Запах

Megabats используют запах, чтобы находить такие источники пищи, как фрукты и нектар.[63] У них острое обоняние, которое может соперничать с домашняя собака.[64] Фруктовые летучие мыши, такие как восточная летучая мышь-трубочка (Nyctimene robinsoni) есть стерео обоняние, что означает, что они могут отображать шлейфы запаха и прослеживать их в трехмерном пространстве.[64]Наряду с большинством (или, возможно, со всеми) другими видами летучих мышей, матери и потомство летучих мышей также используют запах, чтобы узнавать друг друга, а также для распознавания особей.[63] У летучих лисиц самцы увеличились в размерах. андроген-чувствительный сальные железы на своих плечах они используют для ароматическая маркировка их территории, особенно во время брачного сезона. Секреты этих желез различаются у разных видов - из 65 химических соединений, выделенных из желез четырех видов, ни одно соединение не было обнаружено у всех видов.[65] Мужчины также занимаются промывание мочи, или покрывая себя собственной мочой.[65][66]
Вкус
Мегабаты обладают TAS1R2 ген, что означает, что они способны обнаруживать сладость в пище. Этот ген присутствует у всех летучих мышей, кроме летучие мыши-вампиры. Как и все другие летучие мыши, мегабаты не могут попробовать умами, из-за отсутствия TAS1R1 ген. Среди других млекопитающих только гигантские панды было показано, что этот ген отсутствует.[63] Мегабаты также имеют несколько TAS2R гены, указывающие на то, что они могут чувствовать горечь.[67]
Размножение и жизненный цикл

Мегабаты, как и все летучие мыши, долгожители относительно своего размера для млекопитающих. Продолжительность жизни некоторых пленных мегабатов превышает тридцать лет.[51] По сравнению с их размерами, у мегакомбатов низкая репродуктивность и задержка полового созревания, при этом самки большинства видов не рожают до одного или двух лет.[68]:6 Некоторые мегабаты, похоже, могут размножаться в течение всего года, но большинство видов вероятно сезонные заводчики.[51] Спаривание происходит на насесте.[69] Продолжительность беременности варьируется,[70] но у большинства видов составляет от четырех до шести месяцев. У разных видов летучих мышей есть репродуктивные приспособления, которые удлиняют период между совокуплением и родами. Некоторые виды, такие как соломенная летучая мышь, имеют репродуктивную адаптацию отсроченная имплантация, что означает, что совокупление происходит в июне или июле, но зигота не имплантируется в матка стена до месяцев спустя в ноябре.[68]:6 В Карликовая летучая мышь Фишера (Haplonycteris fischeri), с адаптацией к задержке после имплантации, имеет самый большой срок беременности среди всех видов летучих мышей - до 11,5 месяцев.[70] Задержка после имплантации означает, что развитие эмбриона приостанавливается на срок до восьми месяцев после имплантации в стенку матки, что является причиной его очень долгой беременности.[68]:6 Более короткие сроки беременности обнаруживаются в большая коротконосая летучая мышь (Циноптер сфинкс) сроком на три месяца.[71]
Размер помета у всех мегабатов обычно один.[68]:6 Имеются скудные сведения о близнецах у следующих видов: Мадагаскарская летучая лисица (Pteropus rufus), Летучая мышь Добсона с эполетом (Epomops dobsoni), седая летучая лисица, черная летучая лисица (Pteropus alecto), Очковая летучая лисица (Pteropus conspicillatus),[72] большая коротконосая летучая мышь,[73] Летучая мышь Петерса с эполетом (Эпомофор криптурус), летучая мышь с головой молотка, летучая мышь соломенного цвета, маленькая летучая мышь с воротником (Myonycteris torquata), египетская летучая мышь и Розетка Лешено (Rousettus leschenaultii).[74]:85–87 В случае близнецов оба потомства выживают редко.[72] Поскольку у мегабатов, как и у всех летучих мышей, низкая репродуктивность, их популяции медленно восстанавливаются после спада.[75]
При рождении потомство мегабата составляет в среднем 17,5% от послеродового веса их матери. Это наименьшее соотношение потомков к матери для любой семьи летучих мышей; у всех летучих мышей вес новорожденных составляет 22,3% от послеродового веса их матери. Потомство мегабата нелегко отнести к традиционным категориям альтриальный (беспомощный при рождении) или ранний (способный при рождении). Такие виды, как большая коротконосая летучая мышь, рождаются с открытыми глазами (признак раннего потомства), тогда как у потомства египетской плодовой летучей мыши глаза открываются только через девять дней после рождения (признак альтрициального потомства).[76]
Как и почти все виды летучих мышей, самцы не помогают самкам в родительской заботе.[77]Молодые остаются с матерями, пока они отлученный от груди; продолжительность отлучения от груди зависит от всей семьи. Мегабаты, как и все летучие мыши, имеют относительно длительные периоды кормления грудью: потомство будет кормить грудью, пока не достигнет примерно 71% массы тела взрослого человека, по сравнению с 40% массы тела взрослого человека у млекопитающих, не являющихся летучими мышами.[78] Виды в роду Микроптеропус отнимают детенышей к семи-восьми неделям, тогда как Индийская летучая лисица (Pteropus medius) не отнимает детенышей до пяти месяцев.[74] Очень необычно, что мужские особи двух видов мегаполисов, Бисмарк в маске летучая лисица (Pteropus capistratus) и Даяк фруктовая летучая мышь (Dyacopterus spadiceus), наблюдались производство молока, но никогда не наблюдалось, чтобы мужчина кормил детенышей.[79] Неясно, является ли лактация функциональной, и самцы действительно кормят щенков, или это результат стресс или же недоедание.[80]
Поведение и социальные системы
Многие виды мегабатов очень общительный или в социальных сетях. Megabats будут вокализовать, чтобы общаться друг с другом, создавая шумы, описываемые как «всплески звука, похожие на трели»,[81] гудок,[82] или громкие, похожие на блеяние звонки[83] в разных родах. По крайней мере, один вид, египетская летучая мышь, способен вокальное обучение называется обучением вокальному производству, определяемым как «способность изменять вокализацию в ответ на взаимодействие с сородичами».[84][85] Молодые египетские летучие мыши способны приобретать диалект слушая своих матерей, а также других особей в своих колониях. Было высказано предположение, что эти диалектные различия могут приводить, например, к тому, что люди из разных колоний общаются с разной частотой.[86][87]
Социальное поведение Megabat включает использование сексуального поведения не только для воспроизводства. Данные свидетельствуют о том, что самки египетских летучих мышей берут еду у самцов в обмен на секс. Тесты на отцовство подтвердили, что самцы, у которых каждая самка брала еду, имели большую вероятность стать отцом потомства этой самки.[88]Гомосексуальный фелляция наблюдалась по крайней мере у одного вида, Бонин летучая лисица (Pteropus pselaphon).[89][90] Предполагается, что этот однополый фелляция способствует формированию колоний у самцов, которые в других отношениях враждебны, в более холодном климате.[89][90]
Мегабаты в основном ночной образ жизни и сумеречный, хотя некоторые из них наблюдались летать днем.[37] Несколько островных видов и подвидов дневной, предположительно как ответ на отсутствие хищники.Суточные таксоны включают подвид черноухая летучая лисица (Pteropus melanotus natalis), Маврикийская летучая лисица (Pteropus niger), Кэролайн летучая лисица (Pteropus molossinus), подвид Pteropus pelagicus (П. п. островок), а Фруктовая летучая мышь Сейшельских островов (Pteropus seychellensis).[91]:9
Насест
В сводке 1992 года по сорока одному роду мегабатонов отмечено, что двадцать девять родов населяют деревья. Еще одиннадцать родов обитают в пещерах, а остальные шесть родов обитают в других местах (например, человеческие постройки, шахты и расщелины). Населяющие деревья виды могут быть одиночными или сильно размножающимися. колониальный, образуя скопления до одного миллиона особей. Виды, населяющие пещеры, образуют скопления от десяти до нескольких тысяч особей. Высоко колониальные виды часто демонстрируют верность населенным пунктам, а это означает, что их деревья или пещеры могут использоваться в качестве убежищ в течение многих лет. Одиночные виды или те, которые собираются в меньшем количестве, менее привязаны к своим насестам.[68]:2
Диета и кормление

Большинство мегабатов в первую очередь плодоядный.[92] Во всей семье едят разнообразные фрукты почти 188 родов растений.[93] Некоторые виды также нектароядный, что означает, что они также пьют нектар из цветов.[92] В Австралии, Эвкалипт цветы - особенно важный источник пищи.[39] Другие пищевые ресурсы включают листья, побеги, почки, пыльцу, семенные коробочки, сок, шишки, кору и веточки.[94] Они потрясающе едят и могут съедать фруктов в 2,5 раза больше их собственного веса за ночь.[93]
Мегабаты летают на ночевку и добычу пищи. Обычно они летят прямо и относительно быстро для летучих мышей; некоторые виды медленнее с большей маневренностью. Виды могут преодолевать 20–50 км (12–31 миль) за ночь. Мигрирующие виды родов Эйдолон, Птеропус, Эпомофор, Rousettus, Myonycteris, и Nanonycteris может перемещаться на расстояние до 750 км (470 миль). У большинства мегабатов ниже среднего соотношение сторон,[95] который является измерением размаха и площади крыла.[95]:348 Нагрузка на крыло, которая измеряет вес относительно площади крыла,[95]:348 средний или выше среднего в мегабатах.[95]
Распространение семян
Мегабаты играют важную роль в распространение семян. В результате своей долгой эволюционной истории некоторые растения развили характеристики, совместимые с чувствами летучих мышей, в том числе фрукты, которые сильно пахнут, ярко окрашены и заметно обнажены вдали от листвы. Яркие цвета и расположение фруктов могут отражать зависимость мегабатов от визуальных сигналов и неспособности ориентироваться в беспорядке. В исследовании, в котором изучались плоды более сорока видов инжира, только один вид инжира употреблялся как птицами, так и крупными летучими мышами; большинство видов потребляются одним или другим. Инжир, потребляемый птицами, часто бывает красного или оранжевого цвета, тогда как инжир, потребляемый в больших количествах, часто бывает желтым или зеленым.[96] Большинство семян выводятся из организма вскоре после употребления из-за быстрого прохождения через кишечник, но некоторые семена могут оставаться в кишечнике более двенадцати часов. Это увеличивает способность мегабатов рассеивать семена вдали от родительских деревьев.[97] Будучи высокомобильными плодоядными животными, мега-летучие мыши способны восстанавливать лес между изолированными фрагментами леса, рассеивая семена деревьев на обезлесенных ландшафтах.[98] Эта способность к рассеянию ограничена растениями с мелкими семенами, длина которых меньше 4 мм (0,16 дюйма), поскольку семена большего размера не попадают в организм.[99]
Хищники и паразиты

У мегабатов, особенно на островах, мало местных хищников: такие виды, как маленькая летучая лисица (Pteropus hypomelanus) не имеют известных естественных хищников.[100] К инородным хищникам летучих лисиц относятся домашние кошки и крысы. В мангровый монитор, который является местным хищником для одних видов гигантских летучих мышей, но завезенным хищником для других, конъюнктурно охотится на крупных летучих мышей, поскольку он способный лазать по деревьям.[101] Другой вид, коричневая древесная змея, может серьезно повлиять на популяции мегабатов; как чужеродный хищник в Гуам, the snake consumes so many offspring that it reduced the набор персонала населения Mariana fruit bat (Pteropus mariannus) to essentially zero. The island is now considered a раковина for the Mariana fruit bat, as its population there relies on bats immigrating from the nearby island of Рота to bolster it rather than successful reproduction.[102] Predators that are naturally сочувствующий with megabats include reptiles such as крокодилы, snakes, and large lizards, as well as birds like соколы, ястребы, и совы.[68]:5 В морской крокодил is a known predator of megabats, based on analysis of crocodile stomach contents in northern Australia.[103] During extreme heat events, megabats like the Маленькая красная летучая лисица (Pteropus scapulatus) must cool off and rehydrate by drinking from waterways, making them susceptible to opportunistic depredation by пресноводные крокодилы.[104]
Megabats are the hosts of several паразит таксоны. Known parasites include Nycteribiidae и Streblidae species ("bat flies"),[105][106] а также клещи рода Демодекс.[107] Blood parasites of the family Haemoproteidae and intestinal nematodes of Toxocaridae also affect megabat species.[39][108]
Диапазон и среда обитания
Megabats are widely distributed in the тропики из Старый мир, occurring throughout Africa, Asia, Australia, and throughout the islands of the Indian Ocean and Океания.[18] As of 2013, fourteen genera of megabat are present in Africa, representing twenty-eight species. Of those twenty-eight species, twenty-four are only found in tropical or субтропический климат. The remaining four species are mostly found in the tropics, but their ranges also encompass умеренный климат. In respect to habitat types, eight are exclusively or mostly found in покрытый лесом habitat; nine are found in both forests and саванны; nine are found exclusively or mostly in savannas; and two are found on islands. Only one African species, the long-haired rousette (Rousettus lanosus), is found mostly in montane ecosystems, but an additional thirteen species' ranges extend into montane habitat.[109]:226
Outside of Southeast Asia, megabats have relatively low species richness in Asia. The Egyptian fruit bat is the only megabat whose range is mostly in the Палеарктическое царство;[110] it and the straw-colored fruit bat are the only species found in the Средний Восток.[110][111] The northernmost extent of the Egyptian fruit bat's range is the northeastern Средиземноморье.[110] В Восточная Азия, megabats are found only in China and Japan. In China, only six species of megabat are considered resident, while another seven are present marginally (at the edge of their ranges), questionably (due to possible misidentification), or as accidental migrants.[112] Four megabat species, all Птеропус, are found on Japan, but none on its five main islands.[113][114][115][116] В Южная Азия, megabat species richness ranges from two species in the Мальдивы to thirteen species in Индия.[117] Megabat species richness in Southeast Asia is as few as five species in the small country of Singapore and seventy-six species in Индонезия.[117] Of the ninety-eight species of megabat found in Asia, forest is a habitat for ninety-five of them. Other habitat types include human-modified land (66 species), caves (23 species), savanna (7 species), shrubland (4 species), rocky areas (3 species), grassland (2 species), and desert (1 species).[117]
In Australia, five genera and eight species of megabat are present. These genera are Птеропус, Syconycteris, Dobsonia, Nyctimene, и Macroglossus.[39]:3 Птеропус species of Australia are found in a variety of habitats, including мангровые заросли-dominated forests, тропические леса, а wet sclerophyll forests of the Australian bush.[39]:7 Австралийский Птеропус are often found in association with humans, as they situate their large colonies in городские районы, particularly in May and June when the greatest proportions of Птеропус species populations are found in these urban colonies.[118]
In Oceania, the countries of Палау и Тонга have the fewest megabat species, with one each. Папуа - Новая Гвинея has the greatest number of species with thirty-six.[119] Of the sixty-five species of Oceania, forest is a habitat for fifty-eight. Other habitat types include human-modified land (42 species), caves (9 species), savanna (5 species), shrubland (3 species), and rocky areas (3 species).[119] An estimated nineteen percent of all megabat species are эндемичный to a single island; of all bat families, only Myzopodidae—containing two species, both single-island endemics—has a higher rate of single-island endemism.[120]
Отношение к людям
Еда
Megabats are killed and eaten as мясо диких животных throughout their range. Bats are consumed extensively throughout Asia, as well as in islands of the West Indian Ocean and the Pacific, where Птеропус species are heavily hunted. In continental Africa where no Птеропус species live, the straw-coloured fruit bat, the region's largest megabat, is a preferred hunting target.[121]
In Guam, consumption of the Mariana fruit bat exposes locals to the нейротоксин бета-метиламино-L-аланин (BMAA) which may later lead to нейродегенеративные заболевания. BMAA may become particularly biomagnified in humans who consume flying foxes; flying foxes are exposed to BMAA by eating саговник фрукты.[122][123][124]
Как резервуары болезней


Megabats are the резервуары из нескольких вирусы that can affect humans and cause disease. They can carry филовирусы, в том числе Вирус Эбола (EBOV) and Марбургвирус.[125] Наличие Марбургвирус, что приводит к Marburg virus disease, has been confirmed in one species, the Egyptian fruit bat. The disease is rare, but the fatality rate of an outbreak can reach up to 88%.[125][126] The virus was first recognized after simultaneous outbreaks in the German cities of Марбург и Франкфурт а также Белград, Сербия в 1967 г.[126] where 31 people became ill and seven died.[127] The outbreak was traced to лаборатория работать с верветы обезьяны из Уганда.[126] The virus can pass from a bat host to a human (who has usually spent a prolonged period in a mine or cave where Egyptian fruit bats live); from there, it can spread person-to-person through contact with infected bodily fluids, including blood and сперма.[126] Соединенные Штаты Центры по контролю и профилактике заболеваний lists a total of 601 confirmed cases of Marburg virus disease from 1967 to 2014, of which 373 people died (62% overall mortality).[127]
Species that have tested positive for the presence of EBOV include Летучая мышь Франке с эполетом (Epomops franqueti), the hammer-headed fruit bat, and the little collared fruit bat. Кроме того, антитела against EBOV have been found in the straw-coloured fruit bat, Gambian epauletted fruit bat (Epomophorus gambianus), Peters's dwarf epauletted fruit bat (Micropteropus pusillus), Veldkamp's dwarf epauletted fruit bat (Nanonycteris veldkampii), Leschenault's rousette, and the Egyptian fruit bat.[125] Much of how humans contract the Ebola virus is unknown. Scientists hypothesize that humans initially become infected through contact with an infected animal such as a megabat or non-human primate.[128] Megabats are presumed to be a natural reservoir of the Ebola virus, but this has not been firmly established.[129] Microbats are also being investigated as the reservoir of the virus, with the greater long-fingered bat (Miniopterus inflatus) once found to harbor a fifth of the virus's genome (though not testing positive for the actual virus) in 2019.[130] Due to the likely association between Ebola infection and "hunting, butchering and processing meat from infected animals", several West African countries banned bushmeat (including megabats) or issued warnings about it during the 2013–2016 epidemic; many bans have since been lifted.[131]
Other megabats implicated as disease reservoirs are primarily Птеропус разновидность. Notably, flying foxes can transmit Лиссавирус австралийских летучих мышей, который вместе с вирус бешенства, причины бешенство. Australian bat lyssavirus was first identified in 1996; it is very rarely transmitted to humans. Transmission occurs from the bite or scratch of an infected animal but can also occur from getting the infected animal's saliva in a слизистая оболочка or an open ранить. Exposure to flying fox blood, urine, or feces cannot cause infections of Australian bat lyssavirus. Since 1994, there have been three records of people becoming infected with it in Квинсленд—each case was fatal.[132]
Flying foxes are also reservoirs of генипавирусы Такие как Вирус Хендры и Вирус нипах. Hendra virus was first identified in 1994; it rarely occurs in humans. From 1994 to 2013, there have been seven reported cases of Hendra virus affecting people, four of which were fatal. The hypothesized primary route of human infection is via contact with лошади that have come into contact with flying fox моча.[133] There are no documented instances of direct transmission between flying foxes and humans.[134] As of 2012, there is a вакцина available for horses to decrease the likelihood of infection and transmission.[135]
Nipah virus was first identified in 1998 in Malaysia. Since 1998, there have been several Nipah outbreaks in Malaysia, Сингапур, India, and Bangladesh, resulting in over 100 casualties. А Вспышка 2018 г. в Керала, Индия resulted in 19 humans becoming infected—17 died.[136] The overall fatality rate is 40–75%. Humans can contract Nipah virus from direct contact with flying foxes or their fluids, through exposure to an intermediate хозяин Такие как домашние свиньи, or from contact with an infected person.[137] A 2014 study of the Indian flying fox and Nipah virus found that while Nipah virus outbreaks are more likely in areas preferred by flying foxes, "the presence of bats in and of itself is not considered a risk factor for Nipah virus infection." Rather, the consumption of сок финиковой пальмы is a significant route of transmission. The practice of date palm sap collection involves placing collecting pots at date palm trees. Indian flying foxes have been observed licking the sap as it flows into the pots, as well as defecating and urinating in proximity to the pots. In this way, humans who drink palm wine can be exposed to henipaviruses. The use of bamboo skirts on collecting pots lowers the risk of contamination from bat urine.[138]
Flying foxes can transmit several non-lethal diseases as well, such as Вирус Менангле[139] и Nelson Bay virus.[140] These viruses rarely affect humans, and few cases have been reported.[139][140] Megabats are not suspected to be vectors of коронавирусы.[141]
В культуре

Megabats, particularly flying foxes, are featured in indigenous cultures and traditions. Folk stories from Australia and Papua New Guinea feature them.[142][143]They were also included in Indigenous Australian cave art, as evinced by several surviving examples.[144]
Indigenous societies in Oceania used parts of flying foxes for functional and ceremonial weapons. In the Solomon Islands, people created barbs out of their bones for use in spears.[145] In New Caledonia, ceremonial axes сделано из нефрит were decorated with braids of flying fox fur.[146] Flying fox wings were depicted on the war shields of the Асмат люди Индонезии; they believed that the wings offered protection to their warriors.[147]
There are modern and historical references to flying fox byproducts used as валюта. In New Caledonia, braided flying fox fur was once used as currency.[145]На острове Макира, which is part of the Solomon Islands, indigenous peoples still hunt flying foxes for their teeth as well as for bushmeat.The клыки are strung together on necklaces that are used as currency.[148] Teeth of the insular flying fox (Pteropus tanganus) are particularly prized, as they are usually large enough to drill holes in. The Makira flying fox (Pteropus когнатус) is also hunted, despite its smaller teeth. Deterring people from using flying fox teeth as currency may be detrimental to the species, with Lavery and Fasi noting, "Species that provide an important cultural resource can be highly treasured." Emphasizing sustainable hunting of flying foxes to preserve cultural currency may be more effective than encouraging the abandonment of cultural currency. Even if flying foxes were no longer hunted for their teeth, they would still be killed for bushmeat; therefore, retaining their cultural value may encourage sustainable hunting practices.[149] Lavery stated, "It's a positive, not a negative, that their teeth are so culturally valuable. The practice of hunting bats shouldn't necessarily be stopped, it needs to be managed sustainably."[148]
Сохранение
Положение дел
По состоянию на 2014 г. Международный союз охраны природы (IUCN) evaluated a quarter of all megabat species as под угрозой, which includes species listed as находящихся под угрозой исчезновения, находящихся под угрозой исчезновения, и уязвимый. Megabats are substantially threatened by humans, as they are hunted for food and medicinal uses.Additionally, they are culled for actual or perceived damage to agriculture, especially to fruit production.[150] As of 2019, the IUCN had evaluations for 187 megabat species. The status breakdown is as follows:[151]
- Extinct: 4 species (2.1%)
- Critically endangered: 8 species (4.3%)
- Endangered: 16 species (8.6%)
- Vulnerable: 37 species (19.8%)
- Почти под угрозой: 13 species (7.0%)
- Least-concern: 89 species (47.6%)
- Недостаток данных: 20 species (10.7%)
Factors causing decline
Anthropogenic sources
Megabats are threatened by habitat destruction by humans. Вырубка леса of their habitats has resulted in the loss of critical roosting habitat. Deforestation also results in the loss of food resource, as native fruit-bearing trees are felled. Habitat loss and resulting urbanization leads to construction of new roadways, making megabat colonies easier to access for overharvesting. Additionally, habitat loss via deforestation compounds natural threats, as fragmented forests are more susceptible to damage from тайфун-сила ветра.[68]:7 Cave-roosting megabats are threatened by human disturbance at their roost sites. Гуано mining is a livelihood in some countries within their range, bringing people to caves. Caves are also disturbed by mineral mining and cave tourism.[68]:8
Megabats are also killed by humans, intentionally and unintentionally. Half of all megabat species are hunted for food, in comparison to only eight percent of insectivorous species,[152] while human persecution stemming from perceived damage to crops is also a large source of mortality. Some megabats have been documented to have a preference for native fruit trees over fruit crops, but deforestation can reduce their food supply, causing them to rely on fruit crops.[68]:8 They are shot, beaten to death, or poisoned to reduce their populations. Mortality also occurs via accidental entanglement in сетка used to prevent the bats from eating fruit.[153] Culling campaigns can dramatically reduce megabat populations. In Mauritius, over 40,000 Mauritian flying foxes were culled between 2014 and 2016, reducing the species' population by an estimated 45%.[154] Megabats are also killed by electrocution. In one Australian orchard, it is estimated that over 21,000 bats were electrocuted to death in an eight-week period.[155] Farmers construct electrified grids over their fruit trees to kill megabats before they can consume their crop. The grids are questionably effective at preventing crop loss, with one farmer who operated such a grid estimating they still lost 100–120 тонны (220,000–260,000 lb) of fruit to flying foxes in a year.[156] Some electrocution deaths are also accidental, such as when bats fly into воздушные линии электропередачи.[157]
Climate change causes flying fox mortality and is a source of concern for species persistence. Extreme heat waves in Australia have been responsible for the deaths of more than 30,000 flying foxes from 1994 to 2008. Females and young bats are most susceptible to extreme heat, which affects a population's ability to recover.[158] Megabats are threatened by sea level rise associated with climate change, as several species are endemic to low-lying атоллы.[159]
Natural sources
Because many species are endemic to a single island, they are vulnerable to random events such as typhoons. A 1979 typhoon halved the remaining population of the Родригес летучая лисица (Pteropus rodricensis). Typhoons result in indirect mortality as well: because typhoons defoliate the trees, they make megabats more visible and thus more easily hunted by humans. Food resources for the bats become scarce after major storms, and megabats resort to riskier foraging strategies such as consuming fallen fruit off the ground. There, they are more vulnerable to depredation by domestic cats, dogs, and pigs.[91] As many megabat species are located in the tectonically active Огненное кольцо, they are also threatened by volcanic eruptions. Flying foxes, including the endangered Mariana fruit bat,[116][160] have been nearly exterminated from the island of Анатахан following a series of eruptions beginning in 2003.[161]
Рекомендации
- ^ а б McKenna, M.C .; Белл, С. К. (1997). Классификация млекопитающих: выше видового уровня. Издательство Колумбийского университета. п. 296. ISBN 9780231528535.
- ^ а б c d е ж грамм час я j k л м п о Almeida, F.; Giannini, N.P .; Simmons, N. B. (2016). "The Evolutionary History of the African Fruit Bats (Chiroptera: Pteropodidae)". Acta Chiropterologica. 18: 73–90. Дои:10.3161/15081109ACC2016.18.1.003. S2CID 89415407.
- ^ а б Gray, J. E. (1821). "On the natural arrangement of vertebrose animals". London Medical Repository (25): 299.
- ^ а б c Miller Jr., Gerrit S. (1907). "The Families and Genera of Bats". Бюллетень Национального музея США. 57: 63.
- ^ а б c Hutcheon, J. M.; Kirsch, J. A. (2006). "A moveable face: deconstructing the Microchiroptera and a new classification of extant bats". Acta Chiropterologica. 8 (1): 1–10. Дои:10.3161/1733-5329(2006)8[1:AMFDTM]2.0.CO;2.
- ^ "Definition of PTEROPUS". Мерриам-Вебстер. Получено 22 мая 2019.
- ^ а б c Jackson, S.; Jackson, S. M.; Гровс, К. (2015). Таксономия австралийских млекопитающих. Csiro Publishing. ISBN 9781486300136.
- ^ а б Dobson, G. E. (1875). "Conspectus of the suborders, families, and genera of Chiroptera arranged according to their natural affinities". Летопись и журнал естественной истории; Зоология, ботаника и геология. 4. 16 (95).
- ^ а б Springer, M. S .; Тилинг, E.C .; Madsen, O .; Стэнхоуп, М. Дж .; Де Йонг, В. В. (2001). «Интегрированные ископаемые и молекулярные данные реконструируют эхолокацию летучих мышей». Труды Национальной академии наук. 98 (11): 6241–6246. Bibcode:2001ПНАС ... 98.6241С. Дои:10.1073 / pnas.111551998. ЧВК 33452. PMID 11353869.
- ^ Lei, M.; Dong, D. (2016). "Phylogenomic analyses of bat subordinal relationships based on transcriptome data". Научные отчеты. 6 (27726): 27726. Bibcode:2016NatSR...627726L. Дои:10.1038/srep27726. ЧВК 4904216. PMID 27291671.
- ^ Tsagkogeorga, G.; Parker, J.; Stupka, E.; Cotton, J. A.; Rossiter, S. J. (2013). "Phylogenomic Analyses Elucidate the Evolutionary Relationships of Bats". Текущая биология. 23 (22): 2262–2267. Дои:10.1016/j.cub.2013.09.014. PMID 24184098. S2CID 9133016.
- ^ Szcześniak, M.; Yoneda, M .; Sato, H .; Makałowska, I.; Kyuwa, S.; Sugano, S.; Suzuki, Y.; Makałowski, W.; Kai, C. (2014). "Characterization of the mitochondrial genome of Rousettus leschenaulti". Митохондриальная ДНК. 25 (6): 443–444. Дои:10.3109/19401736.2013.809451. PMID 23815317. S2CID 207657381.
- ^ Тилинг, E.C .; Springer, M. S .; Madsen, O .; Bates, P.; О'Брайен, С. Дж .; Мерфи, У. Дж. (2005). "A Molecular Phylogeny for Bats Illuminates Biogeography and the Fossil Record". Наука. 307 (5709): 580–584. Bibcode:2005Sci...307..580T. Дои:10.1126/science.1105113. PMID 15681385. S2CID 25912333.
- ^ Ungar, P. (2010). Зубы млекопитающих: происхождение, эволюция и разнообразие. JHU Press. п. 166. ISBN 9780801899515.
- ^ Giannini, N.P .; Simmons, N. B. (2003). "A phylogeny of megachiropteran bats (Mammalia: Chiroptera: Pteropodidae) based on direct optimization analysis of one nuclear and four mitochondrial genes". Кладистика. 19 (6): 496–511. Дои:10.1111/j.1096-0031.2003.tb00385.x. S2CID 84696546.
- ^ Colgan, D.J .; Фланнери, Т. Ф. (1995). "A Phylogeny of Indo-West Pacific Megachiroptera Based on Ribosomal DNA". Систематическая биология. 44 (2): 209–220. Дои:10.1093/sysbio/44.2.209.
- ^ Bergmans, W. (1997). "Taxonomy and biogeography of African fruit bats (Mammalia, Megachiroptera). 5. The genera Lissonycteris Andersen, 1912, Myonycteris Matschie, 1899 and Megaloglossus Pagenstecher, 1885; general remarks and conclusions; annex: key to all species". Beaufortia. 47 (2): 69.
- ^ а б c d е ж грамм час я j k л м п о п q р s Almeida, F.C .; Giannini, N.P .; Desalle, R .; Simmons, N. B. (2011). "Evolutionary relationships of the old world fruit bats (Chiroptera, Pteropodidae): Another star phylogeny?". BMC Эволюционная биология. 11: 281. Дои:10.1186/1471-2148-11-281. ЧВК 3199269. PMID 21961908.
- ^ Butler, P. M. (1984). "Macroscelidea, Insectivora and Chiroptera from the Miocene of east Africa". Palaeovertebrata. 14 (3): 175.
- ^ Gunnell, G. F.; Boyer, D. M.; Friscia, A. R.; Heritage, S.; Manthi, F.K .; Miller, E. R .; Sallam, H. M.; Simmons, N.B .; Stevens, N. J.; Seiffert, E. R. (2018). «Ископаемые лемуры из Египта и Кении предполагают африканское происхождение ай-айе Мадагаскара». Nature Communications. 9 (1): 3193. Bibcode:2018НатКо ... 9,3193 г. Дои:10.1038 / s41467-018-05648-w. ЧВК 6104046. PMID 30131571.
- ^ Burgin, Connor J; Colella, Jocelyn P; Kahn, Philip L; Upham, Nathan S (2018). "How many species of mammals are there?". Журнал маммологии. 99 (1): 1–14. Дои:10.1093 / jmammal / gyx147. ISSN 0022-2372. S2CID 90797674.
- ^ "Taxonomy=Pteropus". Красный список видов, находящихся под угрозой исчезновения МСОП. 2019. Получено 19 мая 2019.
- ^ Eiting, T. P.; Gunnell, G. F. (2009). "Global Completeness of the Bat Fossil Record". Журнал эволюции млекопитающих. 16 (3): 157. Дои:10.1007/s10914-009-9118-x. S2CID 5923450.
- ^ а б Тилинг, E.C .; Springer, M. S .; Madsen, O .; Bates, P.; О'Брайен, С. Дж .; Мерфи, У. Дж. (2005). "A Molecular Phylogeny for Bats Illuminates Biogeography and the Fossil Record" (PDF). Наука. 307 (5709): 580–584. Bibcode:2005Sci...307..580T. Дои:10.1126/science.1105113. PMID 15681385. S2CID 25912333.
- ^ а б Almeida, F.C .; Giannini, N.P .; Desalle, Rob; Simmons, N. B. (2009). "The phylogenetic relationships of cynopterine fruit bats (Chiroptera: Pteropodidae: Cynopterinae)". Молекулярная филогенетика и эволюция. 53 (3): 772–783. Дои:10.1016/j.ympev.2009.07.035. HDL:11336/74530. PMID 19660560.
- ^ О'Брайен, Дж .; Mariani, C.; Olson, L.; Russell, A. L.; Say, L.; Yoder, A.D .; Hayden, T. J. (2009). "Multiple colonisations of the western Indian Ocean by Pteropus fruit bats (Megachiroptera: Pteropodidae): The furthest islands were colonised first". Молекулярная филогенетика и эволюция. 51 (2): 294–303. Дои:10.1016/j.ympev.2009.02.010. PMID 19249376.
- ^ Teeling EC, Jones G, Rossiter SJ (2016). "Phylogeny, Genes, and Hearing: Implications for the Evolution of Echolocation in Bats". In Fenton MB, Grinnell AD, Popper AN, Fay RN (eds.). Bat Bioacoustics. Справочник Springer по слуховым исследованиям. 54. Нью-Йорк: Спрингер. pp. 25–54. Дои:10.1007/978-1-4939-3527-7_2. ISBN 9781493935277.
- ^ Ван, Чжэ; Zhu, Tengteng; Xue, Huiling; Fang, Na; Zhang, Junpeng; Zhang, Libiao; Pang, Jian; Тилинг, Эмма К .; Zhang, Shuyi (2017). "Prenatal development supports a single origin of laryngeal echolocation in bats". Природа Экология и эволюция. 1 (2): 21. Дои:10.1038/s41559-016-0021. PMID 28812602. S2CID 29068452.
- ^ Holland, R.A .; Waters, D. A.; Rayner, J. M. (December 2004). "Echolocation signal structure in the Megachiropteran bat Rousettus aegyptiacus Geoffroy 1810". Журнал экспериментальной биологии. 207 (Pt 25): 4361–4369. Дои:10.1242/jeb.01288. PMID 15557022. S2CID 2715542.
- ^ Boonman, A.; Bumrungsri, S .; Yovel, Y. (December 2014). "Nonecholocating fruit bats produce biosonar clicks with their wings". Текущая биология. 24 (24): 2962–2967. Дои:10.1016/j.cub.2014.10.077. PMID 25484290. S2CID 17789233.
- ^ Speakman, J. R .; Racey, P. A. (April 1991). "No cost of echolocation for bats in flight". Природа. 350 (6317): 421–423. Bibcode:1991Natur.350..421S. Дои:10.1038/350421a0. PMID 2011191. S2CID 4314715.
- ^ Lancaster, W. C.; Henson, O. W.; Keating, A. W. (January 1995). "Respiratory muscle activity in relation to vocalization in flying bats" (PDF). Журнал экспериментальной биологии. 198 (Pt 1): 175–191. PMID 7891034.
- ^ а б Altringham JD (2011). "Echolocation and other senses". Летучие мыши: от эволюции к сохранению. Нью-Йорк: Oxford University Press. ISBN 9780199207114.
- ^ а б c Hutcheon, J. M.; Garland Jr, T. (2004). "Are Megabats Big?". Журнал эволюции млекопитающих. 11 (3/4): 257–277. Дои:10.1023/B:JOMM.0000047340.25620.89. S2CID 11528722.
- ^ Ганнелл, Грегг Ф .; Manthi, Fredrick K. (April 2018). «Летучие мыши плиоцена (Chiroptera) из Канапой, бассейн Туркана, Кения». Журнал эволюции человека. 140: 4. Дои:10.1016 / j.jhevol.2018.01.001. ISSN 0047-2484. PMID 29628118.
- ^ Flannery, T. (1995). Mammals of the South-West Pacific & Moluccan Islands. Издательство Корнельского университета. п. 271. ISBN 0801431506.
- ^ а б Новак, Р. М .; Уокер, Э. П .; Kunz, T. H.; Pierson, E. D. (1994). Walker's bats of the world. JHU Press. п.49. ISBN 9780801849862.
- ^ Geist, V .; Kleiman, D.G .; Макдэйд, М. С. (2004). Энциклопедия жизни животных Гржимека Млекопитающие II. Volume 13 (2nd ed.). Гейл. п. 309.
- ^ а б c d е ж грамм час Nelson, J. E. Фауна Австралии (PDF) (Отчет). 1B. Департамент окружающей среды и энергетики правительства Австралии.
- ^ Santana, S. E.; Dial, T. O.; Eiting, T. P.; Alfaro, M. E. (2011). "Roosting Ecology and the Evolution of Pelage Markings in Bats". PLOS One. 6 (10): e25845. Bibcode:2011PLoSO...625845S. Дои:10.1371/journal.pone.0025845. ЧВК 3185059. PMID 21991371.
- ^ а б c d Холл, Л. С .; Ричардс, Г. (2000). Летучие лисицы: плодовые и цветущие летучие мыши Австралии. UNSW Press. ISBN 9780868405612.
- ^ Ingleby, S.; Colgan, D. (2003). "Electrophoretic studies of the systematic and biogeographic relationships of the Fijian bat genera Pteropus, Pteralopex, Chaerephon and Notopteris". Australian Mammalogy. 25: 13. Дои:10.1071/AM03013.
- ^ Vaughan, T. A .; Райан, Дж. М .; Czaplewski, N. J. (11 December 2013). Маммология (6 изд.). Издательство "Джонс и Бартлетт". pp. 255–256. ISBN 9781284032185.
- ^ Симмонс, Нэнси Б.; Conway, Tenley M. (2001). "Phylogenetic Relationships of Mormoopid Bats (Chiroptera: Mormoopidae) Based on Morphological Data". Бюллетень Американского музея естественной истории. 258: 17. Дои:10.1206/0003-0090(2001)258<0001:PROMBC>2.0.CO;2. HDL:2246/1608. ISSN 0003-0090.
- ^ Lindenau, Christa (2011). "Middle Pleistocene bats (Mammalia: Chiroptera) from the Yarimburgaz Cave in Turkish Thrace (Turkey)". E&G – Quaternary Science Journal. 55: 127. Дои:10.23689/fidgeo-999.
- ^ Tate, G. H. H. (1942). "Results of the Archbold Expeditions No. 48: Pteropodidae (Chiroptera) of the Archbold Collections". Бюллетень Американского музея естественной истории. 80: 332–335.
- ^ а б Giannini, N.P .; Simmons, N. B. (2007). "Element homology and the evolution of dental formulae in megachiropteran bats (Mammalia: Chiroptera: Pteropodidae)" (PDF). Американский музей Novitates. 3559: 1–27. Дои:10.1206/0003-0082(2007)3559[1:EHATEO]2.0.CO;2. HDL:2246/5849.
- ^ а б Juste, J.; Ibáñez, C. (1993). "An asymmetric dental formula in a mammal, the Sao Tomé Island fruit bat Myonycteris brachycephala (Mammalia: Megachiroptera)". Канадский журнал зоологии. 71 (1): 221–224. Дои:10.1139/z93-030. HDL:10261/48798.
- ^ а б c d е Воан, Т. (1970). «Глава 3: Скелетная система». В Wimsatt, W. (ed.). Биология летучих мышей. Академическая пресса. С. 103–136. ISBN 9780323151191.
- ^ Luo, Z. X.; Kielan-Jaworowska, Z .; Cifelli, R. L. (2004). "Evolution of dental replacement in mammals" (PDF). Бюллетень Музея естественной истории Карнеги. 2004 (36): 159–176. Дои:10.2992/0145-9058(2004)36[159:EODRIM]2.0.CO;2. S2CID 5630875.
- ^ а б c Новак, Р. М .; Pillsbury Walker, E. (1999). Млекопитающие мира Уокера. Volume 1. JHU Press. п. 258. ISBN 9780801857898.
- ^ а б Bennett, M. B. (1993). "Structural modifications involved in the fore- and hind limb grip of some flying foxes (Chiroptera: Pteropodidae)". Журнал зоологии. 229 (2): 237–248. Дои:10.1111/j.1469-7998.1993.tb02633.x.
- ^ Schutt, W. A.; Simmons, N. B. (1998). "Morphology and Homology of the Chiropteran Calca, with Comments on the Phylogenetic Relationships of Archaeopteropus". Журнал эволюции млекопитающих. 5: 2. Дои:10.1023/A:1020566902992. S2CID 20426664.
- ^ а б Maina, J. N.; King, A. S. (1984). "Correlations between structure and function in the design of the bat lung: a morphometric study" (PDF). Журнал экспериментальной биологии. 11: 44.
- ^ Carpenter, R. E. (1986). "Flight Physiology of Intermediate-Sized Fruit Bats (Pteropodidae)" (PDF). Журнал экспериментальной биологии. 120: 84–93.
- ^ а б c Richards, G. C. (1983). "Fruit-bats and their relatives". В Strahan, R. (ред.). Complete book of Australian mammals. The national photographic index of Australian wildlife (1-е изд.). Лондон: Ангус и Робертсон. С. 271–273. ISBN 978-0207144547.
- ^ Schmidt-Rhaesa, A., ed. (2017). Comparative Anatomy of the Gastrointestinal Tract in Eutheria II. Walter de Gruyter GmbH & Co KG. С. 328–330. ISBN 9783110560671.
- ^ Smith, J. D. L.; Gregory, T. R. (2009). "The genome sizes of megabats (Chiroptera: Pteropodidae) are remarkably constrained". Письма о биологии. 5 (3): 347–351. Дои:10.1098/rsbl.2009.0016. ЧВК 2679926. PMID 19324635.
- ^ а б c Müller, B .; Goodman, S.M .; Peichl, Leo (2007). "Cone Photoreceptor Diversity in the Retinas of Fruit Bats (Megachiroptera)". Мозг, поведение и эволюция. 70 (2): 90–104. Дои:10.1159/000102971. PMID 17522478. S2CID 29095435.
- ^ а б Graydon, M.; Giorgi, P.; Pettigrew, J. (1987). "Vision in Flying-Foxes (Chiroptera:Pteropodidae)". Журнал Австралийского общества млекопитающих. 10 (2): 101–105.
- ^ Thiagavel, J.; Cechetto, C.; Santana, S. E.; Jakobsen, L.; Warrant, E.J .; Ratcliffe, J. M. (2018). "Auditory opportunity and visual constraint enabled the evolution of echolocation in bats". Nature Communications. 9 (1): 98. Bibcode:2018NatCo...9...98T. Дои:10.1038/s41467-017-02532-x. ЧВК 5758785. PMID 29311648.
- ^ Giannini, N.P .; Almeida, F.C .; Simmons, N.B .; Helgen, K. M. (2008). "The systematic position of Pteropus leucopterus and its bearing on the monophyly and relationships of Pteropus (Chiroptera: Pteropodidae)". Acta Chiropterologica. 10: 11–20. Дои:10.3161/150811008X331054. HDL:11336/82001. S2CID 59028595.
- ^ а б c Jones, G .; Тилинг, E.C .; Rossiter, S. J. (2013). "From the ultrasonic to the infrared: Molecular evolution and the sensory biology of bats". Границы физиологии. 4: 117. Дои:10.3389/fphys.2013.00117. ЧВК 3667242. PMID 23755015.
- ^ а б Schwab, I. R. (2005). "A choroidal sleight of hand". Британский журнал офтальмологии. 89 (11): 1398. Дои:10.1136/bjo.2005.077966. ЧВК 1772916. PMID 16267906.
- ^ а б Wood, W. F .; Уолш, А .; Seyjagat, J.; Weldon, P. J. (2005). "Volatile Compounds in Shoulder Gland Secretions of Male Flying Foxes, Genus Pteropus (Pteropodidae, Chiroptera)". Z Naturforsch C. 60 (9–10): 779–784. Дои:10.1515/znc-2005-9-1019. PMID 16320623. S2CID 1938648.
- ^ Wagner, J. (2008). "Glandular secretions of male Pteropus (Flying foxes): preliminary chemical comparisons among species". Independent Study Project (Isp) Collection.
- ^ Li, D .; Чжан, Дж. (2014). "Diet Shapes the Evolution of the Vertebrate Bitter Taste Receptor Gene Repertoire". Молекулярная биология и эволюция. 31 (2): 303–309. Дои:10.1093/molbev/mst219. ЧВК 3907052. PMID 24202612.
- ^ а б c d е ж грамм час я Mickleburgh, S. P.; Hutson, A.M .; Racey, P. A. (1992). Old World fruit bats: An action plan for their conservation (PDF) (Отчет). Gland, Switzerland: МСОП.
- ^ Hengjan, Yupadee; Iida, Keisuke; Doysabas, Karla Cristine C.; Phichitrasilp, Thanmaporn; Ohmori, Yasushige; Hondo, Eiichi (2017). "Diurnal behavior and activity budget of the golden-crowned flying fox (Acerodon jubatus) in the Subic bay forest reserve area, the Philippines". Журнал ветеринарной медицины. 79 (10): 1667–1674. Дои:10.1292/jvms.17-0329. ЧВК 5658557. PMID 28804092.
- ^ а б Heideman, P. D. (1988). "The timing of reproduction in the fruit bat Haplonycteris fischeri (Pteropodidae): Geographic variation and delayed development". Журнал зоологии. 215 (4): 577–595. Дои:10.1111/j.1469-7998.1988.tb02396.x. HDL:2027.42/72984.
- ^ Новак, Р. М .; Pillsbury Walker, E. (1999). Млекопитающие мира Уокера. Volume 1. JHU Press. п. 287. ISBN 9780801857898.
- ^ а б Фокс, Саманта; Spencer, Hugh; O'Brien, Gemma M. (2008). "Analysis of twinning in flying-foxes (Megachiroptera) reveals superfoetation and multiple-paternity". Acta Chiropterologica. 10 (2): 271–278. Дои:10.3161/150811008X414845. S2CID 83506361.
- ^ Sreenivasan, M.A .; Bhat, H.R .; Geevarghese, G. (30 March 1974). "Observations on the Reproductive Cycle of Cynopterus sphinx sphinx Vahl, 1797 (Chiroptera: Pteropidae)". Журнал маммологии. 55 (1): 200–202. Дои:10.2307/1379269. JSTOR 1379269. PMID 4819592.
- ^ а б Дуглас Хэйссен, В .; Van Tienhoven, A.; Van Tienhoven, A. (1993). Паттерны воспроизводства млекопитающих Асделла: сборник данных по конкретным видам. Издательство Корнельского университета. п. 89. ISBN 9780801417535.
- ^ Altringham, John D.; McOwat, Tom; Hammond, Lucy (2011). Bats: from evolution to conservation (2-е изд.). Оксфорд и Нью-Йорк: Издательство Оксфордского университета. п. XV. ISBN 978-0-19-920711-4.
- ^ Kunz, T. H.; Kurta, A. (1987). "Size of bats at birth and maternal investment during pregnancy" (PDF). Симпозиумы Лондонского зоологического общества. 57.
- ^ Safi, K. (2008). "Social Bats: The Males' Perspective". Журнал маммологии. 89 (6): 1342–1350. Дои:10.1644/08-MAMM-S-058.1. S2CID 85733862.
- ^ Crichton, E.G .; Krutzsch, P. H., eds. (2000). Репродуктивная биология летучих мышей. Академическая пресса. п.433. ISBN 9780080540535.
- ^ Racey, D. N.; Peaker, M.; Рэйси, П. А. (2009). "Galactorrhoea is not lactation". Тенденции в экологии и эволюции. 24 (7): 354–355. Дои:10.1016/j.tree.2009.03.008. PMID 19427057.
- ^ Kunz, T. H; Hosken, David J (2009). "Male lactation: Why, why not and is it care?". Тенденции в экологии и эволюции. 24 (2): 80–85. Дои:10.1016/j.tree.2008.09.009. PMID 19100649.
- ^ Schoeman, M. C.; Goodman, S. M. (2012). "Vocalizations in the Malagasy Cave-Dwelling Fruit Bat, Eidolon dupreanum: Possible Evidence of Incipient Echolocation?". Acta Chiropterologica. 14 (2): 409. Дои:10.3161/150811012X661729. S2CID 86613252.
- ^ "Hammer-headed Fruit Bat". BATS Magazine. Vol. 34 нет. 1. 2015. Получено 30 мая 2019.
- ^ Loveless, A. М .; Макби, К. (2017). "Nyctimene robinsoni (Chiroptera: Pteropodidae)". Виды млекопитающих. 49 (949): 68–75. Дои:10.1093 / mspecies / sex007. S2CID 89828640.
- ^ Прат, Йосеф; Тауб, Мор; Йовель, Йоси (2015). «Обучение вокалу у социальных млекопитающих: продемонстрировано экспериментами по изоляции и воспроизведению на летучих мышах». Достижения науки. 1 (2): e1500019. Bibcode:2015SciA .... 1E0019P. Дои:10.1126 / sciadv.1500019. ISSN 2375-2548. ЧВК 4643821. PMID 26601149.
- ^ Верн, С. К. (2017). «Что летучие мыши говорят о речи и языке». Психономический бюллетень и обзор. 24 (1): 111–117. Дои:10.3758 / s13423-016-1060-3. ЧВК 5325843. PMID 27368623.
- ^ Прат, Йосеф; Азулай, Линдси; Дор, Рой; Йовель, Йосси (2017). «Массовое обучение вокалу способствует развитию вокальных диалектов у летучих мышей: Воспроизведение сородичей формирует использование основной частоты щенками». PLOS Биология. 15 (10): e2002556. Дои:10.1371 / journal.pbio.2002556. ISSN 1545-7885. ЧВК 5663327. PMID 29088225.
- ^ Циммер, К. (1 января 2018 г.). "Что ссоры летучих мышей говорят нам об обучении вокалу". Ученый. Получено 23 мая 2019.
- ^ Harten, L .; Prat, Y .; Бен Коэн, S .; Dor, R .; Йовель, Ю. (2019). «Пища для секса у летучих мышей, выявленная как самцы-производители размножаются с ухаживающими самками». Текущая биология. 29 (11): 1895–1900.e3. Дои:10.1016 / j.cub.2019.04.066. PMID 31130455. S2CID 162183551.
- ^ а б Сугита, Н. (2016). "Гомосексуальный фелляция: лизание эрегированного пениса между самцами бонинских летучих лисиц Pteropus pselaphon". PLOS ONE. 11 (11): e0166024. Bibcode:2016PLoSO..1166024S. Дои:10.1371 / journal.pone.0166024. ЧВК 5100941. PMID 27824953.
- ^ а б Tan, M .; Jones, G .; Zhu, G .; Ye, J .; Hong, T .; Чжоу, S .; Zhang, S .; Чжан, Л. (2009). "Фелляция фруктовых летучих мышей продлевает время совокупления". PLOS ONE. 4 (10): e7595. Bibcode:2009PLoSO ... 4.7595T. Дои:10.1371 / journal.pone.0007595. ЧВК 2762080. PMID 19862320.
- ^ а б c Pierson, E.D .; Рейни, В. Э. (1992). «Биология летучих лисиц рода Pteropus: обзор». Биологический отчет. 90 (23).
- ^ а б Dumont, E. R .; О'Нил, Р. (2004). «Жесткость пищи и пищевое поведение у фруктовых летучих мышей Старого Света (Pteropodidae)». Журнал маммологии. 85: 8–14. Дои:10.1644 / BOS-107. S2CID 27275791.
- ^ а б Инь, Q .; Zhu, L .; Liu, D .; Ирвин, Д. М .; Zhang, S .; Пан, Ю. (2016). «Молекулярная эволюция ядерного фактора (полученного из эритроидов 2) - как гена 2 Nrf2 у фруктовых летучих мышей Старого Света (Chiroptera: Pteropodidae)». PLOS ONE. 11 (1): e0146274. Bibcode:2016PLoSO..1146274Y. Дои:10.1371 / journal.pone.0146274. ЧВК 4703304. PMID 26735303.
- ^ Суды, С. Э. (1998). «Стратегии питания фруктовых летучих мышей Старого Света (Megachiroptera, Pteropodidae): как они получают достаточное количество белка?». Обзор млекопитающих. 28 (4): 185–194. Дои:10.1046 / j.1365-2907.1998.00033.x.
- ^ а б c d Норберг, У. И Рейнер, J.M.V. (1987). «Экологическая морфология и полет летучих мышей (Mammalia: Chiroptera): адаптация крыльев, летные характеристики, стратегия поиска пищи и эхолокация». Философские труды Королевского общества B. 316 (1179): 382–383. Bibcode:1987РСПТБ.316..335Н. Дои:10.1098 / рстб.1987.0030.
- ^ Hodgkison, R .; Лысеющий, С. Т .; Зубайд, А .; Кунц, Т. Х. (2003). «Плодовые летучие мыши (Chiroptera: Pteropodidae) как рассеиватели семян и опылители в низинных тропических лесах Малайзии1». Биотропика. 35 (4): 491–502. Дои:10.1111 / j.1744-7429.2003.tb00606.x.
- ^ Шилтон, Л. А .; Altringham, J.D .; Compton, S.G .; Уиттакер, Р. Дж. (1999). «Летучие мыши Старого Света могут распространять семена на большие расстояния за счет длительного удержания жизнеспособных семян в кишечнике». Труды Лондонского королевского общества. Серия B: Биологические науки. 266 (1416): 219–223. Дои:10.1098 / rspb.1999.0625. ЧВК 1689670.
- ^ Алексей, Р .; Рэйси, П. А .; Джонс, Г. (2015). «Отслеживание GPS с высоким разрешением позволяет выявить выбор места обитания и возможность распространения семян мадагаскарских летучих лисиц Pteropus rufus на большие расстояния». Глобальная экология и сохранение. 3: 690. Дои:10.1016 / j.gecco.2015.02.012.
- ^ Корлетт, Р. Т. (2017). «Бережливость и распространение семян позвоночными животными в тропической и субтропической Азии: обновленная информация». Глобальная экология и сохранение. 11: 13. Дои:10.1016 / j.gecco.2017.04.007.
- ^ Reeder, D. M .; Kunz, T. H .; Видмайер, Э. П. (2004). «Исходные и вызванные стрессом глюкокортикоиды во время размножения у изменчивой летучей лисицы, Pteropus hypomelanus (Chiroptera: Pteropodidae)». Журнал экспериментальной зоологии. 301A (8): 682–690. Дои:10.1002 / jez.a.58. PMID 15286948.
- ^ Buden, D .; Helgen, K. M .; Уайлс, Г. (2013). «Таксономия, распространение и естественная история летучих лисиц (Chiroptera, Pteropodidae) на островах Мортлок и в штате Чуук, Каролинские острова». ZooKeys (345): 97–135. Дои:10.3897 / zookeys.345.5840. ЧВК 3817444. PMID 24194666.
- ^ Esselstyn, J.A .; Amar, A .; Джанеке, Д. (2006). «Влияние посттайфунной охоты на морских летучих мышей (Pteropus mariannus)». Тихоокеанская наука. 60 (4): 531–532. Дои:10.1353 / psc.2006.0027. S2CID 55543225.
- ^ Адаме, Мария Фернанда; Jardine, T. D .; Фрай, Б .; Valdez, D .; Lindner, G .; Nadji, J .; Банн, С. Э. (2018). «Устьевые крокодилы в тропической прибрежной пойме получают питание от наземной добычи». PLOS ONE. 13 (6): e0197159. Bibcode:2018PLoSO..1397159A. Дои:10.1371 / journal.pone.0197159. ЧВК 5991389. PMID 29874276.
- ^ Летучие лисицы против пресноводного крокодила (видео). BBC Earth. 10 апреля 2015 г.. Получено 22 мая 2019.
- ^ Рамасиндразана, Б .; Goodman, S.M .; Gomard, Y .; Dick, C.W .; Тортоса, П. (2017). «Скрытое разнообразие летучих мышей Nycteribiidae (Diptera) из Малагасийского региона и сведения о взаимодействиях паразита и хозяина». Паразиты и векторы. 10 (1): 630. Дои:10.1186 / s13071-017-2582-х. ЧВК 5747079. PMID 29284533.
- ^ Ramanantsalama, R. V .; Андрианаримиса, А .; Raselimanana, A.P .; Гудман, С. М. (2018). «Показатели потребления гематофагов-эктопаразитов во время ухода за эндемичными плодовыми летучими мышами Мадагаскара». Паразиты и векторы. 11 (1): 330. Дои:10.1186 / s13071-018-2918-1. ЧВК 5984742. PMID 29859123.
- ^ Деш, К. Э. (1981). «Новый вид клеща-демодицида (Acari: Prostigmata) из Западной Австралии, паразитирующий на Macroglossus minimus (Chiroptera: Pteropodidae)» (PDF). Записи Музея Западной Австралии. 9 (1): 41–47.
- ^ Ландау, I .; Chavatte, J.M .; Караджян, Г .; Chabaud, A .; Беверидж, И. (2012). «Гемоспоридические паразиты летучих мышей с описанием Спраттиелла алектоген. Ноябрь, sp. Ноя ". Паразит. 19 (2): 137–146. Дои:10.1051 / паразит / 2012192137. ЧВК 3671437. PMID 22550624.
- ^ Kingdon, J .; Happold, D .; Бутынский, Т .; Hoffmann, M .; Happold, M .; Калина, Дж. (2013). Млекопитающие Африки. 4. A&C Black. ISBN 9781408189962.
- ^ а б c Бенда, Петр; Валло, Питер; Хульва, Павел; Горачек, Иван (2012). «Египетская плодовая летучая мышь Rousettus aegyptiacus (Chiroptera: Pteropodidae) в Палеарктике: географическая изменчивость и таксономический статус». Биология. 67 (6). Дои:10.2478 / s11756-012-0105-у. S2CID 14907114.
- ^ Mickleburgh, S .; Hutson, A.M .; Bergmans, W .; Fahr, J .; Рэйси, П.А. (2008). "Eidolon helvum". Красный список видов, находящихся под угрозой исчезновения МСОП. 2008: e.T7084A12824968. Дои:10.2305 / IUCN.UK.2008.RLTS.T7084A12824968.en.
- ^ Чжан, Цзинь-Шо; Джонс, Гарет; Чжан Ли-Бяо; Чжу Гуан-Цзянь; Чжан, Шу-И (2010). «Недавние исследования летучих мышей (Mammalia: Chiroptera) из Китая II. Pteropodidae». Acta Chiropterologica. 12: 103–116. Дои:10.3161 / 150811010X504626. S2CID 86402486.
- ^ Винсено, К. (2017). "Pteropus dasymallus". Красный список видов, находящихся под угрозой исчезновения МСОП. МСОП. 2017: e.T18722A22080614. Дои:10.2305 / IUCN.UK.2017-2.RLTS.T18722A22080614.en.
- ^ Маэда, К. (2008). «Pteropus loochoensis». Красный список видов, находящихся под угрозой исчезновения МСОП. 2008: e.T18773A8614831. Дои:10.2305 / IUCN.UK.2008.RLTS.T18773A8614831.en.
- ^ Винсено, К. (2017). "Pteropus pselaphon". Красный список видов, находящихся под угрозой исчезновения МСОП. МСОП. 2017: e.T18752A22085351. Дои:10.2305 / IUCN.UK.2017-2.RLTS.T18752A22085351.en.
- ^ а б Allison, A .; Bonaccorso, F .; Хелген, К. и Джеймс, Р. (2008). "Pteropus mariannus". Красный список видов, находящихся под угрозой исчезновения МСОП. МСОП. 2008: e.T18737A8516291. Дои:10.2305 / IUCN.UK.2008.RLTS.T18737A8516291.en.
- ^ а б c «Таксономия = Pteropodidae, Сухопутные регионы = Западная и Центральная Азия, Южная и Юго-Восточная Азия». МСОП. Получено 24 августа 2019.
- ^ Тейт, Джессика; Perotto-Baldivieso, Humberto L .; Маккеун, Адам; Уэсткотт, Дэвид А. (2014). «Летучие лисицы едут в город? Урбанизация очковой летучей лисицы (Pteropus conspicillatus) в Австралии». PLOS ONE. 9 (10): e109810. Bibcode:2014PLoSO ... 9j9810T. Дои:10.1371 / journal.pone.0109810. ЧВК 4190360. PMID 25295724.
- ^ а б "Taxonomy = Pteropodidae, Land Regions = Oceania". МСОП. Получено 24 августа 2019.
- ^ Jones, K. E .; Mickleburgh, S.P .; Sechrest, W .; Уолш, А. «Глобальный обзор сохранения островных летучих мышей: важные проблемы и возможности». В Fleming, T. H .; Рэйси, П. А. (ред.). Эволюционная экология и сохранение островных летучих мышей. Издательство Чикагского университета.
- ^ Mickleburgh, S .; Waylen, K .; Рэйси, П. (2009). «Летучие мыши как мясо диких животных: глобальный обзор». Орикс. 43 (2): 217. Дои:10,1017 / с0030605308000938.
- ^ Banack, S.A .; Murch, S.J .; Кокс, П. А. (2006). «Нейротоксичные летучие лисицы в качестве продуктов питания для народа чаморро, Марианские острова». Журнал этнофармакологии. 106 (1): 97–104. Дои:10.1016 / j.jep.2005.12.032. PMID 16457975.
- ^ Cox, P .; Дэвис, Д .; Маш, Д .; Metcalf, J. S .; Банак, С. А. (2016). «Воздействие токсина окружающей среды на пищу вызывает нейрофибриллярные сплетения и отложения амилоида в головном мозге». Труды Королевского общества B. 283 (3): 1–10. Дои:10.1098 / rspb.2015.2397. ЧВК 4795023. PMID 26791617.
- ^ Holtcamp, W. (2012). «Возникающая наука о BMAA: способствуют ли цианобактерии нейродегенеративным заболеваниям?». Перспективы гигиены окружающей среды. 120 (1823): a110 – a116. Дои:10.1289 / ehp.120-a110. ЧВК 3295368. PMID 22382274.
- ^ а б c Хассанин, А .; Nesi, N .; Marin, J .; Kadjo, B .; Pourrut, X .; Leroy, É .; Gembu, G .; Musaba Akawa, P .; Ngoagouni, C .; Nakouné, E .; Ruedi, M .; Tshikung, D .; Pongombo Shongo, C .; Бонильо, К. (2016). «Сравнительная филогеография африканских летучих мышей (Chiroptera, Pteropodidae) позволяет по-новому взглянуть на вспышку болезни, вызванной вирусом Эбола, в Западной Африке в 2014–2016 годах». Comptes Rendus Biologies. 339 (11–12): 517–528. Дои:10.1016 / j.crvi.2016.09.005. PMID 27746072.
- ^ а б c d «Марбургская геморрагическая лихорадка». Всемирная организация здоровья. Получено 30 мая 2019.
- ^ а б «Хронология вспышек марбургской геморрагической лихорадки». Центры по контролю и профилактике заболеваний. 9 октября 2014 г.. Получено 30 мая 2019.
- ^ «Эбола (болезнь, вызванная вирусом Эбола): передача». Центры по контролю и профилактике заболеваний. 17 мая 2019. Получено 30 мая 2019.
- ^ «Исследование резервуаров Эболы». Центры по контролю и профилактике заболеваний. 9 июля 2018 г.. Получено 30 мая 2019.
- ^ Купфершмидт, К. (24 января 2019 г.). «Этот вид летучих мышей может быть источником эпидемии лихорадки Эбола, унесшей жизни более 11 000 человек в Западной Африке». Наука. Получено 30 мая 2019.
- ^ Zon, H .; Петеш, К. (21 сентября 2016 г.). «После Эболы западноафриканцы с риском возвращаются к дичи». Ассошиэйтед Пресс. Получено 30 мая 2019.
- ^ "Бешенство и фактологический бюллетень об австралийской лиссавирусной инфекции летучих мышей". health.nsw.gov.au. Министерство здравоохранения штата Новый Южный Уэльс, Новый Южный Уэльс, 2015 г. 30 ноября 2015 г.. Получено 14 июн 2018.
- ^ «Болезнь, вызванная вирусом Хендры (HeV)» (PDF). cdc.gov. Министерство здравоохранения и социальных служб США. Получено 14 июн 2018.
- ^ Sánchez, C.A .; Бейкер, М. Л. (2016). «Восприятие риска заболевания и меры безопасности: исследование австралийских реабилитологов Flying Fox». PLOS забытые тропические болезни. 10 (2): e0004411. Дои:10.1371 / journal.pntd.0004411. ЧВК 4734781. PMID 26829399.
- ^ «Вакцина Хендры». ava.com. Австралийская ветеринарная ассоциация (AVA). 2018 г.. Получено 14 июн 2018.
- ^ Гулланд, А. (12 июня 2018 г.). «Вирус нипах« находится под контролем »в Индии - но Великобритания и мир должны быть готовы к появлению признаков зараженных путешественников». Телеграф. Telegraph Media Group Limited 2018. Получено 14 июн 2018.
- ^ «Вирус Нипах». Всемирная организация здоровья. ВОЗ. 30 мая 2018. Получено 14 июн 2018.
- ^ Hahn, M. B .; Epstein, J. H .; Gurley, E. S .; Islam, M. S .; Luby, S.P .; Daszak, P .; Патц, Дж. А. (2014). «Гнездовое поведение и выбор среды обитания Pteropus giganteus выявили потенциальную связь с эпидемиологией вируса Нипах». Журнал прикладной экологии. 51 (2): 376–387. Дои:10.1111/1365-2664.12212. ЧВК 4000083. PMID 24778457.
- ^ а б Bowden, T. R .; Westenberg, M .; Wang, L .; Eaton, B.T .; Бойл, Д. Б. (2001). «Молекулярная характеристика вируса Менангле, нового парамиксовируса, который поражает свиней, летучих мышей и людей». Журнал вирусологии. 283 (2): 358–73. Дои:10.1006 / viro.2001.0893. PMID 11336561.
- ^ а б Яманака, А .; Iwakiri, A .; Yoshikawa, T .; Sakai, K .; Singh, H .; Himeji, D .; Kikuchi, I .; Ueda, A .; Ямамото, S .; Миура, М .; Shioyama, Y .; Kawano, K .; Nagaishi, T .; Сайто, М .; Minomo, M .; Iwamoto, N .; Hidaka, Y .; Sohma, H .; Кобаяши, Т .; Kanai, Y .; Кавагиси, Т .; Nagata, N .; Fukushi, S .; Mizutani, T .; Tani, H .; Taniguchi, S .; Fukuma, A .; Shimojima, M .; Куране, И .; и другие. (2014). «Завезенный случай острой инфекции дыхательных путей, связанной с представителем ортореовируса вида Нельсон Бэй». PLOS ONE. 9 (3): e92777. Bibcode:2014PLoSO ... 992777Y. Дои:10.1371 / journal.pone.0092777. ЧВК 3965453. PMID 24667794.
- ^ Smith, I .; Ван, Л. (2013). «Летучие мыши и их виром: важный источник новых вирусов, способных заражать людей». Текущее мнение в вирусологии. 3 (1): 84–91. Дои:10.1016 / j.coviro.2012.11.006. ЧВК 7102720. PMID 23265969.
- ^ Кэмпбелл-Маклеод, П. (2013). "Наллавилли-сядьте (и слушайте): сказки о времени мечты - устная традиция". В Макдональде, М. Р. (ред.). Традиционное повествование сегодня: международный справочник. С. 158–159. ISBN 978-1135917142.
- ^ Slone, T.H., изд. (2001). Тысяча одна ночь в Папуа-Новой Гвинее: сказки 1972–1985 годов. 1. Масалаи Пресс. ISBN 978-0971412712.
- ^ Приход, С .; Richards, G .; Холл, Л. (2012). Естественная история австралийских летучих мышей: работа в ночную смену. Csiro Publishing. ISBN 978-0643103764.
- ^ а б Британский музей. Отдел британских и средневековых древностей и этнографии; Joyce, T. A .; Дальтон, О. М. (1910). Справочник по этнографическим коллекциям. Отпечатано по распоряжению попечителей. п. 125.
- ^ Махрей, Роберт (1899). «Странные виды денег». Ежемесячный иллюстрированный журнал Harmsworth. 1: 639–641.
- ^ Вернесс; Х. Б. (2003). Энциклопедия континуума местного искусства: мировоззрение, символизм и культура в Африке, Океании и Северной Америке. A&C Black. п. 31. ISBN 978-0826414656.
- ^ а б Чой, Чарльз (16 октября 2017 г.). «В Макире зубы летучей лисы - это валюта ... и это может спасти вид». Обнаружить. Kalmbach Media. Получено 2 июн 2018.
- ^ Лавери, Тайрон Н; Фаси, Джон (2017). «Покупка сквозь зубы: традиционная валюта и сохранение летучих лисиц Pteropus spp. На Соломоновых островах». Орикс. 53 (3): 1–8. Дои:10.1017 / S0030605317001004.
- ^ Азиз, С. А .; Olival, K. J .; Bumrungsri, S .; Richards, G.C .; Рэйси, П. А. (2016). «Конфликт между птероподовыми летучими мышами и производителями фруктов: виды, законодательство и меры по смягчению последствий». In Voigt, C .; Кингстон, Т. (ред.). Летучие мыши в антропоцене: сохранение летучих мышей в меняющемся мире. Springer. Дои:10.1007/978-3-319-25220-9_13. ISBN 978-3-319-25220-9.
- ^ «Таксономия = Pteropodidae». Красный список видов, находящихся под угрозой исчезновения МСОП. 2019. Получено 19 мая 2019.
- ^ Mildenstein, T .; Tanshi, I .; Рэйси, П. А. (2016). «Использование летучих мышей для производства мяса диких животных и лекарств». Летучие мыши в антропоцене: сохранение летучих мышей в меняющемся мире. Springer. п. 327. Дои:10.1007/978-3-319-25220-9_12. ISBN 978-3-319-25218-6. S2CID 130038936.
- ^ Vincenot, C.E .; Koyama, L .; Руссо, Д. (2015). «Почти угроза? Первое сообщение о неожиданных факторах сокращения численности летучей лисы Рюкю (Pteropus dasymallus) в Японии, вызванных деятельностью человека». Биология млекопитающих - Zeitschrift für Säugetierkunde. 80 (4): 273. Дои:10.1016 / j.mambio.2015.03.003.
- ^ Vincenot, C.E .; Florens, F. B. V .; Кингстон, Т. (2017). «Можем ли мы защитить островных летучих лисиц?». Наука. 355 (6332): 1368–1370. Bibcode:2017Научный ... 355.1368V. Дои:10.1126 / science.aam7582. PMID 28360279. S2CID 206657272.
- ^ McIlwee, A. P .; Мартин, Л. (2002). «О внутренней способности к увеличению австралийских летучих лисиц (Pteropus spp., Megachiroptera)». Австралийский зоолог. 32: 93. Дои:10.7882 / AZ.2002.008.
- ^ Мартин, Л. (2011). «Являются ли фрукты, которые вы едите, дружелюбными к летучей лисице? Воздействие решеток электрического тока в саду на австралийских летучих лисиц (Pteropus spp., Megachiroptera)». Биология и сохранение австралийских летучих мышей. Королевское зоологическое общество Нового Южного Уэльса. С. 380–390. Дои:10.7882 / FS.2011.039. ISBN 978-0-9803272-4-3.
- ^ Хлопицки, К. (28 октября 2016 г.). «Электрические провода угрожают летучим лисицам и их детенышам». Дейли Телеграф. News Pty Ltd. Получено 26 июн 2018.
- ^ Welbergen, J. A .; Klose, S.M .; Маркус, Н .; Эби, П. (2008). «Изменение климата и влияние экстремальных температур на австралийских летучих лисиц» (PDF). Труды Королевского общества B: биологические науки. 275 (1633): 419–425. Дои:10.1098 / rspb.2007.1385. ЧВК 2596826. PMID 18048286.
- ^ Buden, D .; Helgen, K. M .; Уайлс, Г. (2013). «Таксономия, распространение и естественная история летучих лисиц (Chiroptera, Pteropodidae) на островах Мортлок и в штате Чуук, Каролинские острова». ZooKeys (345): 124. Дои:10.3897 / zookeys.345.5840. ЧВК 3817444. PMID 24194666.
- ^ Вальдес, Эрнест В. (2010). Оценка популяции марианской плодовой летучей мыши (Pteropus mariannus mariannus) на Анатахане, Саригане, Гугуане, Аламагане, Пагане, Агрихане, Асунсьоне и Мауге (PDF) (Отчет). USGS. п. 2. Получено 24 августа 2019.
- ^ Fleming, T. H .; Рэйси, П. А., ред. (2010). Островные летучие мыши: эволюция, экология и сохранение. Издательство Чикагского университета. п. 415. ISBN 9780226253312.
внешняя ссылка
 СМИ, связанные с Pteropodidae в Wikimedia Commons
СМИ, связанные с Pteropodidae в Wikimedia Commons Данные, относящиеся к Pteropodidae в Wikispecies
Данные, относящиеся к Pteropodidae в Wikispecies