WikiDer > Трибромид сурьмы
 | |
| Имена | |
|---|---|
| Название ИЮПАК трибромстибан | |
| Другие имена Бромид сурьмы (III) | |
| Идентификаторы | |
3D модель (JSmol) | |
| ChemSpider | |
| ECHA InfoCard | 100.029.254 |
| Номер ЕС |
|
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| Номер ООН | 1549 |
| |
| |
| Характеристики | |
| СбБР3 | |
| Молярная масса | 361,472 г / моль |
| Внешность | от бесцветных до желтых кристаллов гигроскопичный |
| Плотность | 4,35 г / см3 |
| Температура плавления | 96,6 ° С (205,9 ° F, 369,8 К) |
| Точка кипения | 288 ° С (550 ° F, 561 К) |
| растворимый, частичный гидролиз | |
| Растворимость | растворим в разбавленном HCl, HBr, CS2, ацетон, бензол, хлороформ, аммиак, алкоголь |
| -115.0·10−6 см3/ моль | |
| 1.74 | |
| 2.47 D | |
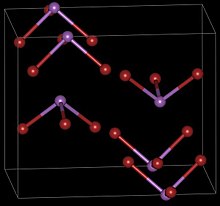
| Структура | |
| Орторомбический, oP16, SpaceGroup = Pnma, No. 62 (β форма) | |
| Термохимия | |
Теплоемкость (C) | 96 Дж / моль К |
Станд. Энтальпия формирование (ΔжЧАС⦵298) | -259 кДж / моль |
| Опасности | |
| Пиктограммы GHS |   |
| Сигнальное слово GHS | Предупреждение |
| H302, H332, H411 | |
| P261, P264, P270, P271, P273, P301 + 312, P304 + 312, P304 + 340, P312, P330, P391, P501 | |
| Смертельная доза или концентрация (LD, LC): | |
LD50 (средняя доза) | 7000 мг / кг |
| NIOSH (Пределы воздействия на здоровье в США): | |
PEL (Допустимо) | TWA 0,5 мг / м3 (как Sb)[1] |
REL (Рекомендуемые) | TWA 0,5 мг / м3 (как Sb)[1] |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Трибромид сурьмы (SbBr3) это химическое соединение содержащий сурьму в степени окисления +3.
Производство
Это может быть реакцией сурьма с элементалью бром, или по реакции триоксид сурьмы с бромистоводородная кислота.
В качестве альтернативы его можно получить действием брома на смесь сульфид сурьмы и триоксид сурьмы при 250 ° С.
Использует
Его можно добавить в полимеры Такие как полиэтилен как огнестойкий материал.[2] Он также используется в производстве других соединений сурьмы, в химическом анализе, как едкий, и в крашении. [3]
Химические свойства
Трибромид сурьмы имеет две кристаллические формы, каждая из которых имеет ромбический симметрии. Когда тепло сероуглерод раствор SbBr3 быстро охлаждается, кристаллизуется в игольчатый α-SbBr3, который затем медленно переходит в более стабильную β-форму.[4]
Трибромид сурьмы гидролизуется в воде с образованием бромистоводородной кислоты и триоксида сурьмы:
- 2 сбн3 + 3 часа2O → Sb2О3 + 6 HBr
Рекомендации
- ^ а б Карманный справочник NIOSH по химической опасности. "#0036". Национальный институт охраны труда и здоровья (NIOSH).
- ^ Ян, Ю. П .; Д. Г. Брюэр; Дж. Э. С. Венарт (1991). «Исследование синергетического действия оксида сурьмы в огнестойком полиэтилене». Огонь и материалы. 15: 37–42. Дои:10.1002 / fam.810150107.
- ^ «Трибромид сурьмы» http://cameochemicals.noaa.gov/chemical/2501
- ^ Окуда, Цутому; Терао, Хиромицу; Эге, Осаму; Негита, Хисао (1970). «Структурные исследования трибромида сурьмы и его молекулярного комплекса с бензолом с помощью ядерного квадрупольного резонанса 81Br». Бюллетень химического общества Японии. 43 (8): 2398. Дои:10.1246 / bcsj.43.2398.
| Этот неорганический сложный–Связанная статья является заглушка. Вы можете помочь Википедии расширяя это. |