WikiDer > Метилнитрит
 | |
| Идентификаторы | |
|---|---|
3D модель (JSmol) | |
| ChemSpider | |
| ECHA InfoCard | 100.009.882 |
PubChem CID | |
| UNII | |
| |
| |
| Характеристики | |
| CЧАС3NО2 | |
| Молярная масса | 61.040 г · моль−1 |
| Внешность | Желтый газ[1] |
| Плотность | 0,991 г / см3[1] |
| Температура плавления | -16 ° С (3 ° F, 257 К)[1] |
| Точка кипения | -12 ° С (10 ° F, 261 К)[1] |
| Термохимия[2] | |
Станд. Энтальпия формирование (ΔжЧАС⦵298) | -66,1 кДж / моль |
| Опасности | |
| Паспорт безопасности | Внешний паспорт безопасности материалов |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
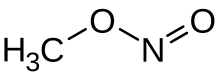
Метилнитрит является органическое соединение с химическая формула CH
3ONO. Это газ, и самый простой алкилнитрит.
Структура
При комнатной температуре метилнитрит существует в виде смеси СНГ и транс конформеры. В СНГ конформер составляет 3,13 кДж моль−1 более стабильный, чем транс форма, с энергетический барьер до вращения 45,3 кДж моль−1.[3] Цис- и транс-структура также была определена с помощью микроволновой спектроскопии (см. Внешние ссылки).
 |  |
Синтез
Метилнитрит может быть получен реакцией серебро нитрит с йодметан: Нитрит серебра (AgNO2) существует в растворе как серебро ион, Ag+ и нитрит-ион NO2−. Один из одинокие пары на кислороде из нитрит-иона нападения метильная группа (-CH3), выпуская йодид ион в раствор.[4] В отличие от нитрита серебра, йодид серебра очень нерастворимый в воде и, таким образом, образует твердое вещество.[5] Обратите внимание, что азот является лучшим нуклеофилом, чем кислород и большинство нитритов будут реагировать через SN2-подобный механизм, и основным продуктом будет нитрометан. Например, натрий и нитрит калия при взаимодействии с иодметаном образуется в основном нитрометан с метилнитритом в качестве второстепенного продукта. Однако присутствие иона серебра в растворе оказывает стабилизирующее влияние на образование карбокатион промежуточные звенья, увеличивая процентный выход метилнитрита. В любом случае образуются нитрометан и метилнитрит.[4]
На рисунке показаны две газофазные структуры метилнитрита, определенные с помощью ИК- и микроволновой спектроскопии.
Метилнитрит, свободный от нитрометана, может быть получен реакцией йодметана с диоксид азота:
- 2 CH
3я + 2 НЕТ
2 → 2 CH
3НЕТ
2 + я
2
Это соединение образуется при сгорании неэтилированный бензин, и может быть причиной снижения насекомые, и, следовательно, домашний воробей и другие певчие птицы в Европа.[6]
Метилнитрит также присутствует в старом сигаретном дыме. Здесь он предположительно образован из оксид азота (сам образуется в результате самоокисления оксид азота) и метанол.[7]
Свойства и использование
Метилнитрит - это окислитель и термочувствительное взрывчатое вещество; его чувствительность увеличивается в присутствии оксидов металлов. С неорганическими основаниями образует взрывоопасные соли. Образует с воздухом взрывоопасные смеси. Он используется как ракетное топливо, а одноразовое топливо.[8] Он взрывается сильнее, чем этилнитрит. Низшие алкилнитриты могут разлагаться и взорвать контейнер даже при хранении в холодильнике.[9]
Метилнитрит - ядовитый удушающий газ, сильнодействующий синюшный агент. Воздействие может привести к метгемоглобинемия.[10]
Метилнитрит используется в химическом синтезе в качестве прекурсора и промежуточного продукта, например во время производства фенилпропаноламин.[10]
Смотрите также
Рекомендации
- ^ а б c d Хейнс, стр. 3,382
- ^ Хейнс, стр. 5.20
- ^ Van Der Veken, B.J .; Maas, R .; Guirgis, G.A .; Stidham, H.D .; Sheehan, T. G .; Дуриг, Джеймс Р. (1990). «Инфракрасный спектр, ab initio расчеты, барьеры внутреннего вращения и структурные параметры для метилнитрита». Журнал физической химии. 94 (10): 4029–39. Дои:10.1021 / j100373a028.
- ^ а б Павия, Дональд Л .; Лэмпман, Гэри М .; Криз, Джордж С. (2004). Органическая химия. 2. Мейсон, Огайо: Томпсон Custom Publishing. ISBN 978-0-03-014813-2. OCLC 236055357.
- ^ Даррелл Д. Эббинг; Стивен Д. Гаммон (2005). Общая химия (8-е изд.). Бостон: Хоутон Миффлин. ISBN 978-0-618-39941-3.
- ^ Саммерс-Смит, Дж. Денис (Сентябрь 2007 г.). «Является ли неэтилированный бензин фактором упадка городских Домовых воробьев?». Британские птицы. 100: 558. ISSN 0007-0335.
- ^ Родгман, Алан; Перфетти, Томас А. (19 апреля 2016 г.). Химические компоненты табака и табачного дыма. ISBN 9781466515529.
- ^ Метилнитрит. Cameochemicals.noaa.gov. Проверено 10 марта 2019.
- ^ Бретерик, Л. (27 октября 2016 г.). Справочник Бретерика по опасностям, связанным с химически активными веществами. ISBN 9781483162508.
- ^ а б МЕТИЛНИТРИТ - База данных HSDB Национальной медицинской библиотеки. Toxnet.nlm.nih.gov. Проверено 10 марта 2019.
Цитированные источники
- Хейнс, Уильям М., изд. (2011). CRC Справочник по химии и физике (92-е изд.). CRC Press. ISBN 978-1439855119.
внешняя ссылка
| Викискладе есть медиафайлы по теме Метилнитрит. |
