WikiDer > Фторметан
| Имена | |||
|---|---|---|---|
| Название ИЮПАК Фторметан | |||
| Другие имена Фреон 41 Метилфторид | |||
| Идентификаторы | |||
3D модель (JSmol) | |||
| Сокращения | R41 | ||
| 1730725 | |||
| ЧЭБИ | |||
| ЧЭМБЛ | |||
| ChemSpider | |||
| ECHA InfoCard | 100.008.907 | ||
| Номер ЕС |
| ||
| 391 | |||
| КЕГГ | |||
| MeSH | Фторметан | ||
PubChem CID | |||
| UNII | |||
| Номер ООН | ООН 2454 | ||
| |||
| |||
| Характеристики | |||
| CH3F | |||
| Молярная масса | 34,03 г / моль | ||
| Внешность | Бесцветный газ | ||
| Запах | приятный эфирный запах при высоких концентрациях | ||
| Плотность | 1,4397 г / л 0,557 г / см3 (жидкость) при давлении насыщения при 25 ° C | ||
| Температура плавления | -137,8 ° С (-216,0 ° F, 135,3 К) [1] | ||
| Точка кипения | -78,4 ° С (-109,1 ° F, 194,8 К) [1] | ||
| 1,66 л / кг (2,295 г / л) | |||
| Давление газа | 3,3 МПа | ||
| Опасности | |||
Классификация ЕС (DSD) (устарело) | |||
| R-фразы (устарело) | R12 | ||
| S-фразы (устарело) | S9, S16, S23, S24 / 25, S26, S28, S33, S36 / 37/39, S60 | ||
| NFPA 704 (огненный алмаз) | |||
Если не указано иное, данные для материалов приведены в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Фторметан, также известный как метилфторид, Фреон 41, Галоген-41 и ГФУ-41, нетоксичный, сжижаемый и легковоспламеняющийся газ при стандартной температуре и давлении. Это сделано из углерод, водород, и фтор. Название связано с тем, что это метан (CH4) с замещением одного из атомов водорода атомом фтора. Он используется в процессах производства полупроводников в качестве травильного газа в реакторах плазменного травления.[2]
Сочинение
Соединение является самым низким массовым членом гидрофторуглерод (HFC), соединения, содержащие только водород, фтор и углерод. Эти соединения относятся к хлорфторуглероды (CFC), но поскольку они не содержат хлора, они не разрушают озоновый слой.[3] Однако фторуглероды являются мощными парниковыми газами, и Кигалийская поправка к Монреальский протокол является попыткой их постепенного отказа из-за их вклада в глобальное потепление.[4]
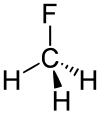
C − F энергия связи составляет 552 кДж / моль, а его длина составляет 0,139 нм (обычно 0,14 нм). Его молекулярная геометрия тетраэдрическая.
Его удельная теплоемкость (Cп) составляет 38,171 Дж · моль−1· K−1 при 25 ° С. В критическая точка фторметана составляет 44,9 ° C (318,1 K) и 6,280 МПа.
Рекомендации
- ^ а б Записывать в базе данных веществ GESTIS Институт охраны труда и здоровья
- ^ Зигемунд, Гюнтер; Швертфегер, Вернер; Фейринг, Эндрю; Умный, Брюс; Бер, Фред; Фогель, Гервард; Маккусик, Блейн (2002). «Соединения фтора, органические». Энциклопедия промышленной химии Ульмана. Вайнхайм: Wiley-VCH. Дои:10.1002 / 14356007.a11_349.
- ^ Фторметан CH3F
- ^ «Объяснение: гидрофторуглероды спасли озоновый слой, так почему мы запрещаем их?».