WikiDer > Тетрафторид ванадия
| Имена | |||
|---|---|---|---|
| Название ИЮПАК тетрафторид ванадия | |||
| Идентификаторы | |||
3D модель (JSmol) | |||
| ChemSpider | |||
| ECHA InfoCard | 100.030.143 | ||
| Номер ЕС |
| ||
PubChem CID | |||
| UNII | |||
| Номер ООН | UN2923 | ||
| |||
| |||
| Характеристики | |||
| F4V | |||
| Молярная масса | 126.9351 г · моль−1 | ||
| Внешность | Лаймовый зеленый порошок, гигроскопичный[1] | ||
| Запах | Без запаха | ||
| Плотность | 3,15 г / см3 (20 ° С)[1] 2,975 г / см3 (23 ° С)[2] | ||
| Температура плавления | 325 ° С (617 ° F, 598 К) при 760 мм рт. ст. разлагается[1] | ||
| Точка кипения | Возвышенные[1] | ||
| Очень растворим[1] | |||
| Растворимость | Растворим в ацетон, уксусная кислота Очень мало растворим в ТАК2Cl2, спирты, CHCl3[2] | ||
| Структура | |||
| Моноклиника, mP10 | |||
| P21/ с, №14 | |||
| Термохимия | |||
Стандартный моляр энтропия (S | 126 Дж / моль · К[3] | ||
Станд. Энтальпия формирование (ΔжЧАС⦵298) | −1412 кДж / моль[3] | ||
Свободная энергия Гиббса (Δжграмм˚) | −1312 кДж / моль[3] | ||
| Опасности | |||
| Пиктограммы GHS |   [4] [4] | ||
| Сигнальное слово GHS | Опасность | ||
| H300, H330, H314, H318[4] | |||
| P260, P301 + 310, P303 + 361 + 353, P304 + 340, P305 + 351 + 338, P320, P330, P405, P501[4] | |||
| Глаз опасность | Вызывает серьезные повреждения | ||
| Кожа опасность | Вызывает ожоги | ||
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |||
| Ссылки на инфобоксы | |||
Фторид ванадия (IV) (VF4) является неорганическое соединение из ванадий и фтор. это парамагнитный желто-коричневое твердое вещество, очень гигроскопичный.[2] В отличие от соответствующих тетрахлорид ванадиятетрафторид не является летучим, поскольку имеет полимерную структуру. Он разлагается перед таянием.
Подготовка и реакции
VF4 можно получить путем обработки VCl4 с HF:
- VCl4 + 4 ВЧ → ВЧ4 + 4 HCl
Первоначально его готовили таким образом.[5]
Он разлагается при 325 ° C, подвергаясь диспропорционированию три- и пентафториды:[2]
- 2 VF4 → VF3 + VF5
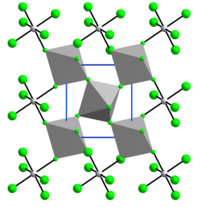
Структура
Структура VF4 связано с тем из SnF4. Каждый центр ванадия является октаэдрическим, окруженным шестью фторидными лигандами. Четыре фторидных центра мост к соседним центрам ванадия.[6]
Рекомендации
- ^ а б c d е Лиде, Дэвид Р., изд. (2009). CRC Справочник по химии и физике (90-е изд.). Бока-Ратон, Флорида: CRC Press. ISBN 978-1-4200-9084-0.
- ^ а б c d Квасник, В. (1963). Брауэр, Георг (ред.). Справочник по препаративной неорганической химии (Великобритания). Лондон: Academic Press. стр.252–253.
- ^ а б c Анатольевич, Кипер Руслан. «фторид ванадия (IV)». http://chemister.ru. Получено 2014-06-25. Внешняя ссылка в
| сайт =(помощь) - ^ а б c «Фторид ванадия (IV) 95%». http://www.alfa.com. Альфа Эзар. Получено 2014-06-25. Внешняя ссылка в
| сайт =(помощь) - ^ Отто Рафф, Герберт Ликфетт "Ванадинфторид" Chemische Berichte 1911, т. 44, страницы 2539–2549. Дои:10.1002 / cber.19110440379
- ^ Беккер С., Мюллер Б. Г. Тетрафторид ванадия, Энгью. Chem. Intnl. Эд. Англ. 1990, т. 29, стр. 406
- WebElements
- Коттон, Ф. Альберт; Уилкинсон, Джеффри; Мурильо, Карлос А .; Бохманн, Манфред (1999), Продвинутая неорганическая химия (6-е изд.), Нью-Йорк: Wiley-Interscience, ISBN 0-471-19957-5
| Этот неорганический сложный–Связанная статья является заглушка. Вы можете помочь Википедии расширяя это. |