WikiDer > Белковая структура
Эта статья нужны дополнительные цитаты для проверка. (Май 2018) (Узнайте, как и когда удалить этот шаблон сообщения) |

Белковая структура это трехмерное расположение атомов в аминокислота-цепь молекула. Белки находятся полимеры - конкретно полипептиды - сформированы из последовательностей аминокислоты, то мономеры полимера. Мономер из одной аминокислоты также можно назвать остаток указывающий на повторяющееся звено полимера. Белки образуются аминокислотами, подвергающимися реакции конденсации, в котором аминокислоты теряют одну молекула воды на реакция чтобы соединиться друг с другом пептидная связь. По соглашению, цепь из 30 аминокислот часто определяется как пептид, а не белок.[1] Чтобы иметь возможность выполнять свою биологическую функцию, белки сворачиваются в одну или несколько конкретных пространственных конформаций, управляемых рядом факторов. нековалентные взаимодействия Такие как водородная связь, ионные взаимодействия, Силы Ван-дер-Ваальса, и гидрофобный упаковка. Чтобы понять функции белков на молекулярном уровне, часто необходимо определить их трехмерную структуру. Это тема научной области структурная биология, в котором используются такие методы, как Рентгеновская кристаллография, ЯМР-спектроскопия, криоэлектронная микроскопия (крио-ЭМ) и двойная поляризационная интерферометрия для определения структуры белков.
Белковые структуры имеют размер от десятков до нескольких тысяч аминокислот.[2] По физическому размеру белки классифицируются как наночастицы, между 1–100 нм. Очень большие агрегаты могут быть образованы из белковые субъединицы. Например, многие тысячи актин молекулы собираются в микрофиламент.
Белок обычно подвергается обратимый структурные изменения при выполнении своей биологической функции. Альтернативные структуры одного и того же белка называются разными. конформационные изомеры, или просто конформации, и переходы между ними называются конформационные изменения.
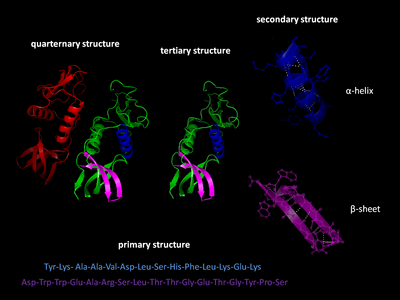
Уровни структуры белка
Есть четыре различных уровня структуры белка.
Первичная структура
В первичная структура белка относится к последовательности аминокислоты в полипептидной цепи. Первичная структура удерживается вместе пептидные связи которые сделаны в процессе биосинтез белка. Два конца полипептидная цепь называются карбоксильный конец (C-конец) и амино-конец (N-конец) в зависимости от характера свободной группы на каждом конце. Подсчет остатков всегда начинается с N-конца (NH2-группа), который представляет собой конец, на котором аминогруппа не участвует в пептидной связи. Первичная структура белка определяется ген соответствующий белку. Определенная последовательность нуклеотиды в ДНК является записано в мРНК, который читается рибосома в процессе, называемом перевод. Последовательность аминокислот в инсулине была обнаружена Фредерик Сэнгер, устанавливая, что белки имеют определяющие аминокислотные последовательности.[3][4] Последовательность белка уникальна для этого белка и определяет структуру и функцию белка. Последовательность белка можно определить такими методами, как Эдман деградация или же тандемная масс-спектрометрия. Однако часто он считывается непосредственно из последовательности гена с помощью генетический код. При обсуждении белков строго рекомендуется использовать слова «аминокислотные остатки», потому что при образовании пептидной связи молекула воды теряется, и поэтому белки состоят из аминокислотных остатков. Посттрансляционная модификация Такие как фосфорилирование и гликозилирование обычно также считаются частью первичной структуры и не могут быть прочитаны из гена. Например, инсулин состоит из 51 аминокислоты в 2 цепях. Одна цепь состоит из 31 аминокислоты, а другая - из 20 аминокислот.
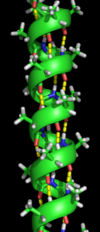
Вторичная структура
Вторичная структура относится к очень регулярным локальным субструктурам на фактической основной цепи полипептида. Два основных типа вторичной структуры: α-спираль и β-цепь или же β-листы, были предложены в 1951 г. Линус Полинг и другие.[5] Эти вторичные структуры определяются паттернами водородные связи между пептидными группами основной цепи. Они имеют правильную геометрию и ограничиваются конкретными значениями двугранных углов ψ и φ на Рамачандран сюжет. Как α-спираль, так и β-лист представляют собой способ насыщения всех доноров и акцепторов водородных связей в основной цепи пептида. Некоторые части белка упорядочены, но не образуют регулярных структур. Их не следует путать с случайный катушки, развернутая полипептидная цепь, лишенная какой-либо фиксированной трехмерной структуры. Несколько последовательных вторичных структур могут образовывать "сверхвторичный блок".[6]
Третичная структура
Третичная структура относится к трехмерной структуре мономерных и мультимерных белковых молекул. Α-спирали и β-гофрированные листы складываются в компактный глобулярная структура. Складывание осуществляется за счет неспецифический гидрофобные взаимодействия, захоронение гидрофобные остатки из воды, но структура устойчива только тогда, когда части белковый домен заблокированы на месте специфический третичные взаимодействия, такие как соляные мосты, водородные связи и плотная упаковка боковых цепей и дисульфидные связи. Дисульфидные связи в цитозольных белках встречаются крайне редко, поскольку цитозоль (внутриклеточная жидкость) обычно сокращение среда.
Четвертичная структура
Четвертичная структура - это трехмерная структура, состоящая из агрегации двух или более отдельных полипептидных цепей (субъединиц), которые действуют как единая функциональная единица (мультимер). Полученный мультимер стабилизируется тем же нековалентные взаимодействия и дисульфидные связи, как в третичной структуре. Есть много возможных организаций четвертичной структуры.[7] Комплексы из двух или более полипептидов (т.е. нескольких субъединиц) называются мультимеры. В частности, это будет называться димер если он содержит две субъединицы, тример если он содержит три субъединицы, тетрамер если он содержит четыре субъединицы, и пентамер если он содержит пять субъединиц. Подразделения часто связаны друг с другом операции симметрии, например, ось 2-го порядка в димере. Мультимеры, состоящие из идентичных субъединиц, обозначаются префиксом «гомо-», а мультимеры, состоящие из разных субъединиц, обозначаются префиксом «гетеро-», например, гетеротетрамер, такой как два альфа и два бета. цепочки гемоглобин.
Домены, мотивы и складки в структуре белка

Белки часто описываются как состоящие из нескольких структурных единиц. Эти единицы включают домены, мотивы и складки. Несмотря на то, что существует около 100000 различных белков, экспрессируемых в эукариотический систем, существует намного меньше различных доменов, структурных мотивов и складок.
Структурная область
А структурная область является самостабилизирующимся элементом общей структуры белка, который часто складки независимо от остальной части белковой цепи. Многие домены не являются уникальными для белковых продуктов одного ген или один генная семья но вместо этого появляются во множестве белков. Домены часто называют и выделяют, потому что они играют важную роль в биологической функции белка, которому они принадлежат; например, "кальций-связывающий домен кальмодулин". Поскольку они независимы друг от друга, домены могут быть заменены генная инженерия между одним белком и другим, чтобы сделать химера белки.
Структурный и последовательный мотив
В структурный и последовательность Мотивы относятся к коротким сегментам трехмерной структуры белка или аминокислотной последовательности, которые были обнаружены в большом количестве различных белков.
Супервторичная структура
В сверхвторичная структура относится к определенной комбинации вторичная структура элементы, такие как β-α-β единицы или спираль-поворот-спираль мотив. Некоторые из них можно также назвать структурными мотивами.
Белковая складка
Белковая складка относится к общей архитектуре белка, как и пучок спиралей, β-ствол, Россманн фолд или различные «складки», предусмотренные в Структурная классификация базы данных белков.[8] Связанная концепция белковая топология это относится к расположению контактов внутри белка.
Супердомен
Супердомен состоит из двух или более номинально не связанных структурных доменов, которые наследуются как единое целое и встречаются в разных белках.[9] Примером может служить протеинтирозинфосфатаза домен и C2 домен пара в PTEN, несколько тензин белки, ауксилин и белки в растениях и грибах. Супердомен PTP-C2, очевидно, возник до расхождения грибов, растений и животных, поэтому, вероятно, ему около 1,5 миллиарда лет.[нужна цитата]
Белковая динамика
Однако белки не являются строго статическими объектами, а скорее населяют ансамбли конформационные состояния.Переходы между этими состояниями обычно происходят наномасштаб, и были связаны с функционально значимыми явлениями, такими как аллостерическая сигнализация[10] и ферментативный катализ.[11] Белковая динамика и конформационные изменения позволяют белкам функционировать как наноразмерные биологические машины внутри клеток, часто в виде мультибелковые комплексы.[12] Примеры включают моторные белки, Такие как миозин, который отвечает за мышца сжатие кинезин, который перемещает груз внутри ячеек подальше от ядро вдоль микротрубочки, и динеин, который перемещает груз внутри клеток к ядру и вызывает биение аксонемы подвижные реснички и жгутики. «[В результате] [подвижная ресничка] представляет собой наномашину, состоящую из, возможно, более 600 белков в молекулярных комплексах, многие из которых также функционируют независимо как наномашины ...Гибкие линкеры позволить мобильные белковые домены связанных ими, чтобы привлечь их связывающих партнеров и вызвать дальнодействующие аллостерия через динамика домена белка. "[13]
Сворачивание белков
Эта секция нуждается в расширении. Вы можете помочь добавляя к этому. (Апрель 2019) |
Как переводится, полипептиды выходят из рибосома как случайный катушки и складывается в его родное государство.[14][15] Поскольку складка определяется сетью взаимодействий между аминокислотами в полипептиде, окончательная структура белковой цепи определяется ее аминокислотной последовательностью (Догма Анфинсена).[16]
Стабильность белка
Стабильность белка зависит от нескольких факторов, таких как 1) нековалентные электростатические взаимодействия 2) гидрофобные взаимодействия Эти энергии взаимодействия составляют порядка 20-40 кДж / моль.[нужна цитата] Белки очень чувствительны к изменению температуры, и изменение температуры может привести к разворачиванию или денатурации. Денатурация белка может привести к потере функции и потере нативного состояния. Или это также может быть примитивное состояние.
Рентгеновская кристаллография и калориметрия показывают, что не существует общего механизма, описывающего влияние изменения температуры на функции и структуру белков. Это связано с тем, что белки не представляют собой единый класс химических веществ с энергетической точки зрения. Структура и стабильность отдельного белка зависит от соотношения его полярных и неполярных остатков. Они вносят вклад в конформационные и чистые энтальпии локальных и нелокальных взаимодействий.
Принимая во внимание слабые межмолекулярные взаимодействия, ответственные за структурную целостность, трудно предсказать влияние температуры, потому что существует слишком много неизвестных факторов, влияющих на гипотетический баланс свободной энергии и его температурную зависимость. Внутренние солевые связи обеспечивают термическую стабильность, и неизвестно, приводит ли низкая температура к дестабилизации этих связей.
В принципе, свободная энергия стабилизации растворимых глобулярных белков не превышает 50-100 кДж / моль.[нужна цитата] Стабилизация основана на эквиваленте небольшого числа водородных связей, ионных пар или гидрофобных взаимодействий, хотя многочисленные внутримолекулярные взаимодействия приводят к стабилизации. Принимая во внимание большое количество водородных связей, которые имеют место для стабилизации вторичных структур и стабилизации внутреннего ядра за счет гидрофобных взаимодействий, свободная энергия стабилизации проявляется как небольшая разница между большими числами. Следовательно, структура нативного белка не оптимизирована для максимальной стабильности.[17]
Определение структуры белка

Около 90% белковых структур, доступных в Банк данных белков были определены Рентгеновская кристаллография.[18] Этот метод позволяет измерять трехмерное (3-D) распределение плотности электроны в белке, в кристаллизованный государство, и тем самым сделать вывод трехмерные координаты всех атомы быть определенным до определенного разрешения. Примерно 9% известных белковых структур было получено ядерный магнитный резонанс (ЯМР) методы.[нужна цитата] Для более крупных белковых комплексов криоэлектронная микроскопия может определять белковые структуры. Разрешение обычно ниже, чем у рентгеновской кристаллографии или ЯМР, но максимальное разрешение постоянно увеличивается. Этот метод по-прежнему особенно ценен для очень больших белковых комплексов, таких как белки оболочки вируса и амилоид волокна.
Общий состав вторичной структуры можно определить с помощью круговой дихроизм. Колебательная спектроскопия также может быть использован для характеристики конформации пептидов, полипептидов и белков.[19] Двумерная инфракрасная спектроскопия стал ценным методом исследования структур гибких пептидов и белков, которые невозможно изучить другими методами.[20][21] Более качественную картину строения белка часто получают протеолиз, что также полезно для скрининга образцов более кристаллизующегося белка. Новые реализации этого подхода, включая быстрый параллельный протеолиз (FASTpp), может исследовать структурированную фракцию и ее стабильность без необходимости очистки.[22] После того, как структура белка была определена экспериментально, дальнейшие подробные исследования могут быть выполнены с помощью вычислений, используя молекулярная динамика моделирование этой структуры.[23]
Анализ белковой последовательности: ансамбли

Белки часто считаются относительно стабильными структурами, имеющими набор третичная структура и испытывают конформационные изменения в результате модификации другими белками или как часть ферментативной активности. Однако белки имеют разную степень стабильности, и некоторые из менее стабильных вариантов внутренне неупорядоченные белки. Эти белки существуют и функционируют в относительно «неупорядоченном» состоянии, в котором отсутствует стабильная третичная структура. В результате их трудно описать в стандартной модели структуры белка, которая была разработана для белков с фиксированным третичная структура. Конформационные ансамбли были разработаны как способ обеспечить более точное и «динамическое» представление конформационного состояния внутренне неупорядоченные белки. Конформационные ансамбли функции, пытаясь представить различные конформации внутренне неупорядоченные белки в файле ансамбля (тип, найденный в База данных ансамбля белков).
Протеин ансамбль файлы представляют собой белок, который можно рассматривать как имеющий гибкую структуру. Создание этих файлов требует определения того, какие из различных теоретически возможных белковых конформаций действительно существуют. Один из подходов заключается в применении вычислительных алгоритмов к данным о белках, чтобы попытаться определить наиболее вероятный набор конформаций для ансамбль файл.
Существует несколько методов подготовки данных для База данных ансамбля белков которые делятся на две общие методологии - подходы пула и молекулярной динамики (МД) (схематически изображены на рисунке). Подход на основе пула использует аминокислотную последовательность белка для создания огромного пула случайных конформаций. Затем этот пул подвергается дополнительной вычислительной обработке, которая создает набор теоретических параметров для каждой конформации на основе структуры. Выбираются конформационные подмножества из этого пула, средние теоретические параметры которых близко соответствуют известным экспериментальным данным для этого белка.[24]
Подход молекулярной динамики принимает несколько случайных конформаций одновременно и подвергает их экспериментальным данным. Здесь экспериментальные данные служат в качестве ограничений, налагаемых на конформации (например, известные расстояния между атомами). Принимаются только конформации, которые остаются в пределах, установленных экспериментальными данными. Этот подход часто применяет большие объемы экспериментальных данных к конформациям, что является очень требовательной в вычислительном отношении задачей.[24]
| Протеин | Тип данных | Протокол | PED ID | Рекомендации |
|---|---|---|---|---|
| Sic1/Cdc4 | ЯМР и SAXS | На базе пула | PED9AAA | [25] |
| p15 PAF | ЯМР и SAXS | На базе пула | PED6AAA | [26] |
| MKK7 | ЯМР | На базе пула | PED5AAB | [27] |
| Бета-синуклеин | ЯМР | На базе MD | PED1AAD | [28] |
| P27 ДИТЯ | ЯМР | На базе MD | PED2AAA | [29] |
(адаптирован из изображение в "Вычислительных подходах к выводу функций внутренне неупорядоченных белков"[24])
Базы данных структуры белков
А база данных структуры белков это база данных, которая смоделированный вокруг различных экспериментально определенный белковые структуры. Целью большинства баз данных о структуре белков является организация и аннотирование структур белков, предоставляя биологическому сообществу доступ к экспериментальным данным в удобной форме. Данные, включенные в базы данных структуры белков, часто включают трехмерные координаты, а также экспериментальную информацию, такую как размеры элементарной ячейки и углы для рентгеновская кристаллография определенные структуры. Хотя в большинстве случаев, в этом случае белки или определения конкретной структуры белка также содержат информацию о последовательности, а некоторые базы данных даже предоставляют средства для выполнения запросов на основе последовательности, первичным атрибутом базы данных структуры является структурная информация, тогда как базы данных последовательностей сосредоточены на информации о последовательности и не содержат структурной информации для большинства записей. Базы данных структуры белков имеют решающее значение для многих усилий в вычислительная биология Такие как дизайн лекарств на основе структуры, как при разработке используемых вычислительных методов, так и при предоставлении большого экспериментального набора данных, который используется некоторыми методами, чтобы получить представление о функции белка.[30]
Классификация конструкций
Белковые структуры можно сгруппировать на основе их структурного сходства, топологический класс или общий эволюционный источник. В Структурная классификация базы данных белков[31] и CATH база данных[32] обеспечивают две различные структурные классификации белков. Когда структурное сходство велико, два белка, возможно, отошли от общего предка.[33], а общая структура белков считается доказательством гомология. Сходство структуры затем можно использовать для группировки белков в белковые суперсемейства.[34]. Если общая структура значительна, но разделяемая фракция мала, общий фрагмент может быть следствием более драматического эволюционного события, такого как горизонтальный перенос генов, и объединение белков, разделяющих эти фрагменты, в суперсемейства белков больше не оправдано.[33] Топология белка также может использоваться для классификации белков. Теория узлов и топология схемы представляют собой две топологические структуры, разработанные для классификации белковых складок на основе пересечения цепей и внутрицепочечных контактов соответственно.
Вычислительное предсказание структуры белка
Поколение белковая последовательность намного проще, чем определение структуры белка. Однако структура белка дает гораздо больше информации о функции белка, чем его последовательность. Поэтому был разработан ряд методов для компьютерного предсказания структуры белка по его последовательности.[35] Ab initio методы прогнозирования используют только последовательность белка. Резьба и моделирование гомологии методы могут построить трехмерную модель для белка неизвестной структуры из экспериментальных структур эволюционно связанных белков, называемых белковая семья.
Смотрите также
- 3did
- Биомолекулярная структура
- Структура гена
- Структура нуклеиновой кислоты
- Z-матрица преобразование торсионных углов в декартовы координаты
- Ленточная диаграмма Трехмерное схематическое изображение белков
Рекомендации
- ^ Х. Стивен Стокер (1 января 2015 г.). Органическая и биологическая химия. Cengage Learning. п. 371. ISBN 978-1-305-68645-8.
- ^ Броккьери Л., Карлин С. (10 июня 2005 г.). «Длина протеина в протеомах эукариот и прокариот». Исследования нуклеиновых кислот. 33 (10): 3390–3400. Дои:10.1093 / нар / gki615. ЧВК 1150220. PMID 15951512.
- ^ Sanger, F .; Таппи, Х. (1 сентября 1951 г.). «Аминокислотная последовательность в фенилаланильной цепи инсулина. I. Идентификация низших пептидов из частичных гидролизатов». Биохимический журнал. 49 (4): 463–481. Дои:10.1042 / bj0490463. ISSN 0264-6021. ЧВК 1197535. PMID 14886310.
- ^ Сэнгер, Ф. (15 мая 1959 г.). «Химия инсулина». Наука. 129 (3359): 1340–1344. Bibcode:1959Научный ... 129.1340G. Дои:10.1126 / наука.129.3359.1340. ISSN 0036-8075. PMID 13658959.
- ^ Полинг Л., Кори Р. Б., Брэнсон Х. Р. (1951). «Структура белков; две спиральные конфигурации полипептидной цепи с водородными связями». Proc Natl Acad Sci USA. 37 (4): 205–211. Bibcode:1951ПНАС ... 37..205П. Дои:10.1073 / pnas.37.4.205. ЧВК 1063337. PMID 14816373.
- ^ Чанг Ю.С., Гельфанд Т.И., Кистер А.Е., Гельфанд И.М. (2007). «Новая классификация супервторичных структур сэндвич-подобных белков раскрывает строгие закономерности сборки цепей». Белки. 68 (4): 915–921. Дои:10.1002 / prot.21473. PMID 17557333.
- ^ Мутевелис Э., Вулфсон Д. Н. (январь 2009 г.). «Периодическая таблица спиральных белковых структур». J. Mol. Биол. 385 (3): 726–32. Дои:10.1016 / j.jmb.2008.11.028. ISSN 0022-2836. PMID 19059267.
- ^ Говиндараджан С., Рекабаррен Р., Гольдштейн Р.А. (17 сентября 1999 г.). «Оценка общего количества складок белка». Белки. 35 (4): 408–414. Дои:10.1002 / (SICI) 1097-0134 (19990601) 35: 4 <408 :: AID-PROT4> 3.0.CO; 2-A. HDL:2027.42/34969. PMID 10382668. Архивировано из оригинал 5 января 2013 г.
- ^ Хейни Д.Т., Сюэ Б. (2015). «Супердомен в иерархии белковой структуры: случай PTP-C2». Белковая наука. 24 (5): 874–82. Дои:10.1002 / pro.2664. ЧВК 4420535. PMID 25694109.
- ^ Bu Z, Callaway DJ (2011). «Белки ДВИГАЮТСЯ! Динамика белков и дальнодействующая аллостерия в передаче сигналов клеток». Структура белка и заболевания. Достижения в химии белков и структурной биологии. 83. С. 163–221. Дои:10.1016 / B978-0-12-381262-9.00005-7. ISBN 9780123812629. PMID 21570668.
- ^ Фрейзер Дж. С., Кларксон М. В., Дегнан С. К., Эрион Р., Керн Д., Альбер Т. (декабрь 2009 г.). «Скрытые альтернативные структуры пролин-изомеразы, необходимые для катализа». Природа. 462 (7273): 669–673. Bibcode:2009Натура.462..669F. Дои:10.1038 / природа08615. ЧВК 2805857. PMID 19956261.
- ^ Дональд, Воет (2011). Биохимия. Воет, Джудит Г. (4-е изд.). Хобокен, Нью-Джерси: Джон Уайли и сыновья. ISBN 9780470570951. OCLC 690489261.
- ^ Сатир, Питер; Сорен Т. Кристенсен (26 марта 2008 г.). «Строение и функции ресничек млекопитающих». Гистохимия и клеточная биология. 129 (6): 687–93. Дои:10.1007 / s00418-008-0416-9. ЧВК 2386530. PMID 18365235. 1432-119Х.
- ^ Чжан, Гонг; Игнатова, Зоя (1 февраля 2011 г.). «Сворачивание при рождении зарождающейся цепи: координирующий перевод с совместным трансляционным сворачиванием». Текущее мнение в структурной биологии. 21 (1): 25–31. Дои:10.1016 / j.sbi.2010.10.008. ISSN 0959-440X. PMID 21111607.
- ^ Альбертс, Брюс; Александр Джонсон; Джулиан Льюис; Мартин Рафф; Кейт Робертс; Питер Уолтерс (2002). «Форма и структура белков». Молекулярная биология клетки; Четвертый выпуск. Нью-Йорк и Лондон: Наука о гирляндах. ISBN 978-0-8153-3218-3.
- ^ Анфинсен, К. (1972). «Формирование и стабилизация структуры белка». Biochem. J. 128 (4): 737–49. Дои:10.1042 / bj1280737. ЧВК 1173893. PMID 4565129.
- ^ Jaenicke, R .; Heber, U .; Franks, F .; Chapman, D .; Гриффин, Мэри С. А .; Hvidt, A .; Коуэн, Д. А. (1990). «Структура и функция белка при низких температурах [и обсуждение]». Философские труды Лондонского королевского общества. Серия B, Биологические науки. 326 (1237): 535–553. Дои:10.1098 / рстб.1990.0030. JSTOR 2398703. PMID 1969647.
- ^ Kendrew, J.C .; Bodo, G .; Dintzis, H.M .; Parrish, R.G .; Wyckoff, H .; Филлипс, округ Колумбия (1958). «Трехмерная модель молекулы миоглобина, полученная с помощью рентгеновского анализа». Природа. 181 (4610): 662–666. Bibcode:1958Натура.181..662K. Дои:10.1038 / 181662a0. PMID 13517261. S2CID 4162786.
- ^ Кримм С., Бандекар Дж. (1986). «Колебательная спектроскопия и конформация пептидов, полипептидов и белков». Достижения в химии белков, том 38. Adv. Protein Chem. Успехи в химии белков. 38. С. 181–364. Дои:10.1016 / S0065-3233 (08) 60528-8. ISBN 9780120342389. PMID 3541539.
- ^ Lessing, J .; Рой, С .; Reppert, M .; Baer, M .; Маркс, Д .; Jansen, T.L.C .; Knoester, J .; Токмаков, А. (2012). «Идентификация остаточной структуры во внутренне неупорядоченных системах: 2D ИК-спектроскопическое исследование пептида GVGXPGVG». Варенье. Chem. Soc. 134 (11): 5032–5035. Дои:10.1021 / ja2114135. PMID 22356513.
- ^ Jansen, T.L.C .; Кнестер, Дж. (2008). «Двумерная инфракрасная спектроскопия переноса населения для улучшения структурных маркеров белков». Биофиз. J. 94 (5): 1818–1825. Bibcode:2008BpJ .... 94.1818J. Дои:10.1529 / biophysj.107.118851. ЧВК 2242754. PMID 17981904.
- ^ Минде Д.П., Морис М.М., Рюдигер С.Г. (2012). «Определение биофизической стабильности белков в лизатах с помощью анализа быстрого протеолиза, FASTpp». PLOS ONE. 7 (10): e46147. Bibcode:2012PLoSO ... 746147M. Дои:10.1371 / journal.pone.0046147. ЧВК 3463568. PMID 23056252.
- ^ Кумари И., Сандху П., Ахмед М., Ахтер Ю. (август 2017 г.). «Моделирование молекулярной динамики, проблемы и возможности: перспективы биолога». Curr. Protein Pept. Наука. 18 (11): 1163–1179. Дои:10.2174/1389203718666170622074741. PMID 28637405.
- ^ а б c d Варади, Михали; Вранкен, Вим; Гухарой, Майнак; Томпа, Питер (1 января 2015 г.). «Вычислительные подходы к выводу функций внутренне неупорядоченных белков». Границы молекулярных биологических наук. 2: 45. Дои:10.3389 / fmolb.2015.00045. ЧВК 4525029. PMID 26301226.
- ^ Миттаг, Таня; Марш, Джозеф; Гришаев Александр; Орлики, Стивен; Линь, Хун; Сичери, Франк; Тайерс, Майк; Форман-Кей, Джули Д. (14 марта 2010 г.). «Значение структуры / функции в динамическом комплексе изначально неупорядоченного Sic1 с субъединицей Cdc4 убиквитинлигазы SCF». Структура. 18 (4): 494–506. Дои:10.1016 / j.str.2010.01.020. ISSN 1878-4186. ЧВК 2924144. PMID 20399186.
- ^ Де Биазио, Альфредо; Ибаньес де Опакуа, Ален; Cordeiro, Tiago N .; Виллате, Майдер; Мерино, Некане; Сибилла, Натали; Лелли, Морено; Диркс, Таммо; Бернадо, По (18 февраля 2014 г.). «p15PAF является внутренне неупорядоченным белком с неслучайными структурными предпочтениями в сайтах взаимодействия с другими белками». Биофизический журнал. 106 (4): 865–874. Bibcode:2014BpJ ... 106..865D. Дои:10.1016 / j.bpj.2013.12.046. ISSN 1542-0086. ЧВК 3944474. PMID 24559989.
- ^ Крагель, Яка; Паленсия, Андрес; Nanao, Max H .; Маурин, Дэмиен; Бувиньи, Гийом; Блэкледж, Мартин; Йенсен, Малене Рингкьёбинг (17 марта 2015 г.). «Структура и динамика сигнального комплекса MKK7-JNK». Труды Национальной академии наук Соединенных Штатов Америки. 112 (11): 3409–3414. Bibcode:2015ПНАС..112.3409К. Дои:10.1073 / pnas.1419528112. ISSN 1091-6490. ЧВК 4371970. PMID 25737554.
- ^ Allison, Jane R .; Риверс, Роберт С.; Christodoulou, John C .; Вендрусколо, Микеле; Добсон, Кристофер М. (25 ноября 2014 г.). «Взаимосвязь между временной структурой в мономерном состоянии и склонностью к агрегации α-синуклеина и β-синуклеина». Биохимия. 53 (46): 7170–7183. Дои:10.1021 / bi5009326. ISSN 1520-4995. ЧВК 4245978. PMID 25389903.
- ^ Сиваколунду, Сивашанкар Г .; Башфорд, Дональд; Кривацки, Ричард В. (11 ноября 2005 г.). «Неупорядоченный p27Kip1 проявляет внутреннюю структуру, напоминающую конформацию, связанную с Cdk2 / циклин A». Журнал молекулярной биологии. 353 (5): 1118–1128. Дои:10.1016 / j.jmb.2005.08.074. ISSN 0022-2836. PMID 16214166.
- ^ Ласковский, Р.А. (2011). «Базы данных структуры белков». Мол Биотехнол. 48 (2): 183–98. Дои:10.1007 / s12033-010-9372-4. PMID 21225378. S2CID 45184564.
- ^ Мурзин, А.Г .; Бреннер, С.; Хаббард, Т.; Чотия, К. (1995). «SCOP: структурная классификация базы данных белков для исследования последовательностей и структур» (PDF). Журнал молекулярной биологии. 247 (4): 536–540. Дои:10.1016 / S0022-2836 (05) 80134-2. PMID 7723011. Архивировано из оригинал (PDF) 26 апреля 2012 г.
- ^ Оренго, К.А.; Michie, A.D .; Jones, S .; Джонс, Д. Т .; Swindells, M. B .; Торнтон, Дж. М. (1997). «CATH - иерархическая классификация доменных структур белков». Структура. 5 (8): 1093–1108. Дои:10.1016 / S0969-2126 (97) 00260-8. PMID 9309224.
- ^ а б Паскуаль-Гарсия, А .; Abia, D .; Ортис, A.R .; Бастолла, У. (2009). «Переход между дискретным и непрерывным пространством белковых структур: понимание автоматической классификации и сетей белковых структур». PLOS вычислительная биология. 5 (3): e1000331. Bibcode:2009PLSCB ... 5E0331P. Дои:10.1371 / journal.pcbi.1000331. ЧВК 2654728. PMID 19325884.
- ^ Holm, L; Розенстрём, П. (июль 2010 г.). «Сервер Дали: сохранение карт в 3D». Исследования нуклеиновых кислот. 38 (Проблема с веб-сервером): W545–9. Дои:10.1093 / nar / gkq366. ЧВК 2896194. PMID 20457744.
- ^ Чжан И (2008). «Прогресс и проблемы в предсказании структуры белка». Curr Opin Struct Biol. 18 (3): 342–348. Дои:10.1016 / j.sbi.2008.02.004. ЧВК 2680823. PMID 18436442.
дальнейшее чтение
- 50 лет графика определения структуры белка - версия HTML - Национальный институт общих медицинских наук в Национальные институты здравоохранения США
внешняя ссылка
 СМИ, связанные с Белковые структуры в Wikimedia Commons
СМИ, связанные с Белковые структуры в Wikimedia Commons