WikiDer > Изобилие химических элементов
В изобилие химических элементов является мерой вхождение из химические элементы относительно всех других элементов в данной среде. Изобилие измеряется одним из трех способов: массовая доля (то же, что и массовая доля); посредством мольная доля (доля атомов в числовом исчислении, а иногда и доля молекул в газах); или объемная доля. Объемная доля - это обычная мера содержания в смешанных газах, таких как атмосферы планет, и аналогична по величине молекулярной мольной доле для газовых смесей при относительно низких плотностях и давлениях, и идеальный газ смеси. Большинство значений численности в этой статье даны в массовых долях.
Например, обилие кислород в чистом виде воды можно измерить двумя способами: массовая доля составляет около 89%, потому что это доля массы воды, которая составляет кислород. Тем не менее мольная доля составляет около 33%, потому что только 1 атом из 3 в воде, H2О, кислород. В качестве другого примера рассмотрим массовая доля обилие водорода и гелия как в Вселенная в целом и в атмосферы из газовые гиганты Такие как Юпитер, это 74% для водород и 23–25% для гелий; в то время как (атомная) мольная доля для водорода 92%, а для гелия 8% в этих средах. Изменение данной среды на Внешняя атмосфера Юпитера, где водород двухатомный в то время как гелий нет, изменяет молекулярный мольная доля (доля от общего количества молекул газа), а также объемная доля атмосферы, водорода около 86% и гелия до 13%.[Примечание 1]
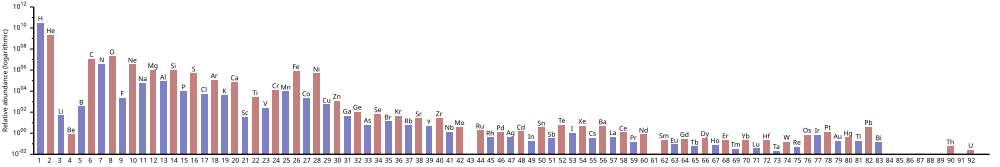
В изобилии химических элементов во Вселенной преобладает большое количество водорода и гелия, которые были произведены в Большой взрыв. Остальные элементы, составляющие лишь около 2% Вселенной, в основном были произведены сверхновые и некоторые красные гигантские звезды. Литий, бериллий и бор редки, потому что, хотя они образуются в результате ядерного синтеза, они затем разрушаются другими реакциями в звездах.[1][2] Элементов от углерода до железа относительно больше во Вселенной из-за простоты их получения в нуклеосинтез сверхновой. Элементы с более высоким атомным номером, чем железо (элемент 26), становятся все более редкими во Вселенной, потому что при их производстве они все больше поглощают звездную энергию. Также элементы с даже атомные числа обычно более распространены, чем их соседи по периодическая таблица, за счет благоприятной энергетики пласта.
Обилие элементов на Солнце и на внешних планетах такое же, как и во Вселенной. Из-за солнечного нагрева элементы Земли и внутренних каменистых планет Солнечной системы подверглись дополнительному истощению летучих водорода, гелия, неона, азота и углерода (который улетучивается в виде метана). Кора, мантия и ядро Земли демонстрируют признаки химической сегрегации плюс некоторая секвестрация по плотности. Более легкие силикаты алюминия находятся в коре, больше силиката магния в мантии, в то время как металлическое железо и никель составляют ядро. Обилие элементов в специализированных средах, таких как атмосфера, океаны или человеческое тело, в первую очередь является продуктом химического взаимодействия со средой, в которой они находятся.
Вселенная
| Z | Элемент | Массовая доля (ppm) |
|---|---|---|
| 1 | Водород | 739,000 |
| 2 | Гелий | 240,000 |
| 8 | Кислород | 10,400 |
| 6 | Углерод | 4,600 |
| 10 | Неон | 1,340 |
| 26 | Утюг | 1,090 |
| 7 | Азот | 960 |
| 14 | Кремний | 650 |
| 12 | Магний | 580 |
| 16 | Сера | 440 |
| Общий | 999,500 |
Стихии - то есть обычные (барионный) материя из протоны, нейтроны, и электроны, составляют лишь небольшую часть содержания Вселенная. Космологические наблюдения предполагают, что только 4,6% энергии Вселенной (включая массу, вносимую энергией, E = mc² ↔ m = E / c²) составляет видимое барионный иметь значение что составляет звезды, планеты, и жизнь существа. Остальное, как полагают, состоит из темная энергия (68%) и темная материя (27%).[4] Считается, что эти формы материи и энергии существуют на основе научная теория и индуктивное мышление основаны на наблюдениях, но они не наблюдались напрямую, и их природа не совсем понятна.
Наиболее стандартная (барионная) материя находится в межгалактическом газе, звездах и межзвездные облака, в виде атомов или ионы (плазма), хотя его можно найти в вырожденных формах в экстремальных астрофизических условиях, таких как высокие плотности внутри белые карлики и нейтронные звезды.
Водород это самый распространенный элемент во Вселенной; гелий второй. Однако после этого ранг обилия больше не соответствует атомный номер; кислород имеет степень распространенности 3, но атомный номер 8. Все остальные встречаются значительно реже.
Обилие самых легких элементов хорошо предсказывается стандартная космологическая модель, поскольку они в основном производились вскоре (то есть в течение нескольких сотен секунд) после Большой взрыв, в процессе, известном как Нуклеосинтез Большого взрыва. Более тяжелые элементы в основном производились гораздо позже, внутри звезды.
По оценкам, водород и гелий составляют примерно 74% и 24% всей барионной материи во Вселенной соответственно. Несмотря на то, что они составляют лишь очень небольшую часть Вселенной, оставшиеся «тяжелые элементы» могут сильно влиять на астрономические явления. Только около 2% (по массе) Млечный путьДиск состоит из тяжелых элементов.
Эти другие элементы создаются звездными процессами.[5][6][7] В астрономия, «металл» - это любой элемент, кроме водорода или гелия. Это различие важно, потому что водород и гелий - единственные элементы, которые были произведены в значительных количествах во время Большого взрыва. Таким образом металличность из галактика или другой объект является признаком звездной активности после Большого взрыва.
Как правило, элементы вплоть до железа образуются в больших звездах в процессе становления. сверхновые. Утюг-56 особенно распространен, поскольку он является наиболее стабильным нуклидом (в том смысле, что он имеет самую высокую ядерную энергию связи на нуклон) и может быть легко получен из альфа-частиц (являющихся продуктом распада радиоактивных никель-56, в конечном итоге состоящий из 14 ядер гелия). Элементы тяжелее железа образуются в процессе поглощения энергии в больших звездах, и их содержание во Вселенной (и на Земле) обычно уменьшается с увеличением атомного номера.
Солнечная система
| Нуклид | А | Массовая доля в частях на миллион | Фракция атома в частях на миллион |
|---|---|---|---|
| Водород-1 | 1 | 705,700 | 909,964 |
| Гелий-4 | 4 | 275,200 | 88,714 |
| Кислород-16 | 16 | 9,592 | 477 |
| Углерод-12 | 12 | 3,032 | 326 |
| Азот-14 | 14 | 1,105 | 102 |
| Неон-20 | 20 | 1,548 | 100 |
| Другие нуклиды: | 3,879 | 149 | |
| Кремний-28 | 28 | 653 | 30 |
| Магний-24 | 24 | 513 | 28 |
| Утюг-56 | 56 | 1,169 | 27 |
| Сера-32 | 32 | 396 | 16 |
| Гелий-3 | 3 | 35 | 15 |
| Водород-2 | 2 | 23 | 15 |
| Неон-22 | 22 | 208 | 12 |
| Магний-26 | 26 | 79 | 4 |
| Углерод-13 | 13 | 37 | 4 |
| Магний-25 | 25 | 69 | 4 |
| Алюминий-27 | 27 | 58 | 3 |
| Аргон-36 | 36 | 77 | 3 |
| Кальций-40 | 40 | 60 | 2 |
| Натрий-23 | 23 | 33 | 2 |
| Утюг-54 | 54 | 72 | 2 |
| Кремний-29 | 29 | 34 | 2 |
| Никель-58 | 58 | 49 | 1 |
| Кремний-30 | 30 | 23 | 1 |
| Утюг-57 | 57 | 28 | 1 |
Следующий график (шкала журнала заметок) показывает количество элементов в Солнечная система. В таблице показаны двенадцать наиболее распространенных элементов в нашей галактике (оцененные спектроскопически), измеренные в частях на миллион по массе.[3]Соседние галактики, которые развивались по аналогичным направлениям, имеют соответствующее обогащение элементами тяжелее водорода и гелия. Более далекие галактики рассматриваются такими, какими они были в прошлом, поэтому их содержание элементов кажется более близким к изначальной смеси. Однако, поскольку физические законы и процессы единообразны во всей Вселенной, ожидается, что и в этих галактиках будет одинаковое количество элементов.
Обилие элементов соответствует их происхождению от Большой взрыв и нуклеосинтез в ряду прародителей сверхновая звезда звезды. В большом количестве водород и гелий являются продуктами Большого взрыва, тогда как следующие три элемента встречаются редко, так как у них было мало времени для образования во время Большого взрыва, и они не образуются в звездах (однако они производятся в небольших количествах при распаде более тяжелых элементов). элементов в межзвездной пыли, в результате удара космические лучи).
Начиная с углерода, элементы образовывались в звездах путем накопления из альфа-частицы (ядра гелия), что приводит к попеременно большему количеству элементов с четными атомными номерами (они также более стабильны). Влияние нечетных химических элементов, которые обычно встречаются во Вселенной более редко, было эмпирически замечено в 1914 году и известно как Правило Оддо-Харкинса.
Отношение к ядерной энергии связи
Наблюдались слабые корреляции между оценкой содержания элементов во Вселенной и кривая энергии связи ядер. Грубо говоря, относительная стабильность различных атомных нуклидов оказала сильное влияние на относительное содержание элементов, образующихся в Большой взрыв, а затем во время развития Вселенной.[9]См. Статью о нуклеосинтез для объяснения того, насколько точно термоядерная реакция процессы в звездах (например, сжигание углеродаи др.) создают элементы тяжелее водорода и гелия.
Еще одна наблюдаемая особенность - это неровное чередование относительного содержания и дефицита соседних атомных номеров на кривой содержания элементов, а также аналогичная картина уровней энергии на кривой энергии связи ядер. Это чередование вызвано высшим относительным энергия связи (соответствует относительной стабильности) четных атомных номеров по сравнению с нечетными атомными номерами и объясняется Принцип исключения Паули.[10]В полуэмпирическая формула массы (SEMF), также называемый Формула Вайцзеккера или Формула массы Бете-Вайцзеккера, дает теоретическое объяснение общей формы кривой энергии связи ядра.[11]
земной шар
В земной шар образовались из того же облака вещества, которое сформировало Солнце, но планеты приобрели разный состав во время формирование и эволюция солнечной системы. В свою очередь, естественная история Земли заставили части этой планеты иметь разную концентрацию элементов.
Масса Земли примерно 5,98×1024 кг. В массе, по массе, он состоит в основном из утюг (32.1%), кислород (30.1%), кремний (15.1%), магний (13.9%), сера (2.9%), никель (1.8%), кальций (1,5%), и алюминий (1,4%); оставшиеся 1,2% составляют следовые количества других элементов.[12]
Основной состав Земли по элементарной массе примерно аналогичен валовому составу Солнечной системы, с основными отличиями в том, что на Земле отсутствует большое количество летучих элементов - водорода, гелия, неона и азота, а также углерод, который был утерян в виде летучих углеводородов. Остающийся элементный состав примерно типичен для «каменистых» внутренних планет, которые образовались в тепловой зоне, где солнечное тепло вытесняет летучие соединения в космос. Земля сохраняет кислород как второй по величине компонент своей массы (и наибольшую атомную долю), в основном из этого элемента, удерживаемого в силикатные минералы которые имеют очень высокую температуру плавления и низкое давление пара.
| Атомный номер | Имя | Символ | Массовая доля (ppm) | Атомная доля (ppb)[13] |
|---|---|---|---|---|
| 8 | кислород | О | 297000 | 482,000,000 |
| 12 | магний | Mg | 154000 | 164,000,000 |
| 14 | кремний | Si | 161000 | 150,000,000 |
| 26 | утюг | Fe | 319000 | 148,000,000 |
| 13 | алюминий | Al | 15900 | 15,300,000 |
| 20 | кальций | Ca | 17100 | 11,100,000 |
| 28 | никель | Ni | 18220 | 8,010,000 |
| 1 | водород | ЧАС | 260 | 6,700,000 |
| 16 | сера | S | 6350 | 5,150,000 |
| 24 | хром | Cr | 4700 | 2,300,000 |
| 11 | натрий | Na | 1800 | 2,000,000 |
| 6 | углерод | C | 730 | 1,600,000 |
| 15 | фосфор | п | 1210 | 1,020,000 |
| 25 | марганец | Mn | 1700 | 800,000 |
| 22 | титан | Ti | 810 | 440,000 |
| 27 | кобальт | Co | 880 | 390,000 |
| 19 | калий | K | 160 | 110,000 |
| 17 | хлор | Cl | 76 | 56,000 |
| 23 | ванадий | V | 105 | 53,600 |
| 7 | азот | N | 25 | 46,000 |
| 29 | медь | Cu | 60 | 25,000 |
| 30 | цинк | Zn | 40 | 16,000 |
| 9 | фтор | F | 10 | 14,000 |
| 21 | скандий | Sc | 11 | 6,300 |
| 3 | литий | Ли | 1.10 | 4,100 |
| 38 | стронций | Sr | 13 | 3,900 |
| 32 | германий | Ge | 7.00 | 2,500 |
| 40 | цирконий | Zr | 7.10 | 2,000 |
| 31 | галлий | Ga | 3.00 | 1,000 |
| 34 | селен | Se | 2.70 | 890 |
| 56 | барий | Ба | 4.50 | 850 |
| 39 | иттрий | Y | 2.90 | 850 |
| 33 | мышьяк | В качестве | 1.70 | 590 |
| 5 | бор | B | 0.20 | 480 |
| 42 | молибден | Пн | 1.70 | 460 |
| 44 | рутений | RU | 1.30 | 330 |
| 78 | платина | Pt | 1.90 | 250 |
| 46 | палладий | Pd | 1.00 | 240 |
| 58 | церий | Ce | 1.13 | 210 |
| 60 | неодим | Nd | 0.84 | 150 |
| 4 | бериллий | Быть | 0.05 | 140 |
| 41 | ниобий | Nb | 0.44 | 120 |
| 76 | осмий | Операционные системы | 0.90 | 120 |
| 77 | иридий | Ir | 0.90 | 120 |
| 37 | рубидий | Руб. | 0.40 | 120 |
| 35 | бром | Br | 0.30 | 97 |
| 57 | лантан | Ла | 0.44 | 82 |
| 66 | диспрозий | Dy | 0.46 | 74 |
| 64 | гадолиний | Б-г | 0.37 | 61 |
| 52 | теллур | Te | 0.30 | 61 |
| 45 | родий | Rh | 0.24 | 61 |
| 50 | банка | Sn | 0.25 | 55 |
| 62 | самарий | См | 0.27 | 47 |
| 68 | эрбий | Э | 0.30 | 47 |
| 70 | иттербий | Yb | 0.30 | 45 |
| 59 | празеодим | Pr | 0.17 | 31 |
| 82 | вести | Pb | 0.23 | 29 |
| 72 | гафний | Hf | 0.19 | 28 |
| 74 | вольфрам | W | 0.17 | 24 |
| 79 | золото | Au | 0.16 | 21 |
| 48 | кадмий | CD | 0.08 | 18 |
| 63 | европий | Европа | 0.10 | 17 |
| 67 | гольмий | Хо | 0.10 | 16 |
| 47 | серебро | Ag | 0.05 | 12 |
| 65 | тербий | Tb | 0.07 | 11 |
| 51 | сурьма | Sb | 0.05 | 11 |
| 75 | рений | Re | 0.08 | 10 |
| 53 | йод | я | 0.05 | 10 |
| 69 | тулий | Тм | 0.05 | 7 |
| 55 | цезий | CS | 0.04 | 7 |
| 71 | лютеций | Лу | 0.05 | 7 |
| 90 | торий | Чт | 0.06 | 6 |
| 73 | тантал | Та | 0.03 | 4 |
| 80 | Меркурий | Hg | 0.02 | 3 |
| 92 | уран | U | 0.02 | 2 |
| 49 | индий | В | 0.01 | 2 |
| 81 | таллий | Tl | 0.01 | 2 |
| 83 | висмут | Би | 0.01 | 1 |
Корка

Массовая доля девяти наиболее распространенных элементов в земной коре составляет приблизительно: кислород 46%, кремний 28%, алюминий 8,3%, железо 5,6%, кальций 4,2%, натрий 2,5%, магний 2,4%, калий 2,0% и титан 0,61%. Остальные элементы составляют менее 0,15%. Полный список см. обилие элементов в земной коре.
График справа иллюстрирует относительную атомную распространенность химических элементов в верхней части континентальной коры Земли - части, которая относительно доступна для измерений и оценок.
Многие элементы, показанные на графике, подразделяются на (частично перекрывающиеся) категории:
- породообразующие элементы (основные элементы в зеленом поле и второстепенные элементы в светло-зеленом поле);
- редкоземельные элементы (лантаноиды, La-Lu, Sc и Y; отмечены синим);
- основные промышленные металлы (мировое производство> ~ 3 × 107 кг / год; помечены красным);
- драгоценные металлы (помечены фиолетовым цветом);
- девять самых редких «металлов» - шесть платиновая группа элементы плюс Au, Re, и Te (металлоид) - в желтом поле. Они редко встречаются в коре, поскольку растворяются в железе и поэтому концентрируются в ядре Земли. Теллур является единственным наиболее обедненным элементом в силикатной Земле по сравнению с космическим распространением, потому что помимо того, что он был сконцентрирован в виде плотных халькогенидов в ядре, он был сильно истощен из-за преаккреционной сортировки в туманности как летучих. теллурид водорода.[14]
Обратите внимание, что есть два разрыва, где нестабильные (радиоактивные) элементы технеций (атомный номер 43) и прометий (атомный номер 61) будет. Эти элементы окружены стабильными элементами, но оба имеют относительно короткий период полураспада (~ 4 миллиона лет и ~ 18 лет соответственно). Таким образом, они чрезвычайно редки, так как любые их изначальные первоначальные фракции в материалах до Солнечной системы давно распались. Эти два элемента теперь производятся естественным путем только через спонтанное деление очень тяжелых радиоактивный элементы (например, уран, торий, или следовые количества плутоний которые существуют в урановых рудах), или взаимодействием некоторых других элементов с космические лучи. И технеций, и прометий были идентифицированы спектроскопически в атмосферах звезд, где они производятся в ходе продолжающихся процессов нуклеосинтеза.
На графике численности также есть разрывы, где шесть благородные газы было бы так, поскольку они не связаны химически в земной коре, и они генерируются в коре только цепочками распада из радиоактивных элементов, и поэтому чрезвычайно редки там.
Восемь природных очень редких высокорадиоактивных элементов (полоний, астатин, франций, радий, актиний, протактиний, нептуний, и плутоний) не включены, поскольку любой из этих элементов, которые присутствовали при формировании Земли, распался эоны назад, и их количество сегодня незначительно и производится только из радиоактивный распад урана и тория.
Кислород и кремний являются наиболее распространенными элементами в коре. На Земле и вообще на каменистых планетах кремний и кислород встречаются гораздо чаще, чем их космическое количество. Причина в том, что они соединяются друг с другом, образуя силикатные минералы.[14] Другие космически общие элементы, такие как водород, углерод и азот образуют летучие соединения, такие как аммиак и метан которые легко выкипают в космос от тепла планетарного образования и / или света Солнца.
Редкоземельные элементы
"Редкие" земные элементы - историческое неправильное название. Постоянство этого термина отражает скорее незнакомость, чем истинную редкость. Более обильный редкоземельные элементы сконцентрированы в коре примерно так же, как и обычные промышленные металлы, такие как хром, никель, медь, цинк, молибден, олово, вольфрам или свинец. Два наименее распространенных редкоземельных элемента (тулий и лютеций) почти в 200 раз более распространены, чем золото. Однако, в отличие от обычных цветных и драгоценных металлов, редкоземельные элементы имеют очень небольшую тенденцию к концентрации в пригодных для использования рудных месторождениях. Следовательно, большая часть мировых запасов редкоземельных элементов поступает из небольшого числа источников. Кроме того, все редкоземельные металлы довольно химически похожи друг на друга, и поэтому их довольно сложно разделить на количества чистых элементов.
Различия в содержании отдельных редкоземельных элементов в верхней континентальной коре Земли представляют собой суперпозицию двух эффектов, одного ядерного и одного геохимического. Во-первых, редкоземельные элементы с четными атомными номерами (58Ce, 60Nd, ...) имеют большее космическое и земное содержание, чем соседние редкоземельные элементы с нечетными атомными номерами (57Ла, 59Пр, ...). Во-вторых, более легкие редкоземельные элементы более несовместимы (потому что они имеют больший ионный радиус) и поэтому более сильно сконцентрированы в континентальной коре, чем более тяжелые редкоземельные элементы. В большинстве месторождений редкоземельных руд первые четыре редкоземельных элемента - лантан, церий, празеодим, и неодим - составляют от 80% до 99% от общего количества редкоземельного металла, содержащегося в руде.
Мантия
Массовая доля восьми самых распространенных элементов в мантии Земли (см. Основную статью выше) составляет приблизительно: кислород 45%, магний 23%, кремний 22%, железо 5,8%, кальций 2,3%, алюминий 2,2%, натрий 0,3%. , калий 0,3%.[нужна цитата]
Основной
Из-за массовая сегрегацияядро Земли, как полагают, в основном состоит из железа (88,8%) с меньшими количествами никеля (5,8%), серы (4,5%) и менее 1% микроэлементов.[12]
Океан
Наиболее распространенными элементами в океане по массе в процентах являются кислород (85,84%), водород (10,82%), хлор (1,94%), натрий (1,08%), магний (0,13%), сера (0,09%), кальций (0,04%), калий (0,04%), бром (0,007%), углерод (0,003%) и бор (0,0004%).
Атмосфера
Порядок элементов по объемной доле (что приблизительно соответствует молекулярной мольной доле) в атмосфера является азот (78.1%), кислород (20.9%),[15] аргон (0,96%), за которыми следуют (в неопределенном порядке) углерод и водород, потому что водяной пар и углекислый газ, которые представляют большинство этих двух элементов в воздухе, являются переменными компонентами. Сера, фосфор и все другие элементы присутствуют в значительно меньших количествах.
Согласно графику кривой содержания (вверху справа), аргон, значительный, если не главный компонент атмосферы, вообще не появляется в коре. Это связано с тем, что атмосфера имеет гораздо меньшую массу, чем кора, поэтому аргон, остающийся в коре, мало влияет на ее массовую долю, в то же время накопление аргона в атмосфере стало достаточно большим, чтобы быть значительным.
Городские почвы
Полный список содержания элементов в городских почвах см. Изобилие элементов (страница данных) # Городские почвы.
Тело человека
| Элемент | Пропорция (по массе) |
|---|---|
| Кислород | 65 |
| Углерод | 18 |
| Водород | 10 |
| Азот | 3 |
| Кальций | 1.5 |
| Фосфор | 1.2 |
| Калий | 0.2 |
| Сера | 0.2 |
| Хлор | 0.2 |
| Натрий | 0.1 |
| Магний | 0.05 |
| Утюг | < 0.05 |
| Кобальт | < 0.05 |
| Медь | < 0.05 |
| Цинк | < 0.05 |
| Йод | < 0.05 |
| Селен | < 0.01 |
По массе клетки человека состоят на 65–90% из воды (H2O), а значительная часть остатка состоит из углеродсодержащих органических молекул. Следовательно, кислород составляет большую часть массы человеческого тела, за ним следует углерод. Почти 99% массы человеческого тела состоит из шести элементов: водород (ЧАС), углерод (С), азот (N), кислород (O), кальций (Ca) и фосфор (П) (ЧНОПС для краткости). Следующие 0,75% состоят из следующих пяти элементов: калий (К), сера (S), хлор (Cl), натрий (Na) и магний (Mg). Известно, что только 17 элементов необходимы для жизни человека, а еще один элемент (фтор) считается полезным для прочности зубной эмали. Еще несколько микроэлементы может играть определенную роль в здоровье млекопитающих. Бор и кремний особенно необходимы для растений, но играют неопределенную роль у животных. Элементы алюминия и кремния, хотя и очень распространены в земной коре, заметно редки в организме человека.[16]
Ниже представлена таблица Менделеева с указанием питательных элементов.[17]
| ЧАС | Он | |||||||||||||||||
| Ли | Быть | B | C | N | О | F | Ne | |||||||||||
| Na | Mg | Al | Si | п | S | Cl | Ar | |||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | В качестве | Se | Br | Kr | |
| Руб. | Sr | Y | Zr | Nb | Пн | Tc | RU | Rh | Pd | Ag | CD | В | Sn | Sb | Te | я | Xe | |
| CS | Ба | Ла | * | Hf | Та | W | Re | Операционные системы | Ir | Pt | Au | Hg | Tl | Pb | Би | По | В | Rn |
| Пт | Ра | Ac | ** | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ц | Og |
| * | Ce | Pr | Nd | Вечера | См | Европа | Б-г | Tb | Dy | Хо | Э | Тм | Yb | Лу | ||||
| ** | Чт | Па | U | Np | Пу | Являюсь | См | Bk | Cf | Es | FM | Мкр | Нет | Lr | ||||
| Легенда: | ||
|---|---|---|
| ||
| ||
| ||
| ||
| ||
| ||
|
Смотрите также
- Изобилие элементов (страница данных)
- Изобилие элементов в земной коре
- Природное изобилие (изотопное содержание)
- Классификация Гольдшмидта
- Первородный нуклид
- Список справочных данных по химическим элементам
Рекомендации
Сноски
- ^ Вангиони-Флам, Элизабет; Кассе, Мишель (2012). Несмотря на то, Моник (ред.). Эволюция галактик: связь далекой Вселенной с местной летописью окаменелостей. Springer Science & Business Media. С. 77–86. ISBN 978-9401142137.
- ^ Тримбл, Вирджиния (1996). «Происхождение и эволюция химических элементов». В Малкане, Matthew A .; Цукерман, Бен (ред.). Происхождение и эволюция Вселенной. Садбери, штат Массачусетс: Джонс и Бартлетт Издательство. п. 101. ISBN 0-7637-0030-4.
- ^ а б Кросуэлл, Кен (февраль 1996 г.). Алхимия Небес. Якорь. ISBN 0-385-47214-5. В архиве из оригинала от 13.05.2011.
- ^ Что такое темная энергия? В архиве 2016-01-15 в Wayback Machine, Space.com, 1 мая 2013 г.
- ^ Зьюсс, Ганс; Юри, Гарольд (1956). «Изобилие стихий». Обзоры современной физики. 28 (1): 53. Bibcode:1956РвМП ... 28 ... 53С. Дои:10.1103 / RevModPhys.28.53.
- ^ Кэмерон, A.G.W. (1973). «Изобилие элементов в солнечной системе». Обзоры космической науки. 15 (1): 121. Bibcode:1973ССРв ... 15..121С. Дои:10.1007 / BF00172440. S2CID 120201972.
- ^ Андерс, Э; Эбихара, М. (1982). «Изобилие элементов в солнечной системе». Geochimica et Cosmochimica Acta. 46 (11): 2363. Bibcode:1982GeCoA..46.2363A. Дои:10.1016/0016-7037(82)90208-3.
- ^ Арнетт, Дэвид (1996). Сверхновые и нуклеосинтез (Первое изд.). Принстон, Нью-Джерси: Princeton University Press. п. 11. ISBN 0-691-01147-8. OCLC 33162440.
- ^ Белл, Джерри А .; Команда редакторов и авторов GenChem (2005). «Глава 3: Происхождение атомов». Химия: проект Американского химического общества. Нью-Йорк [u.a.]: Фриман. С. 191–193. ISBN 978-0-7167-3126-9.
Корреляция между изобилием и энергией связи ядра [Название раздела]
- ^ Белл, Джерри А .; Команда редакторов и авторов GenChem (2005). «Глава 3: Происхождение атомов». Химия: проект Американского химического общества. Нью-Йорк [u.a.]: Фриман. п. 192. ISBN 978-0-7167-3126-9.
Более высокое содержание элементов с четными атомными номерами [Название подраздела]
- ^ Бейли, Дэвид. «Полуэмпирическая формула ядерной массы». PHY357: струны и связывающая энергия. Университет Торонто. В архиве из оригинала 2011-07-24. Получено 2011-03-31.
- ^ а б Morgan, J. W .; Андерс, Э. (1980). «Химический состав Земли, Венеры и Меркурия». Труды Национальной академии наук. 77 (12): 6973–6977. Bibcode:1980ПНАС ... 77.6973М. Дои:10.1073 / pnas.77.12.6973. ЧВК 350422. PMID 16592930.
- ^ а б Уильям Ф. Макдонаф Состав Земли. quake.mit.edu, заархивированный системой Internet Archive Wayback Machine.
- ^ а б c Андерсон, Дон Л .; «Химический состав мантии» в Теория Земли, стр. 147–175 ISBN 0865421234
- ^ Циммер, Карл (3 октября 2013 г.). "Кислород Земли: загадка, которую легко принять на веру". Нью-Йорк Таймс. В архиве из оригинала 3 октября 2013 г.. Получено 3 октября 2013.
- ^ Табличные данные из Чанг, Раймонд (2007). Химия (Девятое изд.). Макгроу-Хилл. п. 52. ISBN 978-0-07-110595-8.
- ^ Нильсен, Форрест Х. (1998). «Ультра-следовые минералы». В Морисе Э. Шилсе; Джеймс А. Олсен; Моше Шайн; А. Кэтрин Росс (ред.). Современное питание при здоровье и болезнях. Балтимор: Липпинкотт Уильямс и Уилкинс. С. 283–303. HDL:10113/46493. ISBN 978-0683307696.
- ^
- Ультра-следовые минералы. Авторы: Нильсен, Форрест Х. USDA, ARS Источник: Современное питание в здоровье и болезнях / редакторы, Морис Э. Шилс ... и др. Балтимор: Williams & Wilkins, c1999, стр. 283-303. Дата выпуска: 1999 URI: [1]
- ^ Дауманн, Лена Дж. (25 апреля 2019 г.). «Важное и повсеместное явление: появление металлобиохимии лантанидов». Angewandte Chemie International Edition. Дои:10.1002 / anie.201904090. Получено 15 июн 2019.
Примечания
- ^ Ниже внешней атмосферы Юпитера объемные доли значительно отличаются от мольных долей из-за высоких температур (ионизация и диспропорционирование) и высокой плотности, где Закон идеального газа неприменимо.
Обозначения
- «Редкоземельные элементы - важнейшие ресурсы для высоких технологий | Информационный бюллетень USGS 087-02». geopubs.wr.usgs.gov.
- «Представьте себе Вселенную! Словарь». 3 декабря 2003 г. Архивировано с оригинал 3 декабря 2003 г.
внешняя ссылка
- Список элементов в порядке их содержания в земной коре (исправлено только для двадцати наиболее распространенных элементов)
- Космическое изобилие элементов и нуклеосинтез
- WebElements.com Списки содержания элементов во Вселенной, Солнце, метеоритах, Земле, океане, речной воде и т. Д.