WikiDer > Флуноксапрофен
 | |
 | |
| Клинические данные | |
|---|---|
| Код УВД | |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| Панель управления CompTox (EPA) | |
| Химические и физические данные | |
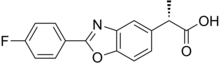
| Формула | C16ЧАС12FNО3 |
| Молярная масса | 285.274 г · моль−1 |
| 3D модель (JSmol) | |
| |
| |
| | |
Флуноксапрофен, также известный как Priaxim, является хиральный нестероидный противовоспалительный препарат (НПВП). Это тесно связано с напроксен, который также является НПВП. Было показано, что флуноксапрофен значительно улучшает симптомы остеоартроз и ревматоидный артрит. Клиническое использование флуноксапрофена прекращено из-за опасений по поводу возможного гепатотоксичность.
Структура
Флуноксапрофен представляет собой двукольцевую гетероциклический соединение, полученное из бензоксазол. Он также содержит фтор атом и пропаноил группа.
Синтез и подготовка
Можно увидеть синтез флуноксапрофена здесь[нужна цитата]
Поскольку флуноксапрофен имеет ограниченную растворимость в воде, необходимо предпринять дополнительные меры для приготовления сиропов, кремов, суппозиториев и т. Д. Чтобы флуноксапрофен растворился в воде, но оставался активным и эффективным, его необходимо смешивать с лизин а затем суспендировали в органическом растворителе, растворимом в воде. При охлаждении соль кристаллизуется. Затем соль нужно отфильтровать и высушить. Фармакологические испытания этого теперь водорастворимого соединения показали, что оно обладает противовоспалительными свойствами, равными самому флуноксапрофену.[1]
Фармакокинетика
Эффективность и безопасность флуноксапрофена сравнивали с таковыми из Напроксен в ревматоидный артрит пациентам, чтобы показать, что оба препарата обладают эквивалентным терапевтическим действием. Оба препарата значительно снимают спонтанную боль, возникающую как днем, так и ночью. Оба препарата также значительно снимают боль, связанную с активными и пассивными движениями, и помогают уменьшить утреннюю скованность. Исследование также показало, что оба препарата одинаково эффективны для улучшения сила захвата.[2]
Флуноксапрофен имеет два энантиомера. Абсорбция и отложение обоих энантиомеров были изучены в 1988 году. Не было замечено значительных различий между периодами полувыведения и абсорбцией этих двух энантиомеров.[3] Однако дальнейшие исследования показали, что S-энантиомер является активной формой препарата. Флуноксапрофен фармакологически активируется путем биотрансформации R-энантиомера в S-энантиомер.[4] Эта высокостереоселективная хиральная инверсия опосредуется тиоэфиром FLX-S-Acyl-CoA.[5]
Фармакокинетические исследования проводились путем определения уровня энантиомеров пропранолола в плазме после перорального введения рацемического препарата.[6] Было показано, что правовращающая форма особенно активна и имеет гораздо более высокую терапевтический индекс чем некоторые другие противовоспалительные средства, в том числе индометацин и диклофенак.[1]
Также было показано, что флуноксапрофен ингибирует лейкотриен скорее, чем простагландин синтез. Это похоже на беноксапрофен. Флуноксапрофен и беноксапрофен было показано, что они имеют аналогичные характеристики поглощения. Однако было показано, что распределение и выведение флуноксапрофена происходит намного быстрее, чем у беноксапрофен.[7]
Побочные эффекты
Структурным аналогом флуноксапрофена является беноксапрофен. Эти два препарата являются аналогами карбоновых кислот, которые образуют реактивные ацилглюкурониды. Беноксапрофен проявляет редкую гепатотоксичность. Из-за этого беноксапрофен был снят с продажи. В ответ на это было прекращено клиническое использование флуноксапрофена, хотя исследования показали, что флуноксапрофен менее токсичен, чем беноксапрофен.
Токсичность этих нестероидные противовоспалительные препараты может быть связано с ковалентной модификацией белков в ответ на реактивные ацилглюкурониды лекарств. Реактивность ацилглюкуронидов может влиять на связывание с белками.[8]
Рекомендации
- ^ а б «Способ получения водорастворимых лизиновых солей (+) 2- (4-фторфенил) альфа-метил-5-бензоксазолуксусной кислоты» Патент США 5,120,851
- ^ Фиораванти А., Джордано Н., Мегале Ф, Джоване Д., Франси А., Марколонго Р. (1989). «[Эффективность и переносимость флуноксапрофена при лечении ревматоидного артрита. Перекрестное клиническое исследование с использованием напроксена]». La Clinica Terapeutica (на итальянском). 131 (2): 83–91. PMID 2533024.
- ^ Палатини П., Монтанари Дж., Пероса А., Форджоне А, Педраццини С., Фурланут М. (1988). «Стереоспецифическое расположение энантиомеров флуноксапрофена у человека». Международный журнал исследований клинической фармакологии. 8 (3): 161–7. PMID 3403103.
- ^ Pedrazzini S, De Angelis M, Muciaccia WZ, Sacchi C, Forgione A (1988). «Стереохимическая фармакокинетика 2-арилпропионовой кислоты нестероидного противовоспалительного препарата флуноксапрофена у крыс и человека». Arzneimittel-Forschung. 38 (8): 1170–5. PMID 3196413.
- ^ Грилло МП, Уэйт Дж. К., Тадано Лор М., Кхера С., Бенет Л.З. (2010). «Стереоселективное образование тиоэфира флуноксапрофен-S-ацил-глутатиона, опосредованное образованием ацил-КоА в гепатоцитах крысы». Метаболизм и утилизация лекарств. 38 (1): 133–42. Дои:10.1124 / dmd.109.029371. ЧВК 2802421. PMID 19786506.
- ^ Мартин Э., Квинке К., Спан Х., Мучлер Э. (1989). «(-) - (S) -флуноксапрофен и (-) - (S) -напроксена изоцианат: два новых флуоресцентных хиральных дериватизирующих агента для энантиоспецифического определения первичных и вторичных аминов». Хиральность. 1 (3): 223–34. Дои:10.1002 / чир.530010308. PMID 2642051.
- ^ Furlanut M, Montanari G, Perosa A, Velussi C, Forgione A, Palatini P (1985). «Кинетика абсорбции и распределения флуноксапрофена и беноксапрофена у здоровых добровольцев». Международный журнал исследований клинической фармакологии. 5 (3): 165–70. PMID 4018949.
- ^ Донг Дж.К., Лю Дж., Смит П.К. (2005). «Роль ацилглюкуронидов беноксапрофена и флуноксапрофена в ковалентном связывании с белками плазмы и печени крыс in vivo». Биохимическая фармакология. 70 (6): 937–48. Дои:10.1016 / j.bcp.2005.05.026. PMID 16046212.