WikiDer > PTPN1 - Википедия
Тирозин-протеинфосфатаза нерецепторного типа 1 также известный как протеин-тирозинфосфатаза 1B (PTP1B) - это фермент это член-основатель протеинтирозинфосфатаза (PTP) семья. У людей это кодируется ПТПН1 ген.[5] PTP1B является негативным регулятором пути передачи сигналов инсулина и считается многообещающей потенциальной терапевтической мишенью, в частности, для лечения диабет 2 типа.[6] Он также был вовлечен в развитие рака груди и исследовался как потенциальная терапевтическая мишень в этом направлении.[7][8][9]
Структура и функции
PTP1B был впервые выделен из экстракта белка плаценты человека,[10][11] но он выражен во многих тканях.[12] PTP1B локализован на цитоплазматической стороне эндоплазматический ретикулум.[13] PTP1B может дефосфорилировать остатки фосфотирозина активированных рецептор инсулина киназа.[11][14][15] У мышей генетическое устранение PTPN1 приводит к повышенной чувствительности к инсулину.[16][17] Несколько других тирозинкиназ, включая рецептор эпидермального фактора роста,[18] рецептор инсулиноподобного фактора роста 1,[19] рецептор колониестимулирующего фактора 1,[20] c-Src,[21] Янус киназа 2,[22] TYK2,[22] и киназа фокальной адгезии[23] а также другие тирозин-фосфорилированные белки, включая BCAR1,[24] DOK1,[25] бета-катенин[26] и кортактин[27] также были описаны как субстраты PTP1B.
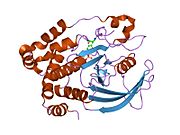
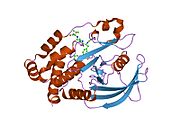
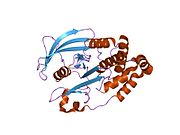
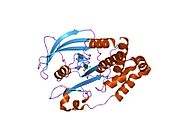
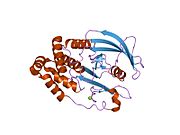
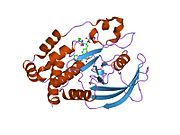
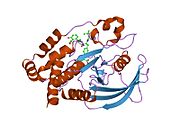
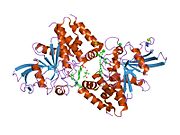
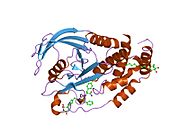
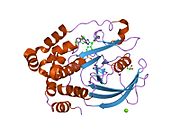
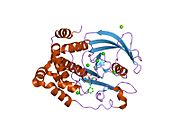
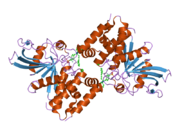
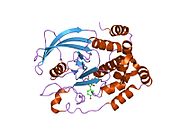
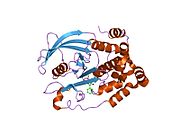
Первая кристаллическая структура каталитического домена PTP1B показала, что каталитический сайт существует в глубокой щели белка, образованной тремя петлями, включая петлю WPD с остатком Asp181, петлю pTyr с остатком Tyr46 и петлю Q с остатком Gln262. .[28][29] Петля pTyr и остаток Tyr46 расположены на поверхности белка и, таким образом, помогают определить глубину, которую субстрат может получить в щели. Это действует как средство повышения селективности, поскольку субстраты, содержащие более мелкие фосфоресиды, не могут достичь места каталитической активности в основании щели.[28] После связывания с субстратом PTP1B претерпевает структурную модификацию, при которой петля WPD замыкается вокруг субстрата, вводя стабилизирующие пи стекинг взаимодействия между ароматическими кольцами фосфотирозин (pTyr) остаток субстрата и остаток Phe182 на петле WPD.[29]
Механизм
Фосфатазная активность PTP1B осуществляется по двухступенчатому механизму.[28] Дефосфорилирование субстрата pTyr происходит на первом этапе, в то время как промежуточные продукты фермента разрушаются на втором этапе. На первом этапе происходит нуклеофильная атака на фосфоцентр восстановленным остатком Cys215 с последующим протонированием Asp181 с образованием нейтрального тирозин фенол. Активный фермент регенерируется после гидролиза промежуточного тиофосфата, чему способствует водородная связь взаимодействия Gln262 и Asp181, которые помогают позиционировать молекулу воды в желаемом месте нуклеофильной атаки.
Регулирование
Остаток Cys215 необходим для ферментативной активности PTP1B, и аналогичные остатки цистеина необходимы для активности других представителей класса I. PTP семья.[30] Форма тиолат-аниона необходима для нуклеофильной активности, но она подвержена окислению активные формы кислорода (АФК) в клетке, что сделает фермент нефункциональным. Было показано, что этот остаток цистеина окисляется при повышенных клеточных концентрациях пероксид водорода (ЧАС2О2), произведенный в ответ на EGF и инсулин сигнализация.[31][32][33] Тиолат окисляется до сульфеновая кислота, который превращается в сульфениламид после реакции с соседним остатком Ser216.[34] Эта модификация остатка Cys215 предотвращает дальнейшее окисление остатка, которое было бы необратимым, а также вызывает структурные изменения в щели активного сайта, так что субстраты могут не связываться.[34][35] Это окисление можно обратить вспять восстановлением за счет глутатион и действует как средство регулирования активности PTP1B.[35] Фосфорилирование остатка Ser50 также было показано как точка аллостерической регуляции PTP1B, в которой фосфорилированное состояние фермента неактивно.[36]
Взаимодействия
PTPN1 показал взаимодействовать с BCAR1,[24] рецептор эпидермального фактора роста,[37][38] Grb2[24][39] и IRS1.[36][39] Рецептор фактора роста эндотелиара сосудов-2 [40] и Фактор роста эндотелия сосудов через PGC1-альфа/ERR-альфа[41]
Клиническое значение
PTP1B имеет клиническое значение для лечения диабет 2 типа а также рак. Исследования нокаута гена, проведенные на мышах, предоставили существенные доказательства роли PTP1B в регуляции инсулин сигнализация и развитие ожирение.[16][17] Мыши с нокаутом PTPN1, содержавшиеся на диете с высоким содержанием жиров, показали устойчивость к ожирение и повышенная степень инсулин чувствительность по сравнению с их дикого типа аналоги.[16][17] Таким образом, разработка и разработка ингибиторов PTP1B является растущей областью исследований для лечения диабет 2 типа и ожирение.[42]
Хотя PTP1B обычно изучается как регулятор метаболизма, некоторые исследования предполагают, что он может играть роль в развитии опухоли, хотя неясно, является ли он онкогенным или подавляющим опухоль, поскольку есть данные в поддержку обоих аргументов. Высокие концентрации АФК в раковых клетках создают среду для потенциальной конститутивной инактивации PTP1B, и это было показано на двух линиях раковых клеток человека. HepG2 и A431, что до 40% остатков Cys215 в PTP1B могут избирательно необратимо окисляться в этих клеточных условиях, что приводит к нефункциональному PTP1B.[43] Кроме того, генетическая абляция PTPN1 в p53 дефицитных мышей приводил к увеличению случаев лимфом и снижению общей выживаемости.[44] Напротив, было показано, что ген PTPN1 сверхэкспрессируется в сочетании с HER2 в рак молочной железы случаи.[8] Мышиные модели HER2 сверхэкспрессия в сочетании с нокаутом PTPN1 приводила к задержке роста опухоли и с меньшим количеством наблюдаемых метастазы в легкие, предполагая, что PTPN1 может иметь онкогенную роль в рак молочной железы.[8][9]
Смотрите также
Рекомендации
- ^ а б c ГРЧ38: Ансамбль выпуск 89: ENSG00000196396 - Ансамбль, Май 2017
- ^ а б c GRCm38: выпуск Ensembl 89: ENSMUSG00000027540 - Ансамбль, Май 2017
- ^ "Справочник человека по PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ "Ссылка на Mouse PubMed:". Национальный центр биотехнологической информации, Национальная медицинская библиотека США.
- ^ Браун-Шимер С., Джонсон К.А., Лоуренс Дж. Б., Джонсон С., Брускин А., Грин Н. Р., Хилл, DE (август 1990 г.). «Молекулярное клонирование и картирование хромосом человеческого гена, кодирующего протеин фосфотирозилфосфатазу 1B». Proc Natl Acad Sci USA. 87 (13): 5148–52. Bibcode:1990PNAS ... 87.5148B. Дои:10.1073 / pnas.87.13.5148. ЧВК 54279. PMID 2164224.
- ^ Combs AP (март 2010 г.). «Последние достижения в открытии конкурентоспособных ингибиторов протеинтирозинфосфатазы 1B для лечения диабета, ожирения и рака». J. Med. Chem. 53 (6): 2333–44. Дои:10.1021 / jm901090b. PMID 20000419.
- ^ Lessard L, Stuible M, Tremblay ML (2010). «Два лица PTP1B в раке». Биохим. Биофиз. Acta. 1804 (3): 613–9. Дои:10.1016 / j.bbapap.2009.09.018. PMID 19782770.
- ^ а б c Бентирес-Элдж М., Нил Б.Г. (2007). «Протеин-тирозинфосфатаза 1B необходима для HER2 / Neu-индуцированного рака груди». Рак Res. 67 (6): 2420–4. Дои:10.1158 / 0008-5472.CAN-06-4610. PMID 17347513.
- ^ а б Жюльен С.Г., Дюбе Н., Рид М., Пенни Дж., Паке М., Хан Й., Кеннеди Б.П., Мюллер В.Дж., Тремблей М.Л. (2007). «Дефицит или ингибирование протеинтирозинфосфатазы 1B задерживает ErbB2-индуцированный онкогенез молочной железы и защищает от метастазов в легкие». Nat. Genet. 39 (3): 338–46. Дои:10,1038 / ng1963. PMID 17259984. S2CID 33612091.
- ^ Тонкс Н.К., Дильтц CD, Фишер Э.Х. (май 1988 г.). «Очистка основных протеин-тирозин-фосфатаз плаценты человека» (PDF). J. Biol. Chem. 263 (14): 6722–30. PMID 2834386.
- ^ а б Тонкс Н.К., Дильтц CD, Фишер Э.Х. (май 1988 г.). «Характеристика основных протеин-тирозин-фосфатаз плаценты человека» (PDF). J. Biol. Chem. 263 (14): 6731–7. PMID 2834387.
- ^ Чернофф Дж., Скивелла А.Р., Йост CA, Эриксон Р.Л., Нил Б.Г. (апрель 1990 г.). «Клонирование кДНК основной протеин-тирозин-фосфатазы человека». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 87 (7): 2735–9. Bibcode:1990PNAS ... 87.2735C. Дои:10.1073 / pnas.87.7.2735. ЧВК 53765. PMID 2157211.
- ^ Frangioni JV, Beahm PH, Shifrin V, Jost CA, Neel BG (февраль 1992 г.). «Нетрансмембранная тирозинфосфатаза PTP-1B локализуется в эндоплазматическом ретикулуме через свою С-концевую последовательность из 35 аминокислот». Клетка. 68 (3): 545–60. Дои:10.1016 / 0092-8674 (92) 90190-Н. PMID 1739967. S2CID 43430621.
- ^ Cicirelli MF, Tonks NK, Diltz CD, Weiel JE, Fischer EH, Krebs EG (июль 1990 г.). «Микроинъекция протеин-тирозин-фосфатазы подавляет действие инсулина в ооцитах Xenopus». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 87 (14): 5514–8. Bibcode:1990PNAS ... 87.5514C. Дои:10.1073 / pnas.87.14.5514. ЧВК 54355. PMID 2164686.
- ^ Сили Б.Л., Стаубс П.А., Райхарт Д.Р., Берхану П., Миларски К.Л., Салтиель А.Р., Кусари Дж., Олефски Дж. М. (октябрь 1996 г.). «Белковая тирозинфосфатаза 1B взаимодействует с активированным рецептором инсулина». Сахарный диабет. 45 (10): 1379–85. Дои:10.2337 / диабет.45.10.1379. PMID 8826975.
- ^ а б c Эльчеблы М., Пайетт П., Михалишин Э., Кромлиш В., Коллинз С., Лой А.Л., Нормандин Д., Ченг А., Химмс-Хаген Дж., Чан С.С., Рамачандран С., Грессер М.Дж., Тремблей М.Л., Кеннеди Б.П. (март 1999 г.). «Повышенная чувствительность к инсулину и устойчивость к ожирению у мышей, лишенных гена протеинтирозинфосфатазы-1B». Наука. 283 (5407): 1544–8. Bibcode:1999Научный ... 283.1544E. Дои:10.1126 / science.283.5407.1544. PMID 10066179.
- ^ а б c Кламан Л.Д., Босс О., Перони О.Д., Ким Дж. К., Мартино Дж. Л., Заболотный Дж. М., Могхал Н., Любкин М., Ким Ю. Б., Шарп А. Х., Стрикер-Кронград А., Шульман Г. И., Нил Б. Г., Кан BB (август 2000 г.). «Повышенное расходование энергии, снижение ожирения и тканеспецифическая чувствительность к инсулину у мышей с дефицитом протеин-тирозинфосфатазы 1B». Мол. Клетка. Биол. 20 (15): 5479–89. Дои:10.1128 / MCB.20.15.5479-5489.2000. ЧВК 85999. PMID 10891488.
- ^ Флинт А.Дж., Тиганис Т., Барфорд Д., Тонкс Н.К. (март 1997 г.). «Разработка« улавливающих субстрат »мутантов для идентификации физиологических субстратов протеинтирозинфосфатаз». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 94 (5): 1680–5. Bibcode:1997PNAS ... 94.1680F. Дои:10.1073 / пнас.94.5.1680. ЧВК 19976. PMID 9050838.
- ^ Бакли Д.А., Ченг А., Кили ПА, Тремблей М.Л., О'Коннор Р. (апрель 2002 г.). «Регулирование активности киназы рецептора инсулиноподобного фактора роста I типа (IGF-I) с помощью протеин-тирозинфосфатазы 1B (PTP-1B) и усиленное IGF-I-опосредованное подавление апоптоза и подвижности в фибробластах с дефицитом PTP-1B». Мол. Клетка. Биол. 22 (7): 1998–2010. Дои:10.1128 / MCB.22.7.1998-2010.2002. ЧВК 133665. PMID 11884589.
- ^ Heinonen KM, Dubé N, Bourdeau A, Lapp WS, Tremblay ML (февраль 2006 г.). «Белковая тирозинфосфатаза 1B отрицательно регулирует развитие макрофагов посредством передачи сигналов CSF-1». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 103 (8): 2776–81. Bibcode:2006PNAS..103.2776H. Дои:10.1073 / pnas.0508563103. ЧВК 1413784. PMID 16477024.
- ^ Zhu S, Bjorge JD, Fujita DJ (ноябрь 2007 г.). «PTP1B способствует онкогенным свойствам клеток рака толстой кишки за счет активации Src». Рак Res. 67 (21): 10129–37. Дои:10.1158 / 0008-5472.CAN-06-4338. PMID 17974954.
- ^ а б Myers MP, Andersen JN, Cheng A, Tremblay ML, Horvath CM, Parisien JP, Salmeen A, Barford D, Tonks NK (декабрь 2001 г.). «TYK2 и JAK2 являются субстратами протеин-тирозинфосфатазы 1B». J. Biol. Chem. 276 (51): 47771–4. Дои:10.1074 / jbc.C100583200. PMID 11694501.
- ^ Чжан З., Лин С.Ю., Нил Б.Г., Хаймович Б. (январь 2006 г.). «Фосфорилированный альфа-актинин и протеин-тирозинфосфатаза 1B корегулируют разборку комплекса фокальной адгезии киназы x Src и способствуют миграции клеток». J. Biol. Chem. 281 (3): 1746–54. Дои:10.1074 / jbc.M509590200. PMID 16291744.
- ^ а б c Лю Ф., Хилл Д.Е., Чернофф Дж. (Декабрь 1996 г.). «Прямое связывание богатой пролином области протеинтирозинфосфатазы 1B с доменом 3 гомологии Src p130 (Cas)». J. Biol. Chem. 271 (49): 31290–5. Дои:10.1074 / jbc.271.49.31290. PMID 8940134.
- ^ Dubé N, Cheng A, Tremblay ML (февраль 2004 г.). «Роль протеинтирозинфосфатазы 1B в передаче сигналов Ras». Proc. Natl. Акад. Sci. СОЕДИНЕННЫЕ ШТАТЫ АМЕРИКИ. 101 (7): 1834–9. Bibcode:2004PNAS..101.1834D. Дои:10.1073 / pnas.0304242101. ЧВК 357013. PMID 14766979.
- ^ Balsamo J, Arregui C, Leung T, Lilien J (октябрь 1998 г.). «Нерецепторный белок тирозинфосфатаза PTP1B связывается с цитоплазматическим доменом N-кадгерина и регулирует связь кадгерин-актин». J. Cell Biol. 143 (2): 523–32. Дои:10.1083 / jcb.143.2.523. ЧВК 2132848. PMID 9786960.
- ^ Stuible M, Dubé N, Tremblay ML (июнь 2008 г.). «PTP1B регулирует фосфорилирование тирозина кортактина, воздействуя на Tyr446». J. Biol. Chem. 283 (23): 15740–6. Дои:10.1074 / jbc.M710534200. ЧВК 3259645. PMID 18387954.
- ^ а б c Тонкс Н.К. (3 июля 2003 г.). «PTP1B: с бровки на передовую!». Письма FEBS. 546 (1): 140–8. Дои:10.1016 / s0014-5793 (03) 00603-3. PMID 12829250. S2CID 21205538.
- ^ а б Барфорд Д., Флинт А.Д., Тонкс Н.К. (март 1994 г.). «Кристаллическая структура протеина тирозинфосфатазы 1B человека». Наука. 263 (5152): 1397–404. Bibcode:1994Научный ... 263.1397B. Дои:10.1126 / science.8128219. PMID 8128219.
- ^ Алонсо А., Сасин Дж., Боттини Н., Фридберг И., Фридберг И., Остерман А., Годзик А., Хантер Т., Диксон Дж., Мустелин Т. (2004). «Белковые тирозинфосфатазы в геноме человека». Клетка. 117 (6): 699–711. Дои:10.1016 / j.cell.2004.05.018. PMID 15186772. S2CID 18072568.
- ^ Махадев К., Зильберинг А., Чжу Л., Гольдштейн Б.Дж. (2001). «Инсулино-стимулированная перекись водорода обратимо ингибирует протеин-тирозинфосфатазу 1b in vivo и усиливает ранний каскад действия инсулина». J. Biol. Chem. 276 (24): 21938–42. Дои:10.1074 / jbc.C100109200. PMID 11297536.
- ^ Ли С.Р., Квон К.С., Ким С.Р., Ри С.Г. (июнь 1998 г.). «Обратимая инактивация протеин-тирозинфосфатазы 1B в клетках A431, стимулированных эпидермальным фактором роста». J. Biol. Chem. 273 (25): 15366–72. Дои:10.1074 / jbc.273.25.15366. PMID 9624118.
- ^ Сундаресан М., Ю. З. X, Ферранс В. Дж., Ирани К., Финкель Т. (октябрь 1995 г.). «Потребность в генерации H2O2 для передачи сигнала тромбоцитарного фактора роста». Наука. 270 (5234): 296–9. Bibcode:1995Научный ... 270..296С. Дои:10.1126 / science.270.5234.296. PMID 7569979. S2CID 8065388.
- ^ а б Салмин А., Андерсен Дж. Н., Майерс М. П., Мэн Т. К., Хинкс Дж. А., Тонкс Н. К., Барфорд Д. (2003). «Редокс-регуляция протеинтирозинфосфатазы 1B включает сульфениламидный промежуточный продукт». Природа. 423 (6941): 769–73. Bibcode:2003Натура.423..769С. Дои:10.1038 / природа01680. PMID 12802338. S2CID 4416512.
- ^ а б ван Монфорт Р.Л., Конгрев М., Тиси Д., Карр Р., Джоти Х. (2003). «Состояние окисления цистеина активного центра в протеинтирозинфосфатазе 1B». Природа. 423 (6941): 773–7. Bibcode:2003Натура.423..773В. Дои:10.1038 / природа01681. PMID 12802339. S2CID 4424814.
- ^ а б Равичандран Л.В., Чен Х., Ли Й., Куон М.Дж. (октябрь 2001 г.). «Фосфорилирование PTP1B по Ser (50) с помощью Akt снижает его способность дефосфорилировать рецептор инсулина». Мол. Эндокринол. 15 (10): 1768–80. Дои:10.1210 / исправление.15.10.0711. PMID 11579209.
- ^ Сармиенто М., Пуйус Ю.А., Веттер С.В., Кенг Ю.Ф., Ву Л., Чжао Ю., Лоуренс Д.С., Альмо С.К., Чжан З.Й. (июль 2000 г.). «Структурные основы пластичности в распознавании субстрата протеинтирозинфосфатазы 1B». Биохимия. 39 (28): 8171–9. Дои:10.1021 / bi000319w. PMID 10889023.
- ^ Чжан З.Й., Уолш А.Б., Ву Л., Макнамара Д.Д., Добрусин Е.М., Миллер В.Т. (март 1996 г.). «Детерминанты распознавания субстрата в протеин-тирозинфосфатазе, PTP1». J. Biol. Chem. 271 (10): 5386–92. Дои:10.1074 / jbc.271.10.5386. PMID 8621392.
- ^ а б Гольдштейн Б.Дж., Биттнер-Ковальчик А., Уайт М.Ф., Харбек М. (февраль 2000 г.). «Дефосфорилирование тирозина и дезактивация субстрата-1 рецептора инсулина протеин-тирозинфосфатазой 1B. Возможное облегчение за счет образования тройного комплекса с адаптерным белком Grb2». J. Biol. Chem. 275 (6): 4283–9. Дои:10.1074 / jbc.275.6.4283. PMID 10660596.
- ^ Ланахан А.А., Лех Д., Дубрак А., Чжан Дж., Чжуан З.В., Эйхманн А., Саймонс М. (сентябрь 2014 г.). «PTP1b является физиологическим регулятором передачи сигналов фактора роста эндотелия сосудов в эндотелиальных клетках». Тираж. 130 (11): 902–9. Дои:10.1161 / CIRCULATIONAHA.114.009683. ЧВК 6060619. PMID 24982127.
- ^ Фигейредо Х., Фигероа А.Л., Гарсия А., Фернандес-Руис Р., Брока С., Войтущишин А. и др. (Июнь 2019). «Нацеливание на панкреатический островок PTP1B улучшает реваскуляризацию островкового трансплантата и результаты трансплантации». Научная трансляционная медицина. 11 (497): eaar6294. Дои:10.1126 / scitranslmed.aar6294. HDL:10609/103266. PMID 31217339. S2CID 195188512.
- ^ Thareja S, Aggarwal S, Bhardwaj TR, Kumar M (2012). «Ингибиторы протеинтирозинфосфатазы 1B: законный подход на молекулярном уровне для управления сахарным диабетом». Med Res Rev. 32 (3): 459–517. Дои:10.1002 / med.20219. PMID 20814956. S2CID 23121386.
- ^ Тонкс Н.К. (2013). «Белковые тирозинфосфатазы - от домашних ферментов до основных регуляторов передачи сигналов». FEBS J. 280 (2): 346–78. Дои:10.1111 / фев.12077. ЧВК 3662559. PMID 23176256.
- ^ Dubé N, Bourdeau A, Heinonen KM, Cheng A, Loy AL, Tremblay ML (2005). «Генетическое удаление протеинтирозинфосфатазы 1B ускоряет лимфомагенез p53-нулевых мышей за счет регуляции развития B-клеток». Рак Res. 65 (21): 10088–95. Дои:10.1158 / 0008-5472.CAN-05-1353. PMID 16267035.