WikiDer > Оксид галлия (III)
 β-Ga2О3 кристалл | |
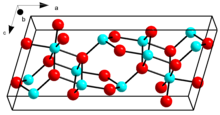 Кристаллическая структура β-Ga2О3 | |
| Имена | |
|---|---|
| Другие имена триоксид галлия, полуторный оксид галлия | |
| Идентификаторы | |
3D модель (JSmol) | |
| ChemSpider | |
| ECHA InfoCard | 100.031.525 |
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| |
| |
| Характеристики | |
| Ga2О3 | |
| Молярная масса | 187,444 г / моль[1] |
| Внешность | белый кристаллический порошок |
| Плотность | 6,44 г / см3, альфа 5,88 г / см3, бета |
| Температура плавления | 1900 ° C (3450 ° F, 2170 K) альфа 1725 ° C, бета [2] |
| нерастворимый | |
| Растворимость | растворим в большинстве кислоты |
| Ширина запрещенной зоны | 4,7-4,9 эВ (β-Ga2О3) |
| Структура | |
| α: Тригональный, 30 грн., космическая группа = R3с, № 167[3] β: Моноклиника, мс20, космическая группа = C2 / м, № 12[4] | |
а = 0,49835 / 1,22247 нм, б = 0,49835 / 0,30403 нм, c = 0,53286 / 0,58088 нм | |
Формула единиц (Z) | 6 / 4 |
| Термохимия | |
Теплоемкость (C) | 92,1 Дж / моль · К[5] |
Стандартный моляр энтропия (S | 85,0 Дж / моль · К[5] |
Станд. Энтальпия формирование (ΔжЧАС⦵298) | -1089,1 кДж / моль[5] |
Свободная энергия Гиббса (Δжграмм˚) | -998,3 кДж / моль[5] |
| Опасности | |
Классификация ЕС (DSD) (устарело) | нет в списке |
Если не указано иное, данные для материалов приводятся в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Триоксид галлия (III) является неорганическое соединение с формулой Ga2О3. Он существует как несколько полиморфы, все они представляют собой белые нерастворимые в воде твердые вещества. Хотя коммерческих приложений не существует, Ga2О3 является промежуточным продуктом очистки галлия, который потребляется почти исключительно в виде арсенид галлия.[6] Теплопроводность β-Ga2О3 по крайней мере на порядок меньше, чем у других широкозонных полупроводников, таких как GaN и SiC.[7] Он дополнительно уменьшается для родственных наноструктур, которые обычно используются в электронных устройствах.[7] Гетерогенная интеграция с подложками с высокой теплопроводностью, такими как алмаз и SiC, способствует рассеиванию тепла β-Ga2О3 электроника.[8] [9]
Подготовка
Триоксид галлия осаждается в гидратированной форме при нейтрализация кислого или основного раствора соли галлия. Также он образуется при нагревании галлия на воздухе или при термическом разложении нитрата галлия при 200–250 ˚C. Он может иметь пять различных модификаций: α, β, γ, δ и ε. Из этих модификаций β-Ga2О3 самая устойчивая форма.[10]
- β-Ga2О3 готовится нагреванием нитрата, ацетата, оксалата или других органических производных выше 1000 ° C. Эпитаксиальный тонкие пленки β-Ga2О3 может быть нанесен на сапфировую подложку при температуре от 190 ° C до 550 ° C.[11]
- α-Ga2О3 может быть получен нагреванием β-Ga2О3 при 65 кбар и 1100 ° C. Гидратированная форма может быть получена разложением осажденного и "выдержанного" гидроксида галлия при 500 ° C.
- γ-Ga2О3 готовится путем быстрого нагревания геля гидроксида при 400–500 ° C. Более кристаллическая форма этого полиморфа может быть получена непосредственно из металлического галлия путем сольвотермического синтеза.[12]
- δ-Ga2О3 получается нагреванием Ga (NO3)3 при 250 ° С.
- ε-Ga2О3 готовится нагреванием δ-Ga2О3 при 550 ° С.[10] Тонкие пленки ε-Ga2О3 депонируются посредством эпитаксия из паровой фазы металлоорганических соединений с помощью триметилгаллий и вода на сапфировых подложках при температуре от 550 до 650 ° C [13]
Реакции
Триоксид галлия (III) - это амфотерный.[14] Он реагирует с щелочной металл оксиды при высокой температуре с образованием, например, NaGaO2, а также с оксидами Mg, Zn, Co, Ni, Cu с образованием шпинель, например MgGa2О4.[15]Он растворяется в сильной щелочи с образованием раствора галлат-иона, Ga (OH)−
4.
С HCl образует трихлорид галлия GaCl3.[16]
- Ga2О3 + 6 HCl → 2 GaCl3 + 3 часа2О
Его можно свести к недокись галлия (оксид галлия (I)) Ga2O by H2.[17] или реакцией с металлическим галлием:[18]
- Ga2О3 + 2 часа2 → Ga2O + 2 H2О
- Ga2О3 + 4 млрд лет → 3 млрд лет2О
Структура
β-Ga2О3, с температурой плавления 1900 ˚C, является наиболее стабильной кристаллической модификацией. Ионы оксида находятся в искаженной кубической структуре плотнейшей упаковки, а ионы галлия (III) занимают искаженные тетраэдрические и октаэдрические позиции с расстояниями связей Ga-O 1,83 и 2,00 Å соответственно.[19]
α-Ga2О3 имеет такую же структуру (корунд) в качестве α-Al2О3, при этом ионы Ga являются 6-координатными. γ-Ga2О3 имеет дефектную структуру шпинели, аналогичную структуре γ-Al2О3.[20]
ε-Ga2О3 пленки, депонированные эпитаксия из паровой фазы металлоорганических соединений показать столбчатую структуру с орторомбическая симметрия кристалла. Макроскопически эту структуру видит Рентгеновская кристаллография в качестве гексагональный плотно упакованный.[21]
Возможные приложения
Оксид галлия (III) был изучен при использовании лазеров, люминофоров и люминесцентных материалов.[10] Он также использовался в качестве изолирующего барьера в плотных соединениях.[22] Моноклинный β-Ga2О3 используется в газовых сенсорах и люминесцентных люминофор и может наноситься на диэлектрические покрытия для солнечные батареи. Этот стабильный оксид также показал потенциал для прозрачных для глубокого ультрафиолета проводящих оксидов,[23] и транзисторные приложения.[24][25]
ε-Ga2О3 тонкие пленки, нанесенные на сапфир, могут использоваться в качестве солнцезащитных УФ-лучей. фотоприемник.[26]
Тонкий Ga2О3 пленки представляют коммерческий интерес как газочувствительные материалы и Ga2О3. Эллипсометрия представляет собой процедуру, которую можно использовать для определения оптических функций β-Ga2О3.[11][23]
β-Ga2О3 используется в производстве Ga2О3-Al2О3 катализатор.[27]
Рекомендации
- ^ Хейнс, Уильям М., изд. (2011). CRC Справочник по химии и физике (92-е изд.). Бока-Ратон, Флорида: CRC Press. п. 4.64. ISBN 1439855110.
- ^ Патнаик, Прадёт (2002) Справочник неорганических химикатов. Макгроу-Хилл. ISBN 0-07-049439-8
- ^ Eckert, L.J .; Брэдт, Р. (1973). «Термическое расширение Alpha Ga2О3". Журнал Американского керамического общества. 56 (4): 229. Дои:10.1111 / j.1151-2916.1973.tb12471.x.
- ^ Dohy, D .; Гаварри, Дж. Р. (1983). «Оксид β-Ga2О3: Champ de force, термическое расширение и анизотропы жесткости ». Журнал химии твердого тела. 49 (1): 107–117. Bibcode:1983JSSCh..49..107D. Дои:10.1016/0022-4596(83)90222-0.
- ^ а б c d Хейнс, Уильям М., изд. (2011). CRC Справочник по химии и физике (92-е изд.). Бока-Ратон, Флорида: CRC Press. п. 5.12. ISBN 1439855110.
- ^ Гребер, Дж. Ф. (2012) «Галлий и соединения галлия» в Энциклопедии промышленной химии Ульмана, Wiley-VCH, Weinheim, Дои:10.1002 / 14356007.a12_163.
- ^ а б Ченг, Чжэ; Танен, Николас; Чанг, Селеста; Ши, Цзинцзин; МакКэндлесс, Джонатан; Мюллер, Дэвид; Йена, Дебдип; Син, Хуэйли Грейс; Грэм, Сэмюэл (26 августа 2019 г.). «Значительно сниженная теплопроводность в сверхрешетках β- (Al0.1Ga0.9) 2O3 / Ga2O3». Письма по прикладной физике. 115 (9): 092105. Дои:10.1063/1.5108757. ISSN 0003-6951.
- ^ Ченг, Чжэ; Йейтс, Люк; Ши, Цзинцзин; Tadjer, Marko J .; Хобарт, Карл Д .; Грэм, Сэмюэл (1 марта 2019 г.). «Теплопроводность гетерогенных границ раздела β-Ga2O3-алмаз Ван-дер-Ваальса». Материалы APL. 7 (3): 031118. Дои:10.1063/1.5089559.
- ^ Ченг, Чжэ; Му, Фенвен; Ты, Тяньгуй; Сюй, Вэньхуэй; Ши, Цзинцзин; Liao, Michael E .; Ван, Екан; Huynh, Кенни; Шуга, Тадатомо; Гоорский, Марк С .; Оу, Синь (7 октября 2020 г.). «Тепловой перенос через тонкие пленки монокристаллического β-Ga2O3 с ионной резкой и связанные границы раздела β-Ga2O3 – SiC». Прикладные материалы и интерфейсы ACS. 12 (40): 44943–44951. Дои:10.1021 / acsami.0c11672. ISSN 1944-8244.
- ^ а б c Байлар, Дж; Emeléus, H; Nyholm, R; Тротман-Дикенсон, А.Ф. (1973). Комплексная неорганическая химия. Vol. 1, стр. 1091
- ^ а б Rafie Borujeny, E .; Сендецкий, О .; Fleischauer, M.D .; Кадиен, К. С. (2020). "Гетероэпитаксиальные тонкие пленки оксида галлия с низким тепловым бюджетом, обеспечиваемые осаждением атомного слоя". Прикладные материалы и интерфейсы ACS. 12 (39). Дои:10.1021 / acsami.0c08477. PMID 32865966.
- ^ Плейфорд, Хелен Ю.; Хэннон, Алекс С .; Барни, Эмма Р .; Уолтон, Ричард И. (2013). «Структуры не охарактеризованных полиморфов триоксида галлия по полной нейтронной дифракции». Химия - Европейский журнал. 19 (8): 2803–13. Дои:10.1002 / chem.201203359. PMID 23307528.
- ^ Boschi, F .; Bosi, M .; Берзина, Т .; Buffagni, E .; Ferrari, C .; Форнари, Р. (2015). «Гетероэпитаксия ε-Ga2О3 слои MOCVD и ALD ». Журнал роста кристаллов. 44: 25–30. Дои:10.1016 / j.jcrysgro.2016.03.013.
- ^ Эббинг, Даррелл Д.; Гаммон, Стивен Д. (2010) Общая химия, 9-е изд., Томсон Брукс / Коул. ISBN 0538497521
- ^ Даунс, Энтони Джон (редактор) (1993) Химия алюминия, галлия, индия и таллия. Springer. ISBN 075140103X
- ^ Цукерман, Дж. Дж. И Хаген, изд. (2009) Неорганические реакции и методы, образование связей с галогенами. (Часть 2), Wiley-VCH Verlag GmbH, ISBN 9780470145395
- ^ Koch, H. F .; Girard, L.A .; Раундхилл, Д. М. (1999). «Определение галлия в суррогате церия и в каплях из медного коллектора с помощью ICP в качестве модельных исследований для удаления галлия из плутония». Атомная спектроскопия. 20 (1): 30.
- ^ Greenwood, N.N .; Эмелей, Х. Дж. И Шарп, А. Г. (1963) "Химия галлия" в Успехи неорганической химии и радиохимии, Vol. 5, Elsevier, Academic Press
- ^ Кинг, Р. Б. (1994) Энциклопедия неорганической химии. Vol. 3. п. 1256. ISBN 978-0-470-86078-6.
- ^ Гринвуд, Норман Н.; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн. п. 247. ISBN 978-0-08-037941-8.
- ^ Кора, я (2017). «Реальная структура ε-Ga2О3 и его связь с κ-фазой ". CrystEngComm. 19 (11): 1509–1516. Дои:10.1039 / C7CE00123A.
- ^ Dai, Z. R .; Pan, Z. W .; Ван, З. Л. (2002). «Наноленты и нанолисты оксида галлия». Журнал физической химии B. 106 (5): 902. CiteSeerX 10.1.1.655.6068. Дои:10.1021 / jp013228x.
- ^ а б Ребиен, М; Генрион, Вт; Hong, M; Mannaerts, J; Флейшер, М. (2002). «Оптические свойства тонких пленок оксида галлия». Письма по прикладной физике. 81 (2): 250. Bibcode:2002АпФЛ..81..250Р. Дои:10.1063/1.1491613.
- ^ Thomas, Stuart R .; Адамопулос, Джордж; Линь, Йен-Хунг; Фабер, Хендрик; Сигеллу, Лабрини; Стратакис, Эммануэль; Пляцикас, Никос; Patsalas, Panos A .; Антопулос, Томас Д. (2014). «Тонкопленочные транзисторы с высокой подвижностью электронов на основе Ga2О3 выращены методом пиролиза в атмосфере ультразвукового распыления при низких температурах ». Письма по прикладной физике. 105 (9): 092105. Bibcode:2014АпФЛ.105и2105Т. Дои:10.1063/1.4894643.
- ^ Higashiwaki, M .; Джессен, Г. Х. (2018). «Заря микроэлектроники на основе оксида галлия». Письма по прикладной физике. 112 (6): 060401. Дои:10.1063/1.5017845.
- ^ Павеси, М. (2018). "ε-Ga2О3 эпитаксиальные слои как материал для солнцезащитных УФ-фотоприемников ». Химия и физика материалов. 205: 502–507. Дои:10.1016 / j.matchemphys.2017.11.023.
- ^ Симидзу, Кен-Ичи; Такамацу, Микио; Ниси, Кодзи; Ёсида, Хисао; Сацума, Ацуши; Танака, Цунехиро; Ёсида, Сатохиро; Хаттори, Тадаши (1999). "Катализаторы на основе триоксида галлия на основе оксида алюминия для селективного восстановления NO: влияние локальной структуры поверхностных частиц триоксида галлия на каталитическую активность". Журнал физической химии B. 103 (9): 1542. Дои:10.1021 / jp983790w.