WikiDer > Фенилпропаноид
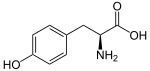
В фенилпропаноиды представляют собой разнообразное семейство органических соединений, которые синтезируются растениями из аминокислоты фенилаланин и тирозин.[1] Их название происходит от шестиуглеродной ароматической фенильной группы и трехуглеродного пропенового хвоста. кумаровая кислота, который является центральным промежуточным звеном в биосинтез фенилпропаноидов. От 4-кумароил-КоА излучает биосинтез множества натуральных продуктов, включая лигнолы (предшественники лигнин и лигноцеллюлоза), флавоноиды, изофлавоноиды, кумарины, ауроны, стильбены, катехин, и фенилпропаноиды.[2] Кумароиловый компонент получают из коричная кислота.

Фенилпропаноиды встречаются во всем царстве растений, где они служат важными компонентами ряда структурных полимеров, обеспечивают защиту от ультрафиолетовое излучение, защищаться от травоядные животные и патогены, и посредник растений-опылитель взаимодействия как цветочные пигменты и ароматические соединения.
Гидроксикоричные кислоты
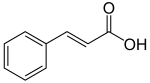
Фенилаланин сначала превращается в коричная кислота действием фермент фенилаланин аммиак-лиаза (PAL). Некоторые растения, в основном однодольные, используйте тирозин синтезировать п-кумаровая кислота под действием бифункционального фермента Фенилаланин / тирозин-аммиак-лиаза (PTAL). Серия ферментативных гидроксилирование и метилирования приводит к кумаровая кислота, кофейная кислота, феруловая кислота, 5-гидроксиферуловая кислота, и синапиновая кислота. Превращение этих кислот в соответствующие им сложные эфиры производит некоторые из летучих компонентов травы и цветов ароматы, которые выполняют множество функций, например привлекают опылители. Этилциннамат это типичный пример.
Коричные альдегиды и монолигнолы
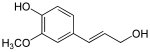
Сокращение карбоновая кислота функциональные группы коричных кислот обеспечивают соответствующие альдегиды, такие как коричный альдегид. Дальнейшее сокращение обеспечивает монолигнолы в том числе кумариловый спирт, конифериловый спирт, и синапиловый спирт, которые различаются только степенью метоксилирование. Монолигнолы - это мономеры, которые полимеризованный для создания различных форм лигнин и Суберин, которые используются как структурный компонент стенок растительных клеток.
В фенилпропены, в том числе эвгенол, шавикол, сафрол и эстрагола, также являются производными монолигнолов. Эти соединения являются основными составляющими различных эфирные масла.
Кумарины и флавоноиды
Гидроксилирование коричная кислота в позиции 4 транс-циннамат-4-монооксигеназа приводит к п-куаровая кислота, которые могут быть далее модифицированы в гидроксилированные производные, такие как умбеллиферон. Другое использование п-куаровая кислота через ее тиоэфир с участием кофермент А, т.е. 4-кумароил-КоА, это производство халконы. Это достигается добавлением 3 малонил-КоА молекулы и их циклизация в секунду фенил группа. Халконы являются предшественниками всех флавоноиды, разнообразный класс фитохимические вещества.
Стилбеноиды
Стилбеноиды, такие как ресвератрол, являются гидроксилированными производными стильбен. Они образуются путем альтернативной циклизации циннамоил-КоА или 4-кумароил-КоА.
Спорополленин
Фенилпропаноиды и другие фенольные смолы входят в химический состав спорополленин. Это связано с Cutin и Суберин.[2] Это плохо определенное вещество, обнаруженное в пыльце, необычайно устойчиво к разложению. Анализы выявили смесь биополимеры, содержащие в основном гидроксилированные жирные кислоты, фенилпропаноиды, фенолы и следы каротиноиды. Трассирующие эксперименты показали, что фенилаланин является основным предшественником, но другие источники углерода также вносят свой вклад. Вероятно, что спорополленин является производным нескольких предшественников, которые химически сшиты, образуя жесткую структуру.
Смотрите также
Смотрите также
использованная литература
- ^ Баррос Дж., Серрани-Ярс Дж. К., Чен Ф., Бакстер Д., Венейблс Б. Дж., Диксон Р. А. (2016). «Роль бифункциональной аммиак-лиазы в биосинтезе клеточной стенки травы». Nat. Растения. 2: 16050. Дои:10.1038 / nplants.2016.50. PMID 27255834.CS1 maint: несколько имен: список авторов (ссылка на сайт)
- ^ а б Фогт, Т. (2010). «Биосинтез фенилпропаноидов». Молекулярный завод. 3: 2–20. Дои:10,1093 / мп / ссп106. PMID 20035037.
- К. Халброк, Д. Шил (1989). «Физиология и молекулярная биология метаболизма фенилпропаноидов». Ежегодный обзор физиологии растений и молекулярной биологии растений. 40: 347–69. Дои:10.1146 / annurev.pp.40.060189.002023.